| |
| Med Sci (Paris). 33: 55–56. doi: 10.1051/medsci/201733s111.Myopathie GNE : L’échec avéré de l’acide sialique… et après ? Sylvie Marion,1* Anthony Béhin,2 and Shahram Attarian3,4 1AFM-Téléthon, Évry, France 2Centre de Référence de Pathologie Neuromusculaire Paris-Est, Institut de Myologie, GH Pitié-Salpêtrière, Paris, France 3Centres de référence des maladies neuromusculaires et SLA, CHU La Timone, Marseille, France 4Pôle Neurosciences Cliniques, Aix-Marseille Université, France |
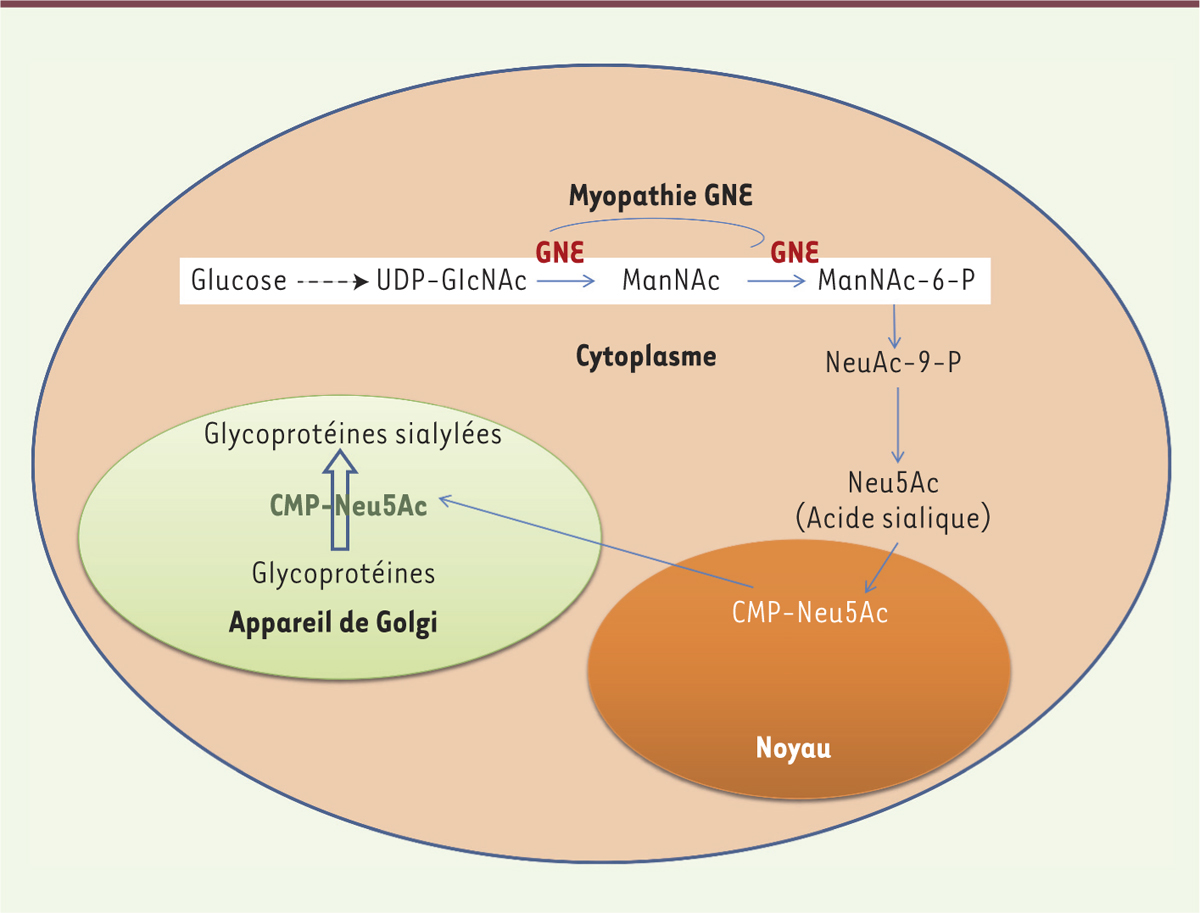
L’appellation unique de myopathie GNE fait désormais consensus [1]. Elle recouvre celles de myopathie distale de type Nonaka, de myopathie épargnant le quadriceps, de myopathie à inclusions autosomique récessive (hIBM) et de myopathie distale à vacuoles bordées. Décrite pour la première fois en 1981, cette maladie autosomique récessive résulte de mutations du gène GNE. Situé sur le chromosome 9, il code l’UDP-N-acétylglucosamine-2-épimérase/N-acétylmannosamine kinase. Cette protéine exerce deux activités enzymatiques (épimérase et kinase) sur la voie de synthèse endogène de l’acide sialique, ou acide N-acétylneuraminique. La mutation du gène GNE entraîne une réduction de 30 à 60 % du taux d’acide sialique dans les muscles atteints [2]. Le constat de cette hyposialylation, même si son rôle pathogénique exact reste mal connu, a légitimé l’essai d’un traitement substitutif. |
Une idée séduisante mais des résultats décevants L’apport d’acide sialique chez l’animal (souris transgéniques) avait des effets prometteurs [3, 4]. Chez l’homme, l’administration intraveineuse d’immunoglobulines, dont la concentration en acide sialique atteint 8 µmoles/g, a été évaluée dès 2005 chez quatre patients porteurs d’une myopathie GNE [5]. Leur amélioration clinique ne s’est pas accompagnée de modifications histologiques en faveur d’une augmentation de la sialylation musculaire. Néanmoins, cette étude à faible effectif n’était pas contrôlée et surtout s’appuyait, pour évaluer l’efficacité, sur la mesure de la force du quadriceps. Or ce muscle est quasi constamment épargné dans la myopathie GNE. L’acide sialique ayant une demi-vie très courte, le laboratoire Ultragenyx en a développé une forme retard, objet en 2012 d’un essai clinique de phase II contre placebo sur 47 patients, aux États-Unis et en Israël. Deux dosages (3 et 6 g/jour) ont été testés, avec une amélioration significative du score composite des membres supérieurs (upper extremity composite ou UEC score) [6], des résultats suffisants pour initier en 2015 un essai international de phase III. Randomisé, et en double aveugle, il a porté sur l’administration per os de 6 g par jour d’acide sialique retard ou d’un placebo à 89 patients capables de marcher 200 mètres ou plus au test des six minutes de marche. Le critère de jugement primaire était identique à celui de la phase II : l’amélioration de la force aux membres supérieurs (UEC score). Les critères secondaires consistaient en l’amélioration de la force musculaire aux membres inférieurs et d’un score spécifique développé par Ultragenyx (GNE myopathy functional activity scale ou GNEM-FAS). Les résultats ont été annoncés par un communiqué de presse du laboratoire américain en date du 22 août 20171. Sur les critères primaires comme les critères secondaires, il n’existe aucune différence significative entre le groupe de patients traités par l’acide sialique et le groupe placebo. Ultragenyx a arrêté le développement de la molécule. |
Mais d’autres approches thérapeutiques sont d’ores et déjà explorées, à commencer par l’utilisation du ManNAc (N-acétylmannosamine), un précurseur de l’acide sialique en cours de développement. Lors d’un essai clinique de phase I, randomisé en double aveugle contre placebo [7], l’administration d’une dose unique de 3, 6 ou 10 g de ManNAc a entraîné une augmentation de sa concentration sanguine et une production d’acide sialique. Ce précurseur a donc été utilisé par la cellule. Un essai clinique de phase II est en cours au National Institutes of Health Clinical Center (Bethesda, États-Unis). Il porte sur une administration orale biquotidienne de 6 g de ManNAc chez 12 patients atteints d’une myopathie GNE. Les premiers résultats, à 12 mois, ont été présentés l’an passé. Ils sont plutôt favorables avec un impact sur la force musculaire jugé significatif par les auteurs, mais qui reste à confirmer par un essai randomisé sur davantage de patients. Certaines souris ayant développé des tumeurs sous ManNAc, des solides essais de tumorigenèse sont également nécessaires avant d’envisager une utilisation au long cours chez des patients jeunes.
 | Figure 1.
Voie de biosynthèse de l’acide sialique. |
|
Au-delà de la sialylation Comme de nombreuses maladies neuromusculaires, la myopathie GNE fait aussi l’objet d’essais de thérapie génique, pour l’heure au stade préclinique. Chez la souris, l’injection d’un virus adéno-associé (adeno-associated virus ou AAV) apportant le gène GNE humain permet une expression durable et sûre de la protéine, et pas seulement dans le muscle injecté [8]. À noter qu’une approche par lipoplex, qui consiste à associer le gène à un liposome, a été testée en 2011 chez une patiente, avec une efficacité probable (expression du gène) mais des effets secondaires non négligeables [9]. De nouvelles pistes thérapeutiques pourraient émerger très bientôt grâce à la recherche fondamentale, clé d’une meilleure connaissance des processus pathogènes de la maladie. Le stress oxydatif pourrait en faire partie, qui apparaît de façon précoce. Une équipe israélienne a mis au jour d’autres mécanismes secondaires potentiels par l’observation du profil protéomique des biopsies musculaires de patients atteints d’une myopathie GNE [10]. Elle a ainsi identifié des variations dans l’expression de nombreuses protéines, impliquées dans des mécanismes cellulaires aussi divers que l’organisation du cytosquelette et le fonctionnement énergétique, avec des anomalies mitochondriales. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les don- nées publiées dans cet article.
|
Footnotes |
1.
Huizing M, Carrillo-Carrasco N, Malicdan MC, et al. GNE myopathy: new name and new mutation nomenclature . Neuromuscul Disord. 2014; ; 24 : :387.–389. 2.
Urtizberea JA, Béhin A. Myopathie GNE. Les Cahiers de Myologie. 2015; ; 31 : :20.–27. 3.
Malicdan MC, Noguchi S, Nonaka I, et al. A Gne knockout mouse expressing human GNE D176V mutation develops features similar to distal myopathy with rimmed vacuoles or hereditary inclusion body myopathy . Hum Mol Genet. 2007; ; 16 : :2669.–2682. 4.
Malicdan MC, Noguchi S, Nishino I. A preclinical trial of sialic acid metabolites on distal myopathy with rimmed vacuoles/hereditary inclusion body myopathy, a sugar-deficient myopathy: a review . Ther Adv Neurol Disord. 2010; ; 3 : :127.–135. 5.
Sparks S, Rakocevic G, Joe G, et al. Intravenous immune globulin in hereditary inclusion body myopathy: a pilot study . BMC Neurol. 2007; ; 7 : :3.. 6.
Argov Z, Caraco Y, Lau H, et al. Aceneuramic acid extended release administration maintains upper limb muscle strength in a 48-week study of subjects with GNE myopathy: results from a phase 2, randomized, controlled study . J Neuromuscul Dis. 2016; ; 3 : :49.–66. 7.
Xu X, Wang AQ, Latham LL, et al. Safety, pharmacokinetics and sialic acid production after oral administration of N-acetylmannosamine (ManNAc) to subjects with GNE myopathy . Mol Genet Metab. 2017; ; 122 : :126.–134. 8.
Mitrani-Rosenbaum S, Yakovlev L, Becker Cohen M, et al. Sustained expression and safety of human GNE in normal mice after gene transfer based on AAV8 systemic delivery . Neuromuscul Disord. 2012; ; 22 : :1015.–1024. 9.
Nemunaitis G, Jay CM, Maples PB, et al. Hereditary inclusion body myopathy: single patient response to intravenous dosing of GNE gene lipoplex . Hum Gene Ther. 2011; ; 22 : :1331.–1341. 10.
Sela I, Milman Krentsis I, Shlomai Z, et al. The proteomic profile of hereditary inclusion body myopathy . PLoS One. 2011; ; 6 : :e16334.. |