| |
| Med Sci (Paris). 33(8-9): 694–697. doi: 10.1051/medsci/20173308003.La dysplasie épithéliale intestinale, ou quand l’intestin est sous « deux de tension » cellulaire Cécile Gaston,1 Julie Salomon,1,2 Olivier Goulet,2 and Delphine Delacour1* 1Adhérence cellulaire et mécanique, Institut Jacques Monod, CNRS UMR7592, Université Paris Diderot, 15, rue Hélène Brion, 75013Paris, France 2Département de gastroentérologie pédiatrique et nutrition, Hôpital Necker-Enfants Malades, Sorbonne Paris Cité, 149, rue de Sèvres, 75015Paris, France |
L’épithélium intestinal, une monocouche épithéliale polarisée dynamique Une monocouche épithéliale est sujette au remodelage lors du développement ou d’événements de réparation tissulaire ; un renouvellement cellulaire, des réarrangements ainsi que des phénomènes d’extrusion adviennent constamment pour maintenir l’homéostasie de cette monocouche. Un épithélium doit donc stabiliser son organisation et s’adapter de façon globale, pour maintenir son état polarisé et cohésif. L’épithélium intestinal constitue un très bon modèle pour étudier différentes questions d’organisation tissulaire et cellulaire. La monocouche de cellules épithéliales qui tapisse l’intestin grêle présente une architecture simple et régulière, où les cellules prolifératives et les cellules différenciées sont distribuées dans des compartiments tissulaires différents : respectivement, les « cryptes » et les « villosités ». Tandis que les entérocytes évoluent le long de la villosité, les cellules suivent un processus d’organisation spécifique, appelé différenciation terminale, avec la formation d’une structure fonctionnelle au cortex apical, la bordure en brosse des microvillosités ; celle-ci expose les enzymes intestinales, augmente la surface membranaire au pôle apical et potentialise ainsi l’absorption de nutriments à l’interface entre la lumière de l’intestin et l’épithélium [1, 2]. |
EpCAM, un acteur clé dans le maintien de la monocouche épithéliale intestinale Les entéropathies congénitales présentent des perturbations de l’organisation de l’épithélium intestinal le long de l’axe crypto-villositaire et sont, pour la plupart, responsables d’insuffisance intestinale. Deux d’entre elles sont particulièrement sévères : l’atrophie microvillositaire (AMV) et la dysplasie épithéliale intestinale (DEI en français, CTE pour congenital tufting enteropathy, en anglais) [3]. La DEI a été décrite pour la première fois en 1994 [4] et plus en détail en 1995 [5]. Cette entéropathie est moins fréquente que l’AMV, avec une incidence estimée à 1/200 000 en Europe. La DEI est histologiquement définie par un épithélium dysplasique caractéristique, prenant de façon hétérogène un aspect pseudo-stratifié où les entérocytes s’accumulent sous forme de houppettes ou « tufts » [6], qui touchent jusqu’à 70 % des villosités à un stade avancé [6]. La preuve directe de la participation d’EpCAM (epithelial cell adhesion molecule) dans le maintien de la monocouche épithéliale intestinale a été fournie par une récente étude clinique où des mutations faux-sens ou non-sens du gène EPCAM, conduisant respectivement à la perte d’expression ou à des formes tronquées de la protéine, ont été corrélées au développement de la DEI chez 73 % des patients [7]. EpCAM est une protéine spécifiquement exprimée dans les épithéliums monostratifiés [8]. Des défauts de son expression perturbent l’homéostasie des tissus épithéliaux ; elle est par ailleurs surexprimée dans de nombreux carcinomes, et représente un marqueur pour la détection et le suivi des tumeurs épithéliales [9, 10]. EpCAM a été initialement décrite comme une molécule d’adhésion cellulaire [8], mais, malgré un rôle évident dans le maintien de l’intégrité épithéliale, ses mécanismes d’action précis dans les cellules épithéliales ont été peu décrits. |
EpCAM préserve l’organisation apico-basale des entérocytes Un travail récent, réalisé dans notre laboratoire, a apporté de nouvelles informations sur le rôle d’EpCAM dans l’épithélium intestinal [11] (→). Les analyses de biopsies duodénales de patients atteints de DEI, exprimant une protéine EpCAM mutée, ont révélé une désorganisation des entérocytes : la perte d’une protéine EpCAM normale engendre en effet un affaiblissement de l’adhérence cellule-cellule, un défaut de polarisation et une perte de la bordure en brosse ; les éléments structuraux de la bordure en brosse tels que la villine et l’ezrine sont spécifiquement délocalisés le long des membranes latérales.
(→) Voir la Nouvelle d’O. Gires, m/s n° 5, mai 2009, page 449
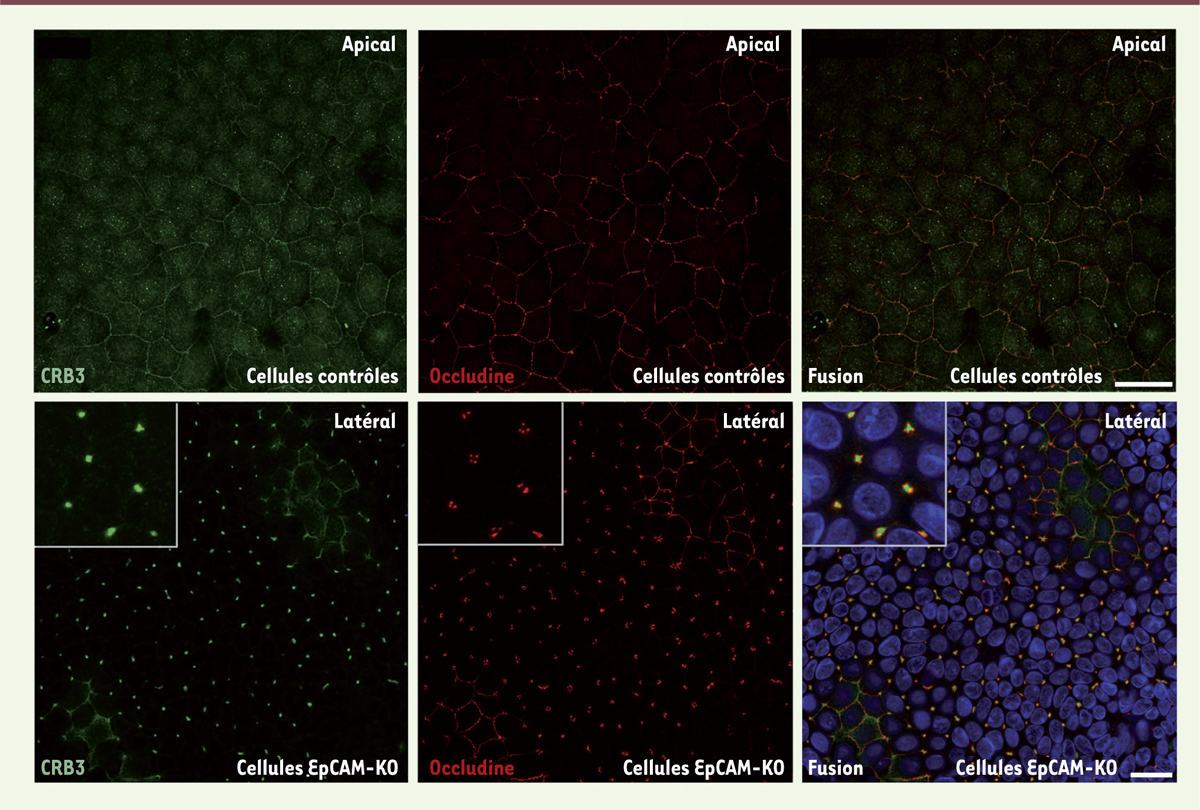
Afin d’affiner l’étude des fonctions d’EpCAM dans l’entérocyte humain, nous avons généré, par une approche d’interférence par l’ARN, des clones de cellules de la lignée intestinale humaine Caco-2 dans lesquels l’expression d’EpCAM est stablement réprimée (cellules EpCAM-Knock-Out ou « EpCAM-KO »). Outre les défauts cellulaires déjà observés sur les biopsies de patients atteints de DEI, une modification de la morphologie des jonctions serrées est visible dans les cellules EpCAM-KO : ces cellules présentent des jonctions serrées déformées aux contacts tricellulaires. Au lieu de maintenir la cohésion du pôle apical, elles s’étirent vers le pôle basal, formant un « puits de jonction » dans lequel des composants du domaine apical s’accumulent et engendrent ainsi la formation de domaines apicaux ectopiques (Figure 1).
 | Figure 1.
Distribution de Crb3 (Crumbs protein homolog 3, protéine de polarité apicale, en vert) et de l’occludine (protéine des jonctions serrées, en rouge) dans les cellules contrôles ou n’exprimant plus EpCAM (EpCAM-KO). Sont présentés les plans focaux dans lesquels les deux protéines sont majoritairement distribuées, côté apical dans les cellules contrôles ou côté latéral dans les cellules EpCAM-KO. Les noyaux ont été colorés par du Hoechst 33342 et apparaissent en bleu (microscopie confocale, barre d’échelle : 10 µm). EpCAM : epithelial cell adhesion molecule ; KO : knock-out. |
Cette étude démontre que l’intégrité de la bordure en brosse, la localisation des hydrolases intestinales associées, et donc la différenciation terminale des entérocytes, sont bouleversées en l’absence d’EpCAM, ce qui permet d’expliquer, au moins en partie, l’incapacité d’absorption des nutriments rencontrée par les patients atteints de DEI. De plus, la déformation des jonctions serrées et la fragilisation des jonctions cellule-cellule contribuent très probablement aux diarrhées chroniques persistantes au repos digestif que connaissent les patients [11]. |
L’absence d’EpCAM modifie l’intensité et la répartition des forces de tension dans l’épithélium intestinal Nous avons émis l’hypothèse que la protéine EpCAM participerait au maintien des forces contractiles générées par le réseau d’actomyosine et exercées aux jonctions cellule-cellule. Décrit initialement dans le muscle strié, le réseau d’actomyosine est formé par l’association de fibres d’actine avec la protéine motrice myosine-II. La myosine-II activée peut se déplacer entre les fibres d’actine, faire glisser ces fibres les unes par rapport aux autres, et ainsi générer un phénomène de contraction du cytosquelette. Dans les cellules épithéliales, l’actomyosine est nécessaire pour stabiliser leur forme cylindrique [12]. Dans des cellules contrôles, le réseau d’actomyosine est majoritairement localisé de façon homogène à la face interne des membranes cellulaires au cortex apical. En l’absence d’EpCAM, il se redistribue le long des contacts tricellulaires. De plus, l’activation de la myosine-II diminue au sein des entérocytes contenant des molécules EpCAM mutées ; l’activité résiduelle se concentre alors néanmoins de façon aberrante au niveau des contacts tricellulaires. Cet accroissement local de la contractilité cellulaire génère des forces de tension ectopiques aux contacts tricellulaires, orientées vers l’intérieur de la monocouche. Le traitement des cellules n’exprimant pas EpCAM par la blebbistatine, une molécule capable d’inhiber l’activité de la myosine-II, permet de contrecarrer les forces contractiles anormalement distribuées, et de relocaliser la bordure en brosse et ses composants à la face luminale, démontrant l’origine biomécanique des défauts causés par la perte d’EpCAM [11]. |
La géométrie du tissu intestinal influence la répartition des forces de tension Bien que l’étude des cellules EpCAM-KO nous ait permis de caractériser le mécanisme responsable des défauts cellulaires, la présence de lésions tissulaires, caractéristiques de l’entéropathie DEI, n’a pu être observée sur les cellules cultivées en monocouche. Les études in vivo sur des modèles animaux sont très restreintes dans le cas de cette pathologie : les modèles murins disponibles, dans lesquels le gène EPCAM a été invalidé, conduisent très rapidement à la mort des animaux et ne permettent pas, par conséquent, d’analyses approfondies. En 2009, le travail d’Hans Clevers a cependant révolutionné le champ de recherche en gastroentérologie avec la génération de cultures primaires sous la forme d’organoïdes intestinaux in vitro [13]. Toutefois, cette technique présente un désavantage intrinsèque majeur pour l’étude de la dysplasie épithéliale intestinale : les organoïdes intestinaux ne forment pas de villosités et le comportement des entérocytes le long de la villosité ne peut être étudié. Les techniques de microfabrication permettent de générer des surfaces structurées de petite échelle qui peuvent être utilisées comme des substrats modèles, de géométrie et de composition contrôlées. De telles approches sont appliquées pour générer des environnements de culture en 3-dimensions (3D) et pour réaliser des études en conditions physiologiques. Nous avons mis en place un tel système de culture 3D, qui fait appel à des techniques alliant la microfabrication et la matière molle. Des moules maîtres de silice sont produits par photolithographie, dans lesquels des inserts en polydiméthylsiloxane (PDMS) sont ensuite polymérisés, constituant ainsi les substrats 3D sur lesquels les entérocytes sont directement cultivés (Figure 2A) [11].
 | Figure 2.
Substrats en 3-dimensions (3D) dans des inserts en polydiméthylsiloxane (PDMS) imitant les villosités. A. Analyse en microscopie électronique à balayage. Sont présentées des vues de côté (a) ou de dessus (b). Barre d’échelle, 100 µm. B. Analyse en microscopie confocale de l’intégrité de la couche épithéliale intestinale constituée par les cellules contrôles ou n’exprimant plus EpCAM (EpCAM-KO) lorsqu’elles sont cultivées sur un substrat de PDMS en 3D, à géométrie semblable aux villosités. Les cellules ont été immuno-marquées pour détecter la E-cadhérine (en vert) et les noyaux ont été révélés par du Hoechst 33342 (en bleu) (barre d’échelle : 100 µm). |
Les cellules Caco2, cultivées sur ces substrats villositaires en 3D, acquièrent une géométrie semblable aux villosités des entérocytes. Elles se polarisent et se différencient en formant une bordure en brosse similaire à celle qui est formée dans l’intestin natif. Les cellules EpCAM-KO, lorsqu’elles sont cultivées dans ces conditions, forment des points focaux d’empilements multicellulaires qui miment les lésions épithéliales caractéristiques de la muqueuse altérée observées dans la DEI (Figure 2B). Ces lésions sont éliminées lorsque les cellules EpCAM-KO sont traitées avec la blebbistatine. Les lésions tissulaires présentes chez les patients souffrant de dysplasie épithéliale intestinale ont donc pour origine le défaut de répartition des forces de tension, comme observé sur les cultures en monocouche. Ces défauts cellulaires sont exacerbés par la géométrie du tissu intestinal. |
Conclusion et perspectives Les retombées de ce travail sont multiples, tant dans le domaine de la biologie fondamentale que dans le domaine médical. L’ensemble de ces résultats plaide en faveur d’une participation de la protéine EpCAM à l’adaptation des cellules aux propriétés géométriques du substrat et à la régulation de l’intégrité de la couche épithéliale intestinale. Ces données suggèrent que les signaux topographiques émanant du microenvironnement tissulaire pourraient être traduits et influencer l’organisation épithéliale. Ces résultats font, en outre, progresser la compréhension des signes cliniques caractéristiques de la dysplasie épithéliale intestinale. Ils sont ainsi très encourageants pour le développement de traitements fondés sur la modulation de l’activité contractile de l’entérocyte pour ces patients exprimant une protéine EpCAM mutée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions Tess Berthier (Institut Jacques Monod, Université Paris Diderot) pour la préparation d’inserts de culture 3D en PDMS, et Virginie Bazin pour la préparation d’échantillons en microscopie électronique à balayage (Service de microscopie électronique, institut de biologie - Paris Seine, IBPS). Ce travail est soutenu par « Initiatives d’excellence » (Idex ANR-11-IDEX-0005-02) - Labex « Who Am I ? » (ANR-11-LABX-0071), et par la Fondation Groupama (Prix de recherche sur les Maladies Rares 2017).
|
1.
Crawley SW, Shifrin DA Jr, Grega-Larson NE, et al. Intestinal brush border assembly driven by protocadherin-based intermicrovillar adhesion . Cell. 2014; ; 157 : :433.–446. 2.
Delacour D, Salomon J, Robine S, Louvard D. Plasticity of the brush border: the yin and yang of intestinal homeostasis . Nat Rev Gastroenterol Hepatol. 2016; ; 13 : :161.–174. 3.
Goulet O, Salomon J, Ruemmele F, et al. Intestinal epithelial dysplasia (tufting enteropathy) . Orphanet J Rare Dis. 2007; ; 2 : :20.. 4.
Reifen RM, Cutz E, Griffiths AM, et al. Tufting enteropathy: a newly recognized clinicopathological entity associated with refractory diarrhea in infants . J Pediatr Gastroenterol Nutr. 1994; ; 18 : :379.–385. 5.
Goulet O, Kedinger M, Brousse N, et al. Intractable diarrhea of infancy with epithelial and basement membrane abnormalities . J Pediatr. 1995; ; 127 : :212.–219. 6.
Patey N, Scoazec JY, Cuenod-Jabri B, et al. Distribution of cell adhesion molecules in infants with intestinal epithelial dysplasia (tufting enteropathy) . Gastroenterology. 1997; ; 113 : :833.–843. 7.
Salomon J, Goulet O, Canioni D, et al. Genetic characterization of congenital tufting enteropathy: epcam associated phenotype and involvement of SPINT2 in the syndromic form . Hum Genet. 2014; ; 133 : :299.–310. 8.
Balzar M, Winter MJ, de Boer CJ, Litvinov SV. The biology of the 17–1A antigen (Ep-CAM) . J Mol Med. 1999; ; 77 : :699.–712. 9.
Patriarca C, Macchi RM, Marschner AK, Mellstedt H. Epithelial cell adhesion molecule expression (CD326) in cancer: a short review . Cancer Treat Rev. 2012; ; 38 : :68.–75. 10.
Salomon J, Gaston C, Magescas J, et al. Contractile forces at tricellular contacts modulate epithelial organization and monolayer integrity . Nat Commun. 2017; ; 8 : :13998.. 11.
Gires O. EpCAM, une protéine versatile impliquée dans l’oncogenèse . Med Sci (Paris). 2009; ; 25 : :449.–450. 12.
Lecuit T, Yap AS. E-cadherin junctions as active mechanical integrators in tissue dynamics . Nat Cell Biol. 2015; ; 17 : :533.–539. 13.
Sato T, Clevers H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications . Science. 2013; ; 340 : :1190.–1194. |