Au-delà des symptômes moteurs qui la caractérisent avec, notamment, la triade akinésie-rigidité-tremblement, qui sont induits par la dégénérescence des neurones dopaminergiques de la substance noire pars compacta (SNc), la maladie de Parkinson (MP) a récemment été identifiée comme une maladie neuropsychiatrique à part entière [1, 2]. En effet, elle s’accompagne très fréquemment de troubles du comportement - notamment l’apathie, la dépression et l’anxiété - qui peuvent apparaître quelques mois, voire quelques années, avant la survenue des symptômes moteurs [1, 2]. Ces troubles dits « non moteurs », ont une étiologie complexe qui reste peu comprise, ce qui rend leur prise en charge délicate. Parmi ces troubles, l’apathie est l’un des symptômes les plus fréquents de la MP. Elle contribue, au moins autant que les troubles moteurs, à altérer la qualité de vie des patients et à une morbidité élevée [1, 2]. L’apathie est définie comme un manque de motivation ou une réduction des comportements dirigés vers un but, qui résultent cliniquement d’un déficit des comportements auto-initiés, volontaires et déterminés [1, 3]. Une étude menée par Schmidt et ses collaborateurs a montré que les patients apathiques souffrent d’une incapacité à produire un effort et à mettre en place une action adaptée permettant d’obtenir une récompense attendue, bien que la perception de la valeur de cette récompense reste inchangée [4]. Ceci suppose que l’apathie est spécifiquement liée à des dysfonctionnements sévères des processus préparatoires motivationnels. Ces symptômes apathiques sont plus particulièrement observés chez les patients parkinsoniens non traités. Toutefois, ils sont également retrouvés chez les patients traités pour lesquels la médication (ayant pour but de rétablir l’activité déficitaire de la transmission dopaminergique, comme la L-dopa ou les agonistes dopaminergiques) est fortement diminuée, par exemple à la suite de la mise en place d’une stimulation cérébrale profonde. Ces symptômes peuvent être toutefois améliorés, voire même abolis, lorsque les traitements dopaminergiques sont adaptés au patient [1]. L’apathie parkinsonienne semble donc dépendre de l’état fonctionnel de la neurotransmission dopaminergique, suggérant un rôle critique de ce neurotransmetteur dans sa physiopathologie [1].
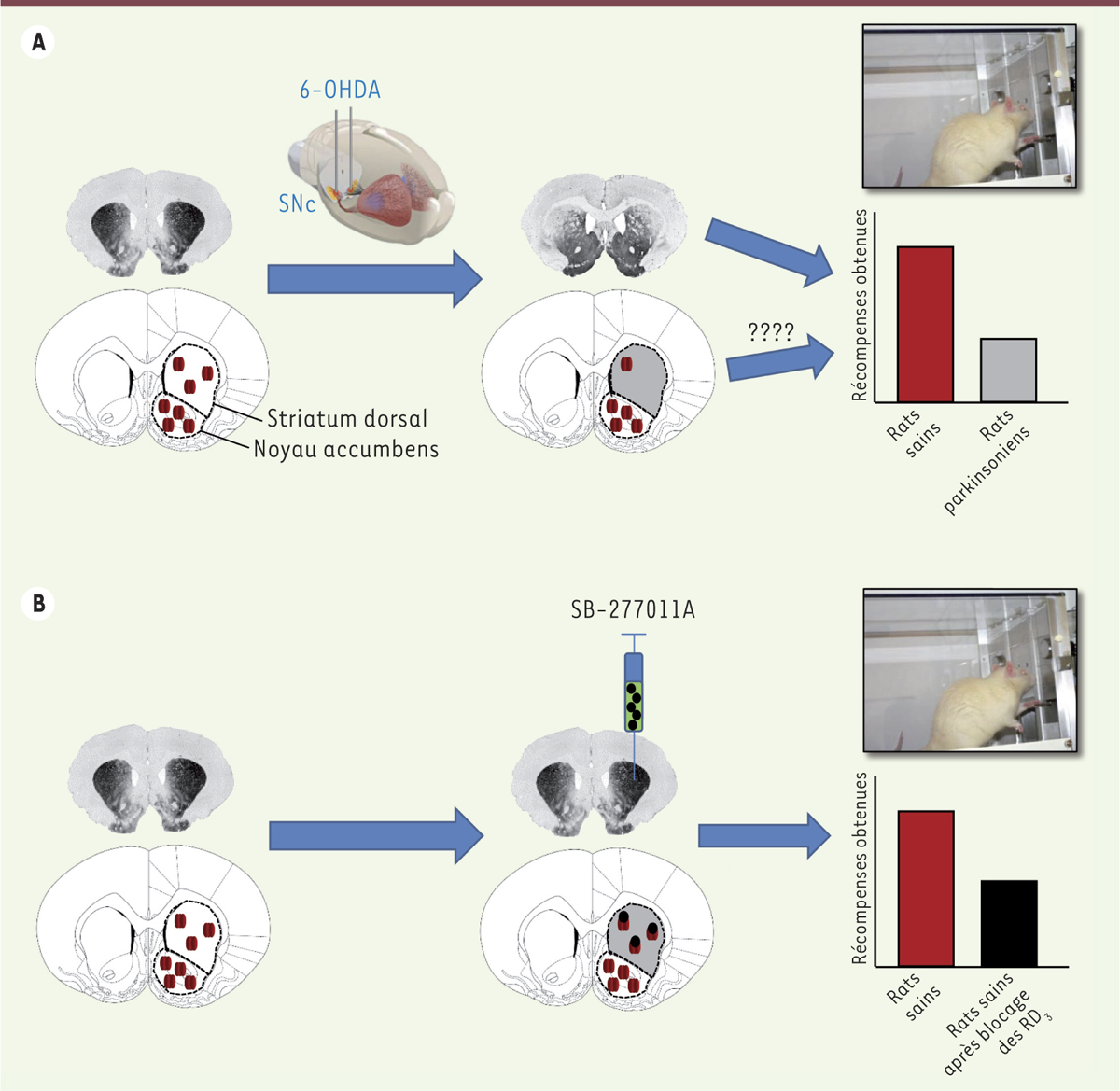
En utilisant un modèle animal de rat fondé sur des lésions neurotoxiques induites par infusion intracérébrale de 6-hydroxydopamine (6-OHDA) dans le mésencéphale (Figure 1A), nous avons récemment montré que des déficits motivationnels, s’apparentant aux symptômes apathiques de la MP, avaient pour origine une perte spécifique de neurones dopaminergiques de la substance noire (SNc) [5]. Ainsi, une lésion dopaminergique partielle et bilatérale de la SNc conduit à une diminution profonde de la performance opérante des animaux pour l’auto-administration de saccharose (un modèle couramment utilisé pour évaluer le désir de récompense) sans qu’il n’y ait d’altération de la valeur « récompensante ». Autrement dit, chez ces animaux, la motivation (l’envie) pour consommer une solution de saccharose est affectée, alors que le plaisir associé à cette consommation reste intact et similaire à celui des rats contrôles non lésés. Il semble donc que la lésion dopaminergique a un impact spécifique sur la composante préparatoire des comportements motivés, comme cela est observé chez les patients parkinsoniens apathiques [5] (Figure 1A). Chez les animaux lésés, un phénotype anxieux et dépressif est également associé à ce déficit motivationnel, ce qui renforce la pertinence de ce modèle pour les études précliniques [5]. Ces altérations comportementales sont corrigées par l’administration d’agonistes des récepteurs dopaminergiques D2/D3, comme cela est observé en clinique, chez des patients parkinsoniens apathiques et dépressifs traités par ces mêmes agonistes [6, 7].
| Figure 1.
Impact de la réduction de fonction des récepteurs D3 dorsostriataux induite par une lésion parkinsonienne sur les comportements motivés A. La dénervation dopaminergique partielle et bilatérale du striatum dorsal, suite à l’infusion de 6-hydroxydopamine (6-OHDA) dans la substance noire (SNc), est révélée par une diminution du marquage de la tyrosine hydroxylase sur la photographie d’une coupe coronale de cerveau (signal gris). Elle induit une diminution sélective de l’expression des récepteurs dopaminergiques D3 (RD3) au sein de cette structure (voir représentation schématique en rouge) et entraîne de façon concomitante une diminution des comportements dirigés vers un but. La photographie à droite illustre le dispositif ayant permis de révéler une réduction importante de l’auto-administration opérante de saccharose. La question soulevée a donc été de savoir si ce déficit d’expression des RD3 pouvait être à l’origine des déficits motivationnels observés (comme la diminution du nombre de récompenses [saccharose] obtenues chez les rats lésés « parkinsoniens ») B.L’injection intracérébrale d’un antagoniste des RD3 (le SB-277011A) directement au sein du striatum dorsal chez des rats sains induit les mêmes déficits motivationnels que ceux observés après lésion dopaminergique de la SNc dans le modèle animal (voir histogramme). Dès lors, le déficit d’expression de ces RD3 induit par la dénervation dopaminergique dans le modèle serait responsable des déficits motivationnels observés. Les histogrammes représentent le nombre moyen de récompenses obtenues (solution de saccharose) au cours d’une session d’auto-administration d’une heure, chez les rats contrôles, lésés, ou après injection intracérébrale du SB-277011A au niveau du striatum dorsal. |
L’ensemble de ces données, en conjonction avec d’autres études précliniques récentes (voir la revue [8]), mettent donc en exergue le rôle déterminant du dysfonctionnement des projections dopaminergiques nigrostriatales1 dans la physiopathologie des troubles motivationnels observés dans la MP. Toutefois, les mécanismes qui les sous-tendent restent encore à élucider.
Les multiples fonctions de la dopamine (détection de signaux pertinents, apprentissage, affect, motivation, motricité, etc.) sont assurées par différents sous-types de récepteurs dopaminergiques. Elles dépendent également de leur localisation neuronale (pré- et/ou post-synaptique mais aussi extrasynaptique) et cérébrale. L’expression et la fonction de ces récepteurs peuvent également être fortement altérées par le déficit en dopamine qui est induit lors du processus dégénératif qui affecte la substance noire pars compacta (SNc) avec des implications physiopathologiques potentielles dans la symptomatologie parkinsonienne [9–12] (→).
(→) Voir la Synthèse de D. Thibault et al., m/s n° 2, février 2010, page 165
Le but de notre étude était d’identifier, dans le modèle animal, les sous-types de récepteurs dopaminergiques qui participaient aux déficits motivationnels induits par la lésion dopaminergique de la SNc. Nous avons évalué, par une analyse autoradiographique semi-quantitative, les modifications d’expression des différents récepteurs dopaminergiques D1, D2 et D3 (RD1-3) dans deux territoires recevant une innervation dopaminergique importante : le noyau accumbens et le striatum dorsal. Une diminution sélective d’expression du récepteur RD3 a été observée au sein du striatum dorsal (Figure 1A), l’expression des récepteurs RD1 et RD2 n’étant pas modifiée [13]. Cette observation nous a conduit à vérifier si ces déficits motivationnels pouvaient avoir pour origine cette diminution d’expression des récepteurs RD3 dans le striatum dorsal, et donc une altération fonctionnelle de la neurotransmission dopaminergique assurée par ces récepteurs. Des injections intracérébrales d’un antagoniste sélectif des récepteurs RD3, le SB-277011A, ont donc été réalisées dans cette structure cérébrale chez des rats sains (non dénervés). Le blocage des récepteurs RD3 par l’antagoniste se traduit par les mêmes déficits motivationnels que ceux qui sont observés après lésion dopaminergique de la SNc (Figure 1B) [13]. Nous avons également évalué, dans une autre étude, l’efficacité à corriger le phénotype comportemental induit par la lésion dopaminergique de la SNc, d’agonistes sélectifs de chaque sous-type de récepteur dopaminergique. Seule l’activation des récepteurs RD3 a permis de réduire efficacement le déficit motivationnel observé dans ce modèle [7]. Cette série d’expériences démontre que le striatum dorsal est un territoire fonctionnel clef pour ce déficit motivationnel et, plus spécifiquement, pour le déficit de la composante préparatoire des comportements motivés, comme ce qui était suggéré par des observations cliniques réalisées chez les patients parkinsoniens [13].
En conclusion, notre étude montre, pour la première fois, un rôle fonctionnel des récepteurs dopaminergiques RD3 au sein du striatum dorsal dans des processus motivationnels complexes, même si leur expression dans ce territoire striatal est physiologiquement faible. L’implication de ces récepteurs était connue dans les circuits neuronaux de la récompense et notamment au sein du striatum ventral [11], mais leur rôle au sein du striatum dorsal restait méconnu.
Nos résultats permettent d’appréhender les mécanismes physiopathologiques responsables de l’apparition des troubles apathiques parkinsoniens. Ils suggèrent également que les récepteurs RD3 pourraient représenter une cible thérapeutique de premier plan afin de traiter les patients parkinsoniens souffrant de troubles apathiques.