| |
| Med Sci (Paris). 33(10): 832–834. doi: 10.1051/medsci/20173310007.Stéatohépatite non-alcoolique et nécroptose Les différentes facettes de RIPK3 Jérémie Gautheron1* 1Université Pierre et Marie Curie, UMR_S 938, Inserm, CDR Saint Antoine Hôpital Saint-Antoine, 184, rue du Faubourg Saint-Antoine, 75012Paris, France MeSH keywords: Animaux, Mort cellulaire, Humains, Foie, Souris, Stéatose hépatique non alcoolique, Receptor-Interacting Protein Serine-Threonine Kinases, physiologie, métabolisme, anatomopathologie |
La stéatose hépatique non alcoolique (NALFD) est la plus fréquente des maladies chroniques du foie. Elle concerne 20 à 30 % de la population générale et sa prévalence a doublé durant les 20 dernières années. La NALFD se caractérise par une accumulation de lipides au niveau des hépatocytes et est fortement associée au développement de l’obésité. Une catégorie de patients affectés par la NALFD, estimée entre 15 et 30 %, évoluera vers une stéatohépatite non alcoolique (NASH) qui se caractérise par des lésions hépatiques, de l’inflammation et le développement d’une fibrose. Cette forme plus sévère de la maladie peut évoluer vers une cirrhose et l’apparition d’un carcinome hépato-cellulaire [1]. Il n’existe à l’heure actuelle aucun traitement médicamenteux efficace contre la NASH. Comprendre les mécanismes moléculaires impliqués dans la transition de la NAFLD vers la NASH est donc devenu un enjeu majeur. Une des différences fondamentales entre la NAFLD et la NASH réside dans la survenue de la mort massive des hépatocytes. Jusqu’à présent, plusieurs études se sont focalisées sur le rôle potentiel de l’apoptose dans ce processus [2, 3], mais, en prenant en compte l’aspect inflammatoire de la maladie, il apparaît que d’autres types de mort cellulaire pourraient être impliqués [4]. |
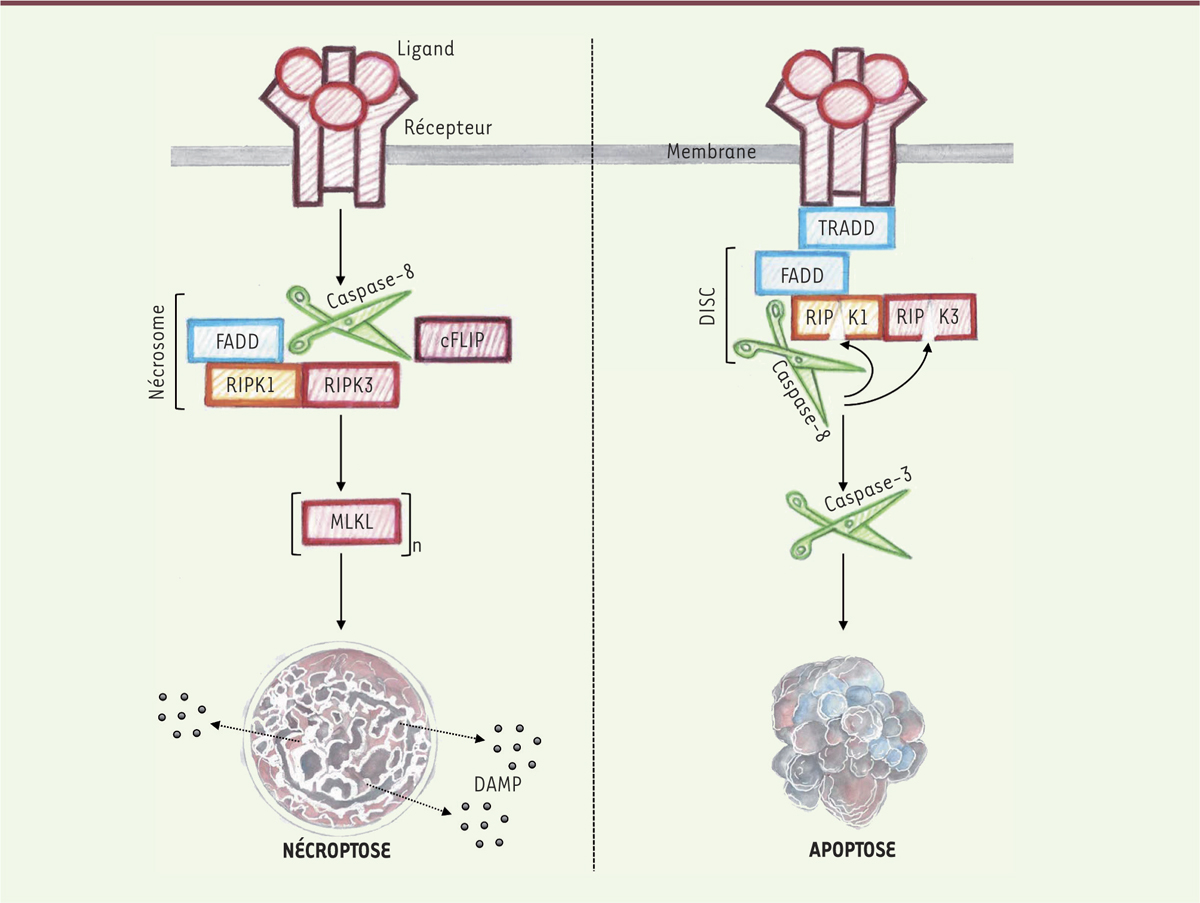
Découverte en 2009, la nécroptose, ou nécrose programmée, désigne un processus biologique de mort cellulaire qui partage la machinerie moléculaire des voies apoptotiques extrinsèques mais dont l’exécution s’apparente à la nécrose avec une oncose (gonflement de la cellule), une dilatation des organelles et une rupture de la membrane plasmique [4, 5] (→). (→) Voir la synthèse de L. Cabon et al. m/s n° 12, décembre 2013, page 1117 Cette séquence d’événements subcellulaires, communs avec la nécrose, indique que la nécroptose pourrait être liée à des processus inflammatoires engendrés par la libération de molécules associées aux dégâts (damage-associated molecular patterns, DAMP) tels que HMGB1 (high-mobility group box 1), IL-1 (interleukin-1) et les HSP (heat-shock proteins). En effet, depuis sa découverte, la nécroptose a été impliquée dans différentes maladies inflammatoires comme l’athérosclérose ou des lésions d’organes (cœur et rein) liées à des chocs ischémiques [6]. La nécroptose est initiée par la liaison d’un ligand sur les récepteurs membranaires de mort tels que TNFR1 (tumor necrosis factor receptor 1), TRAILR1 (tumor-necrosis-factor related apoptosis inducing ligand receptor 1), FASR (fas receptor) et sur les récepteurs de reconnaissance des pathogènes comme TLR3 (Toll-like receptor 3) et TLR4. La fixation du ligand entraîne l’activation des kinases RIPK1 (receptor interacting protein kinase 1) et RIPK3, et la formation d’un complexe protéique inducteur de la nécrose appelé le nécrosome. Au sein de ce nécrosome, RIPK1 active RIPK3 qui phosphoryle la protéine MLKL (mixed lineage kinase domain-like protein). En retour, MLKL s’oligomérise et rejoint la membrane plasmique pour y former des pores et provoquer un choc osmotique (Figure 1) [7]. Les mécanismes par lesquels le nécrosome cause la mort cellulaire restent néanmoins très mal compris et d’autres investigations sont requises pour clarifier tous ces événements.
 | Figure 1.
Activation de l’apoptose et de la nécroptose menant à la mort cellulaire. Panneau de droite : après fixation du ligand, le domaine intracytoplasmique du récepteur recrute les protéines adaptatrices TRADD et FADD. Cette dernière interagit avec la pro-Caspase-8 pour former une plateforme de signalisation appelée le complexe de signalisation induisant la mort (DISC). La pro-Caspase-8 s’active par auto-clivage puis clive la pro-Caspase-3 qui va déclencher l’apoptose. Dans le même temps, les kinases RIPK1 et RIPK3 sont clivées par la Caspase-8 pour prévenir la formation du nécrosome. L’apoptose est représentée schématique avec les corps apoptotiques de la cellule mourante. à noter que les membranes plasmiques restent intactes durant tout le processus de mort cellulaire. Panneau de gauche : la nécroptose est initiée par le récepteur seulement si la Caspase-8 se retrouve inhibée. Dans le cas montré, cFLIP forme un hétérodimère avec la pro-Caspase-8 ce qui a pour conséquence de prévenir son activité protéolytique. L’inhibition chimique ou l’ablation de la Caspase-8 aboutissent aussi à l’activation de la nécroptose. Dans ces différentes conditions, l’activation du récepteur induite par la fixation du ligand permet la formation du nécrosome, un complexe de signalisation comprenant l’adaptateur FADD et les kinases RIPK1 et RIPK3. Le nécrosome induit la mort cellulaire via la phosphorylation de MLKL qui forme des oligomères capables de créer des pores dans la membrane plasmique. La formation des pores serait responsable du relargage de médiateurs de l’inflammation, les DAMP. Le nécrosome pourrait activer d’autres médiateurs qui n’ont pas été encore identifiés. FADD : Fas associating protein with death domain ; TRADD : TNFR1-associated death domain protein ; RIPK1 : receptor-interacting protein kinase 1 ; RIPK3 : receptor-interacting protein kinase 3 ; cFLIP : cellular FLICE-like inhibitory protein ; MLKL : mixed lineage kinase domain-like protein ; (MLKL)n : oligomère de MLKL ; DAMP : damage-associated molecular patterns ; DISC : death-inducing signaling complex. |
Des études récentes ont montré que les voies apoptotiques et nécroptotiques se régulaient mutuellement [7]. L’exemple qui caractérise le mieux cette co-régulation est la capacité de la Caspase-8, un élément central de la voie apoptotique extrinsèque, à inhiber la formation du nécrosome en clivant RIPK1 et RIPK3. à l’inverse, l’inhibition de la nécroptose par la Caspase-8 peut être levée par cFLIP (cellular FLICE-like inhibitory protein) qui inactive la Caspase-8 en formant un hétérodimère [7] (Figure 1). Bien que l’apoptose soit en général considérée comme une mort non-immunogénique du point de vue de son processus (aspect morphologique de la mort), la présence de cellules apoptotiques est très souvent liée à des maladies infectieuses voire inflammatoires. L’étude du déterminisme de la mort cellulaire semble donc essentielle pour mieux comprendre les processus pathologiques responsables du développement de la NASH. Pour la cellule, mourir par apoptose ou par nécroptose, telle est la question. |
Rôle de la nécroptose dans le développement de la stéatohépatite non alcoolique La présence de nécro-inflammation est une des caractéristiques histologiques des patients atteints de NASH [1]. Récemment, il a été montré que l’expression de RIPK3 (l’ARNm et la protéine) augmentait dans les foies des patients NASH [8, 9]. Ces résultats ont été corrélés en immunohistochimie : la kinase RIPK3 et la forme phosphorylée de MLKL (forme active promotrice de la nécroptose) sont fortement augmentées au niveau de groupes d’hépatocytes entourés par de nombreuses cellules immunitaires [9, 10]. Ces résultats indiquent que la nécroptose est activée chez les humains et pourrait contribuer au développement de la NASH. Des souris sauvages (white type, WT) et mutantes Ripk3
-/- (invalidation de Ripk3 dans tout l’organisme) ont été soumises à un régime déficient en choline et méthionine (methionine choline deficient, MCD) qui induit de la NASH indépendamment du développement d’une obésité. Les souris WT surexpriment RIPK3 de façon équivalente à l’augmentation observée chez les patients humains présentant une accumulation de lipides au niveau des hépatocytes et un développement de la fibrose hépatique. Au contraire, les souris Ripk3
-/- restent bloquées au stade de la NALFD sans jamais progresser vers la NASH [8, 9]. De façon intéressante, les souris Caspase-8LPC-KO (liver parenchymal cells-knock out, LPC-KO) montrent un niveau de surexpression de RIPK3 supérieur aux souris WT et, par conséquent, développent une NASH bien plus sévère. En revanche, ces souris Caspase-8LPC-KO sont à nouveau protégées contre le développement de la NASH en absence de RIPK3. Ces résultats ont donc confirmé que la nécroptose était responsable du développement de la NASH chez la souris et que la Caspase-8 agissait bien comme un suppresseur de la nécroptose [9]. De cette étude, une question reste néanmoins en suspens. L’utilisation d’inhibiteurs de caspases pourrait-elle être préjudiciable à long terme chez les patients NASH en induisant une réorientation vers la nécroptose ? |
Une nouvelle fonction de RIPK3 indépendante de la nécroptose Les souris WT et Ripk3
-/- ont été soumises à un régime riche en graisses (high fat diet, HFD) qui induit une NASH très modérée mais, cette fois-ci, associée au développement de l’obésité [11, 12]. De façon surprenante, au contraire du modèle MCD (dans lequel les souris perdent du poids), l’absence de RIPK3 induit un développement de la NASH plus important que celui observé chez les souris WT et ceci s’accompagne d’un syndrome métabolique (avec intolérance au glucose et insulinorésistance). L’analyse histologique a révélé que les souris Ripk3
-/- présentaient une augmentation significative de l’apoptose des hépatocytes et des adipocytes. Un phénotype normal peut être restauré par l’ablation du gène codant la Caspase-8 chez les animaux Ripk3
-/- [11]. De façon similaire, in vitro, il a été montré que l’utilisation d’inhibiteurs de RIPK3 pouvait aussi déclencher une apoptose dépendante de la Caspase-8 [13]. Ceci met en évidence l’existence d’un cercle vicieux entre Caspase-8 et RIPK3, dans lequel l’un et l’autre se contrôlent mutuellement. Dans ce modèle murin lié à l’obésité, l’absence de RIPK3 déclenche une perte de contrôle de l’apoptose qui devient responsable du développement de la NASH et du syndrome métabolique. L’utilisation d’inhibiteurs de RIPK3 pour traiter la NASH chez l’homme semble donc également problématique et devrait être considérée en combinaison avec des inhibiteurs de l’apoptose. Plusieurs questions restent toutefois dans l’attente d’une réponse. Comment RIPK3 supprime-t-elle l’activation de l’apoptose dans le contexte de l’obésité ? Est-ce que l’utilisation d’inhibiteurs de RIPK3 aurait un effet similaire chez les souris obèses ? Finalement, comme RIPK3 montre des fonctions indépendantes de la nécroptose en contrôlant l’apoptose, il serait important d’étudier si MLKL représente une cible thérapeutique plus adaptée car plus spécifique pour traiter la NASH. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Fujii H, Kawada N. Inflammation and fibrogenesis in steatohepatitis . J Gastroenterol. 2012; ; 47 : :215.–225. 2.
Ratziu V, Sheikh MY, Sanyal AJ, et al. A phase 2, randomized, double-blind, placebo-controlled study of GS-9450 in subjects with nonalcoholic steatohepatitis . Hepatology. 2012; ; 55 : :419.–428. 3.
Witek RP, Stone WC, Karaca FG, et al. Pan-caspase inhibitor VX-166 reduces fibrosis in an animal model of nonalcoholic steatohepatitis . Hepatology. 2009; ; 50 : :1421.–1430. 4.
Cabon L, Martinez-Torres AC, Susin SA. La mort cellulaire programmée ne manque pas de vocabulaire . Med Sci (Paris). 2013; ; 29 : :1117.–1124. 5.
Zhang DW, Shao J, Lin J, et al. RIP3, an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis . Science. 2009; ; 325 : :332.–336. 6.
Pasparakis M, Vandenabeele P. Necroptosis and its role in inflammation . Nature. 2015; ; 517 : :311.–320. 7.
Linkermann A, Green DR. Necroptosis . N Engl J Med. 2014; ; 370 : :455.–465. 8.
Afonso MB, Rodrigues PM, Carvalho T, et al. Necroptosis is a key pathogenic event in human and experimental murine models of non-alcoholic steatohepatitis . Clin Sci (Lond). 2015; ; 129 : :721.–739. 9.
Gautheron J, Vucur M, Reisinger F, et al. A positive feedback loop between RIP3 and JNK controls non-alcoholic steatohepatitis . EMBO Mol Med. 2014; ; 6 : :1062.–1074. 10.
Gautheron J, Vucur M, Luedde T. Necroptosis in Nonalcoholic Steatohepatitis . Cell Mol Gastroenterol Hepatol. 2015; ; 1 : :264.–265. 11.
Gautheron J, Vucur M, Schneider AT, et al. The necroptosis-inducing kinase RIPK3 dampens adipose tissue inflammation and glucose intolerance . Nat Commun. 2016; ; 7 : :11869.. 12.
Roychowdhury S, McCullough RL, Sanz-Garcia C, et al. Receptor interacting protein 3 protects mice from high-fat diet-induced liver injury . Hepatology. 2016; ; 64 : :1518.–1533. 13.
Mandal P, Berger SB, Pillay S, et al. RIP3 induces apoptosis independent of pronecrotic kinase activity . Mol Cell. 2014; ; 56 : :481.–495. |