| |
| Med Sci (Paris). 33(10): 839–842. doi: 10.1051/medsci/20173310009.Quand le cytosquelette d’actine fait le jeu des rétrovirus Élodie Teruel,1* Gerges Rizkallah,1* Chloé Journo,1**a and Hélène Dutartre1**b 1Centre international de recherche en infectiologie, équipe oncogenèse rétrovirale, Inserm U1111 - université Claude Bernard Lyon 1, CNRS, UMR5308, École normale supérieure de Lyon, université de Lyon, 46, allée d’Italie, F-69007, Lyon, France ; équipe labellisée « Ligue nationale contre le cancer » MeSH keywords: Cytosquelette d'actine, Protéines de transport, Infections à HTLV-I, Virus T-lymphotrope humain de type 1, Protéines des microfilaments, métabolisme, transmission, virologie, pathogénicité |
Le rétrovirus HTLV-1, un modèle de choix pour étudier le rôle du cytosquelette dans la transmission virale Les virus, « parasites » intracellulaires obligatoires, exploitent diverses stratégies pour se propager au sein de l’hôte qu’ils infectent. Les particules virales peuvent être libérées dans le milieu extracellulaire ou profiter des contacts entre cellules pour se propager directement, de cellule à cellule, en évitant l’environnement cellulaire. Ces contacts peuvent prendre la forme d’extensions (comme les filopodes ou les nanotubes) ou reposer sur une zone de contact étendue appelée « synapse virologique » (SV). La formation de cette synapse nécessite l’établissement d’une zone d’adhérence entre les cellules et l’adressage des éléments viraux de la cellule infectée vers cette zone de contact avec la cellule saine, deux processus qui reposent sur des remaniements du cytosquelette au sein de la cellule infectée. Le rétrovirus HTLV-1 (human T-lymphotropic virus type 1) se transmet principalement par contact cellulaire, les particules virales libres n’étant que peu infectieuses [1](→). Voir la Synthèse de G. Rizkallah et al., m/s n° 6-7, juin-juillet 2015, page 629 Tax, la protéine transactivatrice du virus HTLV-1, induit l’expression de Gem, une protéine membre des petites protéines fixant le GTP de la famille de la superfamille Ras, qui est associée au cytosquelette d’actine et contribue à la migration cellulaire et à la formation de zones de contact (ou conjugués) entre les cellules infectées et les cellules cibles [2]. La protéine Tax induit également l’expression de la protéine d’adhérence ICAM-1 (intercellular adhesion molecule 1) qui stabilise les contacts entre cellules. La signalisation induite à la suite de la polarisation d’ICAM-1 à la surface de la cellule infectée, conduit au positionnement du centre organisateur des microtubules vers la synapse virologique, ce qui favoriserait la transmission virale et le ciblage vers les cellules saines [3]. La fascine contrôle la formation des faisceaux d’actine à partir de l’actine filamenteuse [4]. Elle favorise la migration et l’adhérence cellulaires [5], et stabilise les protrusions et les filopodes, ce qui facilite les contacts entre les cellules [6, 7]. Récemment, il a été montré que l’expression de la fascine était induite par Tax [8, 9] et que la protéine participait à la transmission du virus [10]. |
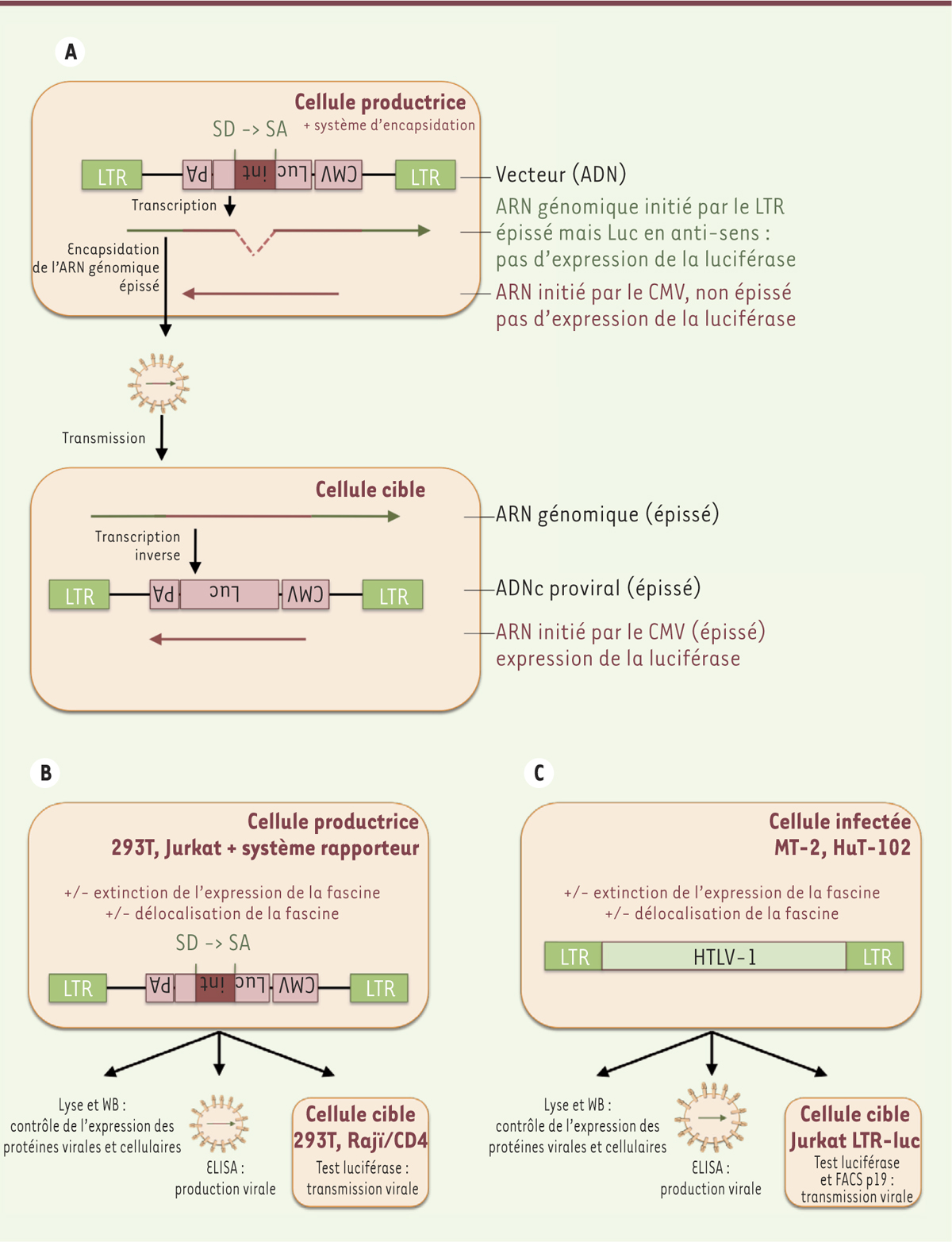
Un outil pour quantifier le virus néo-transmis Afin d’évaluer le rôle de la fascine dans la transmission d’HTLV-1, un système permettant de distinguer le virus avant et après sa transmission a été utilisé (Figure 1A). Il s’agit d’une construction intégrant dans le génome du virus un gène rapporteur dont la traduction n’est autorisée qu’après sa transmission [11]. La construction est encadrée par les séquences LTR (long terminal repeats) d’HTLV-1. Le gène rapporteur de la luciférase, placé sous le contrôle d’un promoteur fort (celui du CMV, cytomégalovirus), est orienté en anti-sens par rapport à l’organisation de la construction. Le gène rapporteur est interrompu par un intron orienté en sens opposé et donc dans la même orientation que la construction. Dans les cellules productrices de virus, le transcrit produit, sous le contrôle du promoteur CMV, ne sera pas épissé et la protéine luciférase ne sera donc pas traduite. En revanche, la transcription virale initiée par le LTR 5’ permettra l’épissage de l’intron, générant ainsi un ARN génomique viral correspondant à la construction sans intron. Pour que ce génome viral puisse être encapsidé, un vecteur d’encapsidation codant les protéines de capside et d’enveloppe d’HTLV-1, ou permettant un pseudotypage par une enveloppe à large tropisme, a été co-transfecté avec la construction précédemment décrite. Les particules virales contenant le génome viral dépourvu d’intron peuvent ainsi se transmettre à de nouvelles cellules saines dans lesquelles la transcription inverse et l’intégration du génome viral s’effectueront. La transcription du gène rapporteur sous le contrôle du promoteur CMV permet alors l’expression de la luciférase dont l’activité traduit la quantité de virus néo-transmis.
 | Figure 1.
Représentation schématique des modèles expérimentaux utilisés dans l’étude. A. Représentation du système rapporteur permettant de quantifier la transmission virale. Dans la cellule productrice, le gène rapporteur de la luciférase (Luc), sous le contrôle du promoteur cytomégalovirus (CMV, en rouge), est orienté en antisens et est flanqué des séquences LTR (long term repeat) du virus HTLV-1 (en vert). Ni l’ARN génomique épissé, initié par le LTR (flèche verte), ni l’ARN non-épissé initié par le CMV (flèche rouge), ne permettent l’expression de la luciférase. Après transmission de l’ARN génomique épissé à la cellule cible, la transcription inverse permet la production d’un ADN complémentaire (ADNc) proviral épissé, à l’origine d’un ARN initié par le CMV (flèche rouge) et de l’expression de la luciférase. SD : site donneur d’épissage; SA : site accepteur d’épissage. B. Représentation schématique des expériences réalisées avec le système rapporteur, après extinction ou délocalisation de la fascine dans les lignées cellulaires humaines : 293T, Rajï et Jurkat. C. Représentation schématique des expériences réalisées dans les lignées cellulaires chroniquement infectées par HTLV-1 (MT-2, cellules transformées par HTLV-1, ou HuT-102, T-cell lymphoma cell lines), après extinction ou délocalisation de la fascine. Jurkat LTR-Luc : cellules Jurkat transfectée exprimant la luciférase sous le contrôle du LTR viral. In : intron; PA : signal de poly-adénylation; WB : western-blot; ELISA : enzyme-linked immunosorbent assay; FACS : flow cytometry cell sorting; p19 : protéine de matrice p19gag. |
|
La fascine facilite la transmission d’HTLV-1 Dans ce système, l’expression de la fascine a été abolie à l’aide d’ARN interférents. Après analyse de l’expression des protéines par western-blot (fascine, Tax, protéine de capside virale p55gag), un examen de la transmission virale a été réalisé par le suivi de l’activité luciférase. La production de particules virales libres a été évaluée par la quantification de p19gag, la protéine de matrice d’HTLV-1, dans les surnageants de culture à l’aide d’un test ELISA (enzyme-linked immunosorbent assay) (Figure 1B). Dans des cellules 293T (human embryonic kidney), l’extinction de l’expression de la fascine réduit de façon significative la transmission virale. Elle diminue également la production de particules virales libres, mais uniquement lorsque Tax est présent, ce qui suggère que ces deux protéines, Tax et fascine, coopèrent au cours de ce processus. Dans ces expériences, la fascine a été « éteinte » dans les cellules de la lignée 293T qui sont, simultanément, productrices et cibles pour le virus. Afin d’exclure un possible rôle de la fascine au cours des étapes précoces de l’infection des cellules cibles, des expériences complémentaires ont été réalisées. Elles ont reposé sur une réduction de l’expression de la protéine spécifiquement dans les cellules productrices de virus. Afin de modéliser la physiologie de l’infection, des cellules de la lignée lymphocytaire T (la lignée Jurkat), cibles principales du virus in vivo ont été utilisées. Les cellules Jurkat expriment peu de fascine, comparées aux cellules 293T. Le taux basal de transmission virale dans ces cellules n’est donc pas affecté par l’extinction de la fascine. En revanche, les résultats obtenus avec les cellules 293T sont confirmés lorsque les cellules Jurkat sont transfectées avec le trans-activateur Tax qui induit l’expression de la fascine. La contribution de la fascine à la transmission d’HLTV-1 a été vérifiée par l’utilisation de lignées cellulaires chroniquement infectées. Le système rapporteur, décrit précédemment, n’est alors plus nécessaire, les lignées infectées produisant naturellement le virus (
Figure 1C
). La transmission virale à partir de ces cellules est suivie à l’aide de cellules cibles « rapporteuses », en évaluant l’expression du gène de la luciférase sous contrôle du LTR du virus HTLV-1, lui-même transactivé par la protéine Tax. Après co-culture avec des cellules infectées, la protéine Tax est produite dans les cellules nouvellement infectées. Elle active ainsi l’expression de la luciférase. Dans ces cellules, l’activité luciférase est diminuée d’environ 50 % lorsque l’expression de la fascine est réprimée dans les cellules productrices, ce qui suggère, à nouveau, un rôle de cette protéine dans la transmission du virus. Le transfert du virus des cellules productrices aux cellules saines a été également mis en évidence en détectant la protéine de matrice p19gag dans les cellules cibles par cytométrie en flux. L’ensemble de ces résultats montre qu’indépendamment du système expérimental utilisé, la fascine participe à la transmission d’HTLV-1 de cellule à cellule. |
La transmission de HTLV-1 repose sur la localisation de la fascine Afin de déterminer si l’effet de la fascine sur la transmission virale reposait sur ses activités de régulation du cytosquelette d’actine, une technique permettant de perturber sa localisation au sein du cytosquelette d’actine a été utilisée. Pour cela, une méthode élégante, fondée sur l’expression de nanobodies dans les cellules productrices de virus a été appliquée. Les nanobodies sont des anticorps produits par les camélidés (dromadaires), réduits au domaine de liaison à l’antigène, le Fab. Dans le cas présent, les nanobodies, dirigés contre la fascine, ont été couplés à des séquences protéiques d’adressage vers la membrane externe de la mitochondrie. Après avoir contrôlé que ces nanobodies ne modifiaient pas le niveau d’expression de la protéine, mais qu’ils induisaient effectivement sa délocalisation, il a pu être montré que cette délocalisation diminuait la production et la transmission virales. La localisation subcellulaire de la fascine contrôle donc spécifiquement la transmission du virus HTLV-1, probablement par l’intermédiaire du cytosquelette d’actine. |
La fascine ne participe pas à la formation de conjugués, mais pourrait contribuer à l’adressage du virus vers les zones de contact entre cellules Pour identifier le mécanisme moléculaire par lequel la fascine facilite la transmission du virus, son implication dans la formation des zones de contact entre cellules productrices et cellules cibles a été étudiée. De façon surprenante, l’absence de fascine ne modifie pas la formation de ces conjugués (ou zones de contact). En revanche, les auteurs ont observé qu’en absence de fascine dans la zone de contact cellulaire, la protéine p19gag n’était pas correctement localisée, ce qui suggère que la fascine contrôle l’adressage du virus vers les sites de contact. Cependant, l’analyse de la distribution de la protéine p19gag par microscopie confocale n’a pas été réalisée sur des cellules productrices dans lesquelles l’expression de la fascine serait réprimée ou la protéine délocalisée. On ne peut donc pas formellement conclure que la localisation de la fascine au niveau des contacts cellulaires influence l’adressage du virus. |
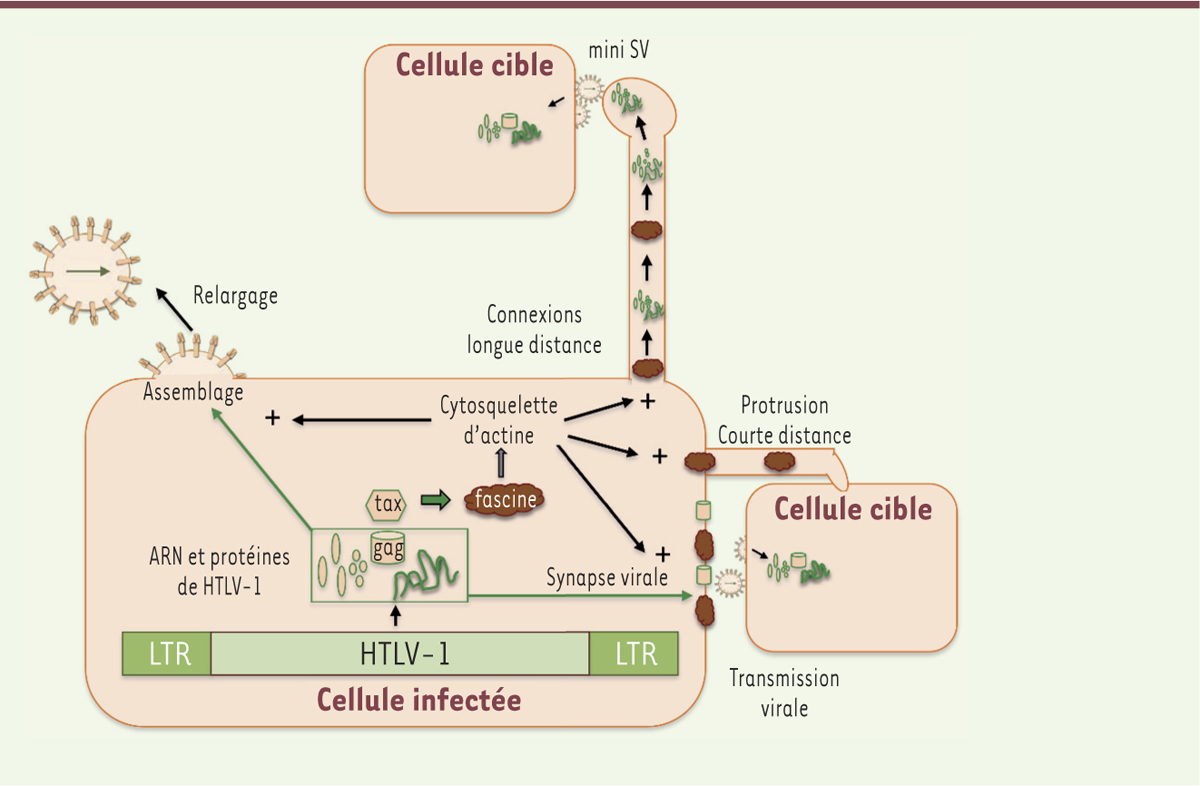
La fascine et Gem, deux protéines cellulaires contrôlant le remodelage du cytosquelette et dont l’expression est induite par Tax, agissent donc différemment sur la transmission virale. La fascine favorise la production virale sans modifier la formation des zones de contact. Inversement, Gem favorise la formation de ces conjugués sans modifier la production virale. La fascine pourrait donc contrôler l’adressage des particules virales vers la membrane plasmique (
Figure 2
). Les mécanismes moléculaires qui gouvernent l’effet de la fascine restent toutefois à préciser. De façon intéressante, le virus d’Epstein-Barr (EBV) induit également l’expression de fascine, via la protéine LMP1 (latent membrane protein 1), mais le rôle de la protéine dans la transmission de l’EBV n’a pas été analysé. En revanche, la fascine confère aux lymphocytes infectés par l’EBV des capacités invasives [12]. Elle pourrait également participer à l’invasivité des cellules infectées par HTLV-1 et être ainsi à l’origine de l’infiltration du système nerveux central chez les patients souffrant de myélopathie associée à HTLV-1 ou même de l’infiltration du derme chez les patients souffrant de leucémie lymphoïde T de l’adulte à manifestation cutanée. Ainsi, une répression de l’expression de la fascine pourrait permettre d’envisager une thérapeutique efficace en infectiologie afin de limiter la transmission virale, et, en oncologie, afin d’abolir les propriétés invasives des cellules cancéreuses.
 | Figure 2.
Schéma récapitulatif des rôles de la fascine lors de la transmission d’HTLV-1. Dans la cellule infectée, le génome proviral (représenté en vert) contrôle l’expression des protéines virales, dont la protéine Tax et les protéines nécessaires à la formation de nouvelles particules virales, regroupées dans le cadre vert. Les flèches vertes symbolisent l’adressage des protéines virales soit vers la synapse virale (SV) soit vers la membrane plasmique. Dans les deux cas, elles forment des particules virales qui sont alors soit transmises à une cellule cible au travers d’une SV, soit libérées dans le milieu extracellulaire. La fascine, dont l’expression est induite par Tax (représentée par une flèche large verte) est impliquée dans la réorganisation du cytosquelette d’actine (représentée par une flèche large grise). Elle peut être localisée au niveau de la SV ou des protrusions cellulaires. Le rôle de la réorganisation du cytosquelette d’actine induite par la fascine est représenté par des flèches noires : elle facilite (noté +) la formation de la synapse virale, le relargage des virions et la formation des connexions longue ou courte distance vers les cellules cibles, probablement via l’augmentation du transport des protéines virales. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Rizkallah G, Mahieux R, Dutartre H. Transmission intercellulaire du HTLV-1 . Med Sci (Paris). 2015; ; 31 : :629.–637. 2.
Chevalier SA, Turpin J, Cachat A, et al. Gem-induced cytoskeleton remodeling increases cellular migration of HTLV-1-infected cells, formation of infected-to-target T-cell conjugates and viral transmission . PLoS Pathog. 2014; ; 10 : :e1003917.. 3.
Nejmeddine M, Negi VS, Mukherjee S, et al. HTLV-1-tax and ICAM-1 act on T-cell signal pathways to polarize the microtubule-organizing center at the virological synapse . Blood. 2009; ; 114 : :1016.–1025. 4.
Otani T, Ogura Y, Misaki K, et al. IKKepsilon inhibits PKC to promote fascin-dependent actin bundling . Development. 2016; ; 143 : :3806.–3816. 5.
Villari G, Jayo A, Zanet J, et al. A direct interaction between fascin and microtubules contributes to adhesion dynamics and cell migration . J Cell Sci. 2015; ; 128 : :4601.–4614. 6.
Hoelzle MK, Svitkina T. The cytoskeletal mechanisms of cell-cell junction formation in endothelial cells . Mol Biol Cell. 2012; ; 23 : :310.–323. 7.
Schafer C, Born S, Mohl C, et al. The key feature for early migratory processes: Dependence of adhesion, actin bundles, force generation and transmission on filopodia . Cell Adh Migr. 2010; ; 4 : :215.–225. 8.
Mohr CF, Gross C, Bros M, et al. Regulation of the tumor marker fascin by the viral oncoprotein tax of human T-cell leukemia virus type 1 (HTLV-1) depends on promoter activation and on a promoter-independent mechanism . Virology. 2015; ; 485 : :481.–491. 9.
Kress AK, Kalmer M, Rowan AG, et al. The tumor marker fascin is strongly induced by the tax oncoprotein of HTLV-1 through NF-kappaB signals . Blood. 2011; ; 117 : :3609.–3612. 10.
Gross C, Wiesmann V, Millen S, et al. The tax-inducible actin-bundling protein fascin is crucial for release and cell-to-cell transmission of human t-cell leukemia virus type 1 (HTLV-1) . PLoS Pathog. 2016; ; 12 : :e1005916.. 11.
Mazurov D, Ilinskaya A, Heidecker G, et al. Quantitative comparison of HTLV-1 and HIV-1 cell-to-cell infection with new replication dependent vectors . PLoS Pathog. 2010; ; 6 : :e1000788.. 12.
Mohr CF, Kalmer M, Gross C, et al. The tumor marker fascin is induced by the Epstein-Barr virus-encoded oncoprotein lmp1 via NF-kappaB in lymphocytes and contributes to their invasive migration . Cell Commun Signal. 2014; ; 12 : :46.. |