Le myélome multiple (MM) est une hémopathie maligne caractérisée par une prolifération clonale de plasmocytes médullaires [1]. Le MM est une maladie hétérogène sur le plan moléculaire, mais également au niveau des réponses au traitement [2]. Une stratification du risque permettrait de constituer différents groupes de patients atteints de MM et in fine, d’améliorer leur prise en charge thérapeutique. Le principal marqueur pronostique actuellement utilisé dans le MM, est représenté par l’ISS (international staging system) [3]. Il est fondé sur l’évaluation des taux d’albumine et de bêta-2-microglobuline réalisée lors du diagnostic. Une version dite révisée (R-ISS) inclut le taux de LDH (lactate deshydrogénase) et les anomalies cytogénétiques comme la translocation t(4; 14) et la délétion 17p [4]. Les anomalies moléculaires présentes au sein des cellules tumorales, pourraient également améliorer la stratification du risque.
Les exosomes sont des nano-vésicules de 50-140 nm de diamètre, qui contiennent des protéines et des acides nucléiques comme des microARN (miARN) [5]. Ils sont sécrétés par plusieurs types de cellules, dont les cellules cancéreuses, et peuvent être isolés aisément à partir du sang périphérique. Les exosomes favorisent la progression tumorale dans de nombreux types de cancers, en particulier par le transfert de miARN de cellules à cellules [6–8]. Ceux-ci agissent principalement comme répresseurs de la traduction de leur ARN messager cible. En se fixant à leur région 3’-UTR (untranslated transcribed region), ils induisent leur dégradation par le complexe RICS (RNA-induced silencing complex). Les miARN circulent par l’intermédiaire de deux mécanismes principaux : ils se fixent aux protéines AGO (argonaute) au cours de la mort cellulaire par apoptose ou par nécrose, ou ils sont sécrétés dans des exosomes par un processus actif.
Dans notre étude, nous avons caractérisé le rôle pronostique des miARN des exosomes circulants dans le MM. Les exosomes ont été recueillis à partir d’échantillons de sérum de patients atteints de MM, par une technique de centrifugation séquentielle associée à l’utilisation d’un agent (le polymère Exoquick®) permettant de les concentrer. Les ARN de petite taille, contenus dans les exosomes, ont été isolés à partir de dix échantillons provenant de patients et de cinq échantillons de donneurs sains. Ils ont été caractérisés par séquençage à haut-débit. La grande majorité des « petits » ARN étaient constitués de miRNA dans les deux types de prélèvements. Des ARN nucléaires et nucléolaires, des ARN ribosomiques, des ARN messagers, et des ARN longs non codants (lincRNA, long intergenic non-coding RNA) ont également été détectés. Une analyse d’expression différentielle nous a permis de définir des sous-groupes de miARN qui étaient significativement sous ou sur-exprimés dans les exosomes de patients atteints de MM [9].
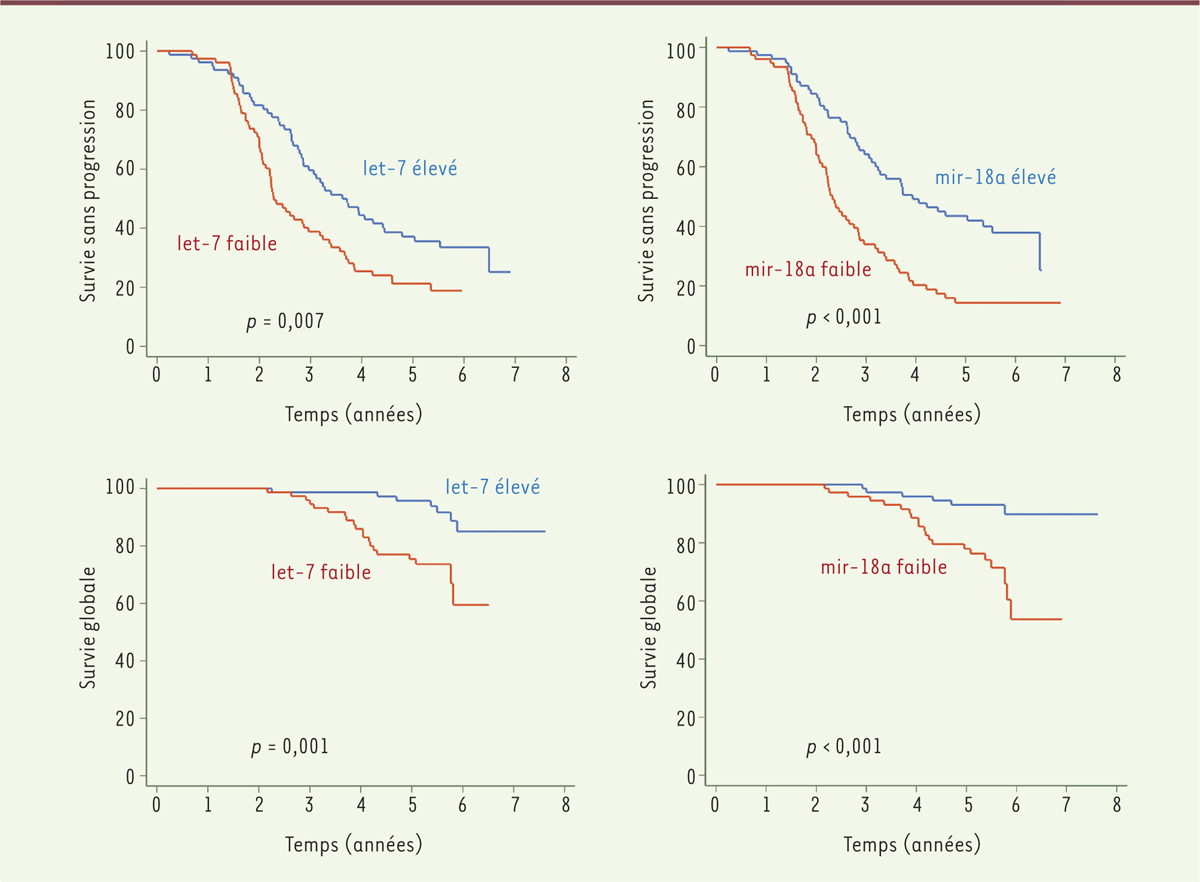
Nous avons ensuite étudié l’expression d’un panel de 22 miARN, par qRT-PCR (quantitative reverse transcription-polymerase chain reaction) de type TLDA (taqman low density array), à partir de 156 échantillons provenant de patients traités uniformément par le bortézomib et la dexaméthasone en première ligne de traitement du MM. Tous les prélèvements ont été réalisés au moment du diagnostic, avant le début d’un traitement. Le suivi médian de la cohorte a été de 5,4 ans. À partir des analyses uni-variées et multi-variées, plusieurs miARN ont été associés à une survie sans progression (SSP) significativement plus courte, spécifiquement les miARN let-7b, let-7e, miR-106a, miR-106b, miR-155, miR-16, miR-17, miR-18a, miR -20a et miR-21. Cependant, seuls deux de ces miARN (let-7b et miR-18a) se sont avérés être significativement associés à une survie globale (SG) plus courte. L’association de let-7b et miR-18a a ensuite été examinée en fonction des caractéristiques des patients. Une expression plus faible des deux miARN a été associée significativement à un stade d’ISS élevé. Après ajustement pour l’ISS et les anomalies cytogénétiques de haut-risque, telles que la délétion 17p et la translocation t(4;14), let-7b et miR-18a se sont révélés être des facteurs pronostiques indépendants. Les deux miARN permettent en effet de distinguer deux groupes de patients présentant des pronostics différents pour la SSP et la SG, comme l’illustrent les courbes de Kaplan-Meier obtenues avec ces patients ( Figure 1 ). La mesure de l’expression de let-7 et de miR-18a au niveau des exosomes circulants pourrait donc permettre d’améliorer la définition du pronostic des patients atteints de MM.
Nous avons évalué la valeur pronostique ajoutée d’une signature de l’expression dans les exosomes circulants, de let-7 et miR-18a en association à l’ISS et aux données de cytogénétique, par une analyse de courbes ROC (receiver operating characteristic). La combinaison de la signature de ces deux miARN avec l’ISS et le statut cytogénétique apporte une meilleure valeur prédictive pour la SSP et la SG que l’ISS et la cytogénétique. L’analyse des miARN exosomiques circulants améliorerait ainsi la stratification pronostique des patients atteints de MM, en association à l’ISS et la cytogénétique.
À notre connaissance, il s’agit de la première étude évaluant la signification clinique des miARN exosomiques circulants dans le MM. Contrairement aux approches génomiques classiques actuelles qui nécessitent une aspiration médullaire, l’étude des miARN exosomiques peut être réalisée à partir d’une prise de sang, ce qui en fait des biomarqueurs attractifs. Dans notre étude, nous avons montré la valeur pronostique ajoutée de deux miARN des exosomes circulants, let-7b et miR-18a, dans la définition de la SSP et de la SG, chez les patients atteints de MM au diagnostic, et similairement traités par le bortézomib et la dexaméthasone. D’autres exemples récents ont montré l’intérêt de l’étude des exosomes circulants dans la prise en charge diagnostique et pronostique de cancers [10] (→).
(→) Voir la Synthèse de S. Baulande et al., m/s n° 3, mars 2014, page 289
Dans le mélanome, les marqueurs comme TYRP2 (tyrosinase related protein-2), VLA-4 (integrine α4β1) et HSP70 (heat shock protein), sont significativement plus élevés dans les exosomes des patients à un stade IV, comparés à ceux de stades moins avancés [6]. Concernant les cancers de la prostate résistants à la castration (CRPC), l’expression de miR-1290 et miR-375 au niveau des exosomes circulants, est un marqueur prédictif indépendant de la SG chez ces patients [11]. Il est à noter que la présence dans les exosomes circulants de glypican-1 a été détectée exclusivement chez les patients atteints de cancer du pancréas. Ce protéoglycane pourrait ainsi servir de marqueur pour le diagnostic de cette maladie [12]. La signature miARN que nous avons étudiée (let-7b et miR-18a) au niveau des exosomes circulants de patients atteints de MM, nécessitera d’être confirmée de façon prospective, afin d’en valider l’intérêt pronostique pour la prise en charge de la maladie. Notre travail démontre cependant, l’intérêt de l’étude de nouvelles formes de biomarqueurs moléculaires dans les hémopathies malignes.