| |
| Med Sci (Paris). 33(11): 1003–1006. doi: 10.1051/medsci/20173311020.Chroniques génomiques - Immunothérapie « CAR-T » : une autorisation qui fait date Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS, Espace éthique méditerranéen, hôpital d’adultes la Timone, 264, rue Saint-Pierre, 13385Marseille Cedex 05, France ; CoReBio PACA, case 901, parc scientifique de Luminy, 13288Marseille Cedex 09, France MeSH keywords: Chimère, Agrément de médicaments, Humains, Immunothérapie, Récidive tumorale locale, Pédiatrie, Leucémie-lymphome lymphoblastique à précurseurs B et T, Récepteurs aux antigènes des cellules T, Induction de rémission, Lymphocytes T, États-Unis d'Amérique, Food and Drug Administration (USA), méthodes, thérapie, génétique, immunologie |

Le premier traitement fondé sur l’emploi de lymphocytes dits « CAR-T » (chimeric antigen receptor T cells), commercialisé par l’entreprise Novartis et destiné aux patients souffrant d’une leucémie aiguë lymphoblastique (LAL) et en échec de traitement, a été approuvé par la FDA (Federal drug administration) le 30 août dernier [1]. C’est un événement important car il s’agit d’une immunothérapie novatrice, très efficace, qui semble aussi prometteuse que l’inhibition des points de contrôle immunitaire [2] (→) et est probablement la première d’une longue série. C’est aussi la première thérapie génique approuvée aux États-Unis, et le prix annoncé de 475 000 dollars américains en fait une des plus chères à ce jour. Elle mérite donc bien qu’une chronique lui soit consacrée…
(→) Voir l’Éditorial de S. Champiat et J.C. Soria, m/s n° 6-7, juin-juillet 2017, page 563
|
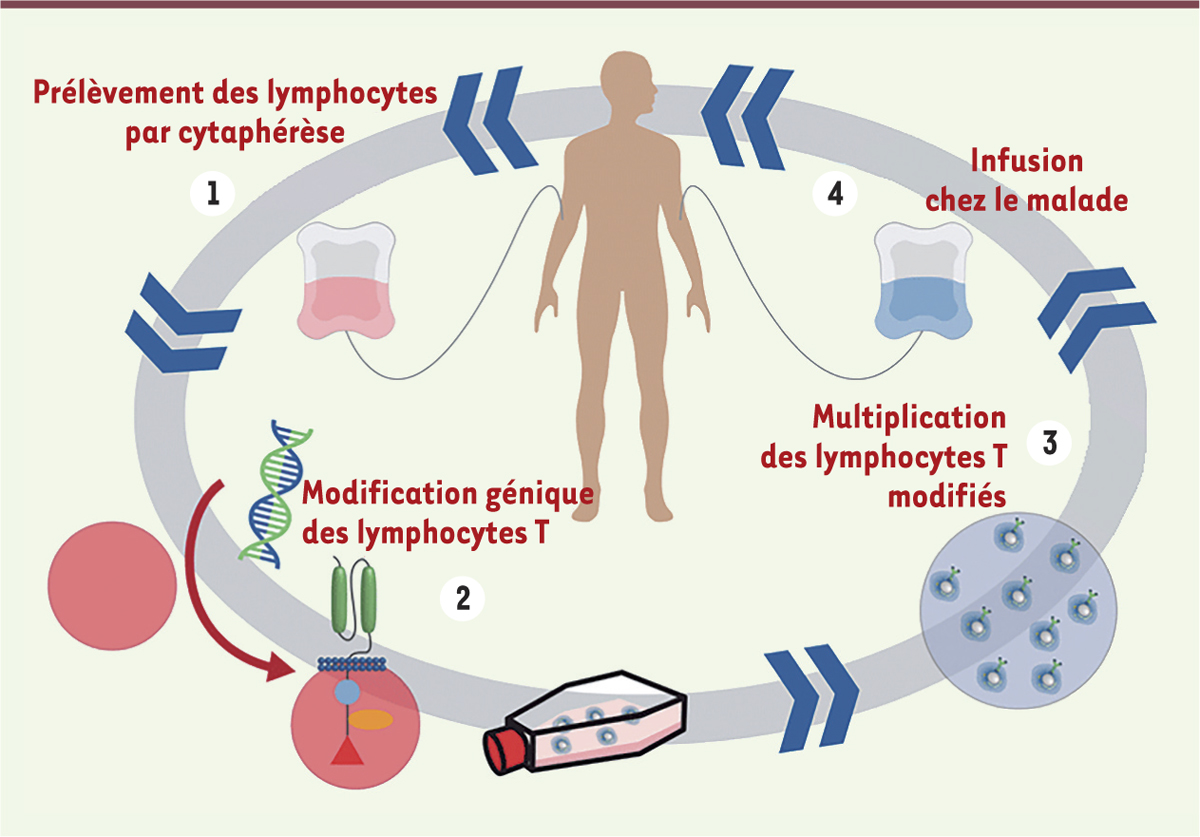
La voie des récepteurs antigéniques chimériques Il s’agit en fait de traiter les malades (pour le moment essentiellement ceux qui sont atteints de divers types de cancers du sang aussi appelés hémopathies malignes) par leurs propres lymphocytes T qui sont prélevés, modifiés in vitro, multipliés au laboratoire puis réinjectés au patient. La modification consiste à introduire (grâce à un vecteur viral) un gène chimérique comportant les deux domaines variables d’immunoglobuline spécifiques d’un antigène tumoral (généralement le marqueur CD191 qui est exprimé sur les lymphocytes B) et des domaines d’activation et de stimulation, avec les séquences nécessaires pour assurer une insertion transmembranaire correcte de la protéine produite. Ces lymphocytes T modifiés vont, on l’espère, s’attaquer aux cellules tumorales et les éliminer. Il s’agit donc bien d’une thérapie génique ex vivo, individualisée et supposant un haut niveau de technicité (Figure 1).
 | Figure 1.
Schéma général d’une thérapie de type CAR-T. Le lymphocyte T modifié (en bas à gauche) exprime un récepteur antigénique chimérique comportant, en surface, deux domaines variables d’immunoglobuline et, à l’intérieur de la cellule, plusieurs domaines d’activation et de stimulation (adapté de Rockland Immunochemicals, https://rocklandinc.com/car-t-cell-therapy-services.aspx). |
Cette approche a été explorée au niveau préclinique dès le début des années 1990 ; le premier résultat clinique positif chez l’homme, publié en 2010 [3], a été suivi de nombreux essais (381 essais cliniques, dont 215 en phase I, répertoriés dans la base de données des essais cliniques clinicaltrials.gov). Ces travaux sont résumés dans un article de synthèse tout récent [4]. Dans la majorité des cas, le ciblage porte sur l’antigène CD19, avec quelques tentatives impliquant d’autres molécules (notamment CD202, et CD303,). Dans l’ensemble les résultats ont été encourageants, une forte proportion de patients présentant une réponse souvent complète (absence de maladie résiduelle) et durable, s’apparentant donc à une guérison. Malheureusement le traitement est fréquemment accompagné d’effets toxiques sévères, notamment un ensemble de symptômes (fièvre, tachycardie, hypotension, insuffisance rénale, etc.) lié à une libération massive de cytokines et dénommé cytokine release syndrome (CRS)4, ainsi que des toxicités neurologiques (tremblements, aphasie, convulsions, etc.), le tout imposant une surveillance très attentive en cours de traitement. |
Un intérêt soutenu de l’industrie Malgré la complexité du procédé, et en raison de ses résultats prometteurs, il a suscité l’intérêt de nombreux industriels, qui ont investi dans sa mise au point. Les plus en vue dans ce domaine sont deux start-up basées aux États-Unis, Kite Pharma (qui vient d’être racheté par Gilead, voir plus loin) et Juno Therapeutics, ainsi qu’une grande entreprise pharmaceutique, Novartis. Ces firmes ont développé, en collaboration avec des laboratoires universitaires, leur propre version du système CAR-T et ont mis au point la logistique complexe qui permet de produire, dans un délai acceptable, les lymphocytes T modifiés à partir d’un prélèvement effectué sur le patient, le tout dans les conditions de sécurité biologique requises. Elles ont chacune lancé plusieurs essais cliniques de phase I ou II, avec l’espoir d’être la première à présenter des résultats suffisamment concluants sur quelques dizaines de patients pour obtenir un accord de la FDA. L’issue de cette course est longtemps restée incertaine ; Juno Therapeutics, qui semblait en très bonne position avec son JCAR05 (CAR-T dirigé contre CD19, testé sur des patients en récidive de leucémie aiguë lymphoblastique B (LAL), a vu ses espoirs ruinés par le décès de cinq patients5 entraînant l’arrêt de l’essai. De son côté Kite déplorait également un décès, sans néanmoins qu’il y ait interruption de l’essai en question, et semble proche de l’obtention d’une autorisation. C’est néanmoins Novartis qui a pu, le premier, présenter à la FDA un ensemble de données suffisamment convaincantes (issues d’un essai de phase II encore en cours) pour emporter une autorisation de mise sur le marché. |
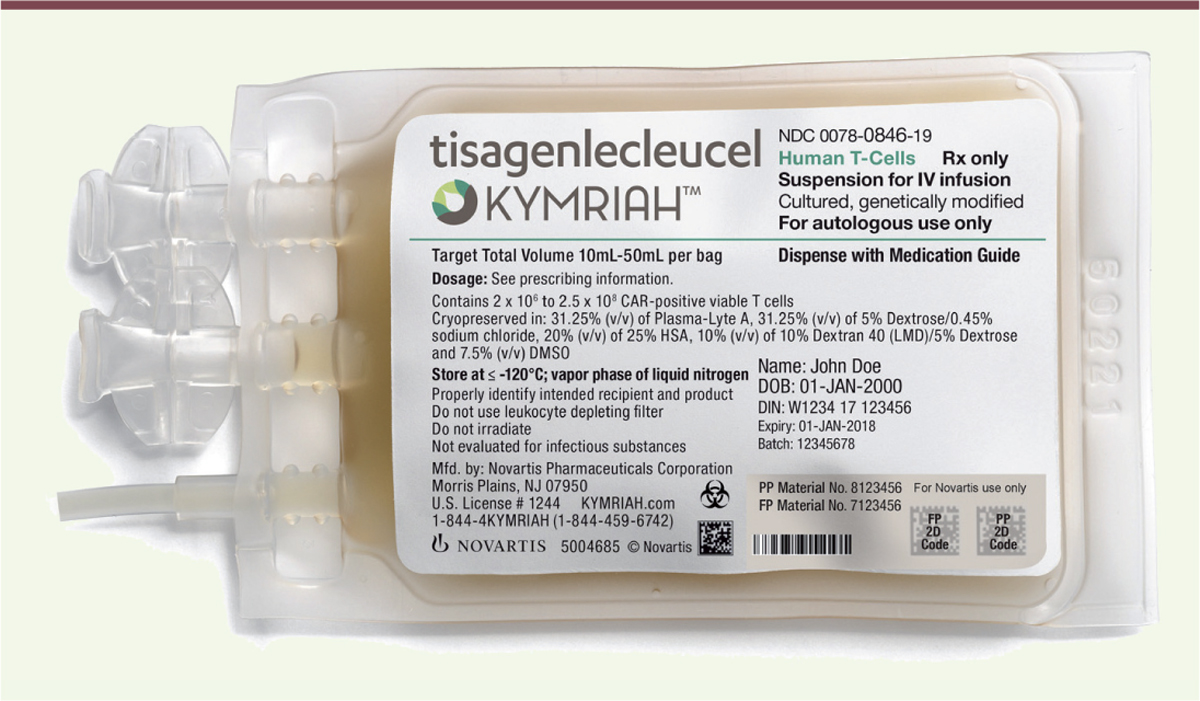
Kymriah, le traitement CAR-T de NovartisMise au point avec l’université de Pennsylvanie (équipe de Carl June) et l’hôpital d’enfants de Philadelphie (PA, États-Unis), la thérapie CAR-T de Novartis a reçu le nom barbare de tisagenlecleucel et le nom commercial de Kymriah (Figure 2). Le récepteur chimérique employé présente un domaine externe de type immunoglobuline dirigé contre l’antigène CD19, et, au niveau intracellulaire, un domaine d’activation CD3-zeta ainsi qu’un domaine de co-stimulation 4-1BB provenant de la molécule CD1376 ; il a déjà été employé pour un essai de phase I qui avait donné des résultats prometteurs [5]. L’essai clinique présent (phase II) concerne des enfants atteints de leucémie aiguë lymphoblastique (LAL) en échec de traitement (y compris après greffe de moelle osseuse) et dont le pronostic à court terme est très sombre. Le gène du récepteur antigénique chimérique est introduit grâce à un vecteur de type lentivirus dans les lymphocytes T du malade (prélevés par cytaphérèse7) ; les cellules CAR-T ainsi obtenues sont multipliées, vérifiées puis infusées chez le malade qui a préalablement subi une chimiothérapie légère pour réduire le nombre de lymphocytes (pré-conditionnement). Cet essai de phase II a débuté à l’été 2014 et implique une douzaine de centres cliniques aux États-Unis ; il n’est pas terminé, ni bien sûr publié (fin officielle à l’automne 2024), les résultats actuels présentés à la FDA sont donc provisoires. Ils n’en sont pas moins impressionnants [6]. Sur les 63 patients traités et évaluables, 52 (83 %) sont entrés en rémission dans les trois mois et ne présentent aucune maladie résiduelle décelable. La durée de rémission ne peut encore être évaluée faute de données car il y a très peu de rechutes : elle va certainement être très longue, au point que l’on peut parler de guérison. Ces résultats spectaculaires sont acquis au prix de toxicités importantes : un syndrome de libération de cytokines (CSR, ou « orage de cytokines ») de grade 3 ou 48 chez la moitié des patients, et une toxicité neurologique de grade 3 ou 4 chez 18 % d’entre eux. Ce traitement ne peut donc être employé que dans des centres très compétents et capables d’intervenir efficacement en cas de problème ; il n’empêche qu’il semble bien guérir des malades qui étaient en échec thérapeutique et dont l’espérance de vie était très limitée.
 | Figure 2.
Une « poche » de Kymriah (suspension de lymhocytes T). Noter l’identification du patient (« John Doe » est l’équivalent de « Jean Dupont » pour nous). |
La commercialisation de Kymriah suppose donc une logistique sophistiquée et implique obligatoirement un centre de traitement certifié par la FDA (Novartis en a déjà établi une vingtaine aux États-Unis) : ces centres doivent être capables d’effectuer le prélèvement des lymphocytes par cytaphérèse et l’envoi de ce prélèvement au laboratoire central créé par Novartis (à Morris Plains dans le New Jersey) qui va effectuer la modification génique, vérifier puis multiplier les cellules pour les renvoyer au centre de traitement, lequel les administrera au patient et suivra son évolution en étant prêt à intervenir en cas de syndrome CRS9 ou de neurotoxicité. Novartis assure que l’ensemble du processus peut être réalisé en moins de 20 jours. |
Un tarif scandaleux ? Pas si sûr… L’annonce de l’approbation de Kymriah s’est accompagné de la fin du suspense sur le prix qu’allait demander Novartis : les analystes tablaient sur une fourchette allant de 500 à 900 000 dollars américains. Finalement le tarif annoncé est de 475 000 dollars, ce qui en fait un des traitements les plus chers de l’histoire. Seuls deux « médicaments », en fait deux thérapies géniques approuvées en Europe (mais pas aux États-Unis) se situent à ce niveau : Glybera, qui traite la déficience en lipoprotéine lipase moyennant un million d’euros et vient d’être retiré du marché après avoir traité… un seul malade, et Strimvelis, qui corrige un déficit immunitaire sévère et coûte environ 600 000 euros. Kymriah, s’il tient ses promesses, est susceptible de guérir définitivement des enfants qui étaient condamnés à brève échéance, et donc de leur procurer un gain très important en termes d’espérance de vie. L’organisme britannique NICE (National institute for health and care excellence), qui évalue le rapport coût/efficacité des nouveaux médicaments, a mené une telle étude pour les thérapies de type CAR-T [7] et est arrivé à la conclusion qu’un tarif maximum de 530 000 livres sterling (environ 580 000 euros) satisferait à ses critères, compte tenu du nombre d’années de vie gagnées10 : l’analyse de cet organisme habituellement sévère justifie le prix demandé par Novartis ou, du moins, indique qu’il n’est pas exorbitant en regard de l’efficacité du traitement. De même, le coût (aux États-Unis) d’une greffe de moelle (transplantation de cellules souches hématopoïétiques, traitement parfois possible, mais risqué et peu satisfaisant) est de l’ordre de 800 000 dollars. Et enfin, compte tenu de la complexité du procédé et des structures à mettre en place, le coût pour l’entreprise d’un traitement par Kymriah tel qu’évalué par divers analystes [8], pourrait atteindre 200 000 dollars, près de la moitié du prix de vente. D’habitude, dans l’industrie pharmaceutique, le coût de production d’un médicament breveté représente moins de 10 % du montant facturé, en d’autres termes la marge brute est supérieure à 90 %. Par rapport à nombre de thérapies ciblées récentes, dont le coût atteint 100 ou 200 000 dollars et qui n’apportent qu’une prolongation de quelques mois de la survie, le tarif de Kymriah ne paraît donc pas scandaleux, malgré l’importance du montant et le fait que les recherches initiales aient été réalisées dans le secteur public. De plus, Novartis accepte de subordonner le paiement à la constatation d’une réponse après un mois de traitement, un pas important vers un paiement subordonné à l’efficacité. En tout état de cause, le marché immédiat pour ce traitement est limité : le nombre de patients pédiatriques atteints d’une leucémie aiguë lymphoblastique et en échec de traitement est estimé à six cents aux États-Unis. Mais bien sûr la firme a d’autres essais en cours sur différents types de cancers sanguins et peut espérer une extension assez rapide de son marché11, de quoi faire de Kymriah un blockbuster, un produit dont le chiffre d’affaires annuel dépasse le milliard de dollars. Comme je l’ai déjà indiqué, elle n’est pas seule sur ce marché, et son concurrent Kite Pharma est très proche de voir son produit CAR-T (lui aussi dirigé contre CD19) avalisé par la FDA. Une transaction toute récente donne la mesure des espoirs - peut-être exagérés -suscités par ces thérapies : Gilead (l’entreprise pharmaceutique californienne qui commercialise à prix d’or le traitement Sovaldi pour l’hépatite C) vient d’acquérir Kite Pharma pour 11,9 milliards de dollars… Certes, Kite Pharma a des résultats très prometteurs avec son produit CAR-T (appelé KTE-C19) qui fait actuellement l’objet de sept essais cliniques ; il s’agit néanmoins d’une start-up créée en 2009 et qui n’a fait l’objet, au total, que d’environ 500 millions de dollars d’investissements. Le montant déboursé par Gilead apparaît donc très élevé : il faudra que l’entreprise vende beaucoup de thérapies CAR-T, et très cher, afin de rentabiliser cette acquisition. On voit là à l’œuvre un des mécanismes qui génèrent le prix très élevé des traitements innovants, tout en faisant bien sûr le bonheur des investisseurs astucieux. |
Vers une extension du domaine des CAR-T ? De nombreux travaux actuellement en cours pourraient, s’ils sont couronnés de succès, élargir le domaine d’application de cette approche thérapeutique. On cherche actuellement à s’attaquer aux cancers « solides » (sein, poumon, intestin, etc.) en ciblant le récepteur chimérique sur d’autres molécules de surface tumorales ; d’autres laboratoires essaient d’augmenter l’efficacité des CAR-T en pratiquant une modification génique supplémentaire, l’inactivation du gène PDCD1 (programmed cell death-1) codant PD-1, qui devrait stabiliser leur activité en bloquant ainsi l’expression de cet important point de contrôle de l’immunité qu’est PD-1 : ces tentatives, qui reposent sur l’emploi du système CRISPR, ont fait l’objet d’une récente chronique [9] (→).
(→) Voir la Chronique génomique de B. Jordan, m/s n° 11, novembre 2016, page 1035
Enfin une entreprise française, Cellectis, tente d’éviter l’emploi de lymphocytes provenant du patient (qui complique singulièrement toute la logistique du procédé et entraîne des frais très importants) et de mettre au point des CAR-T « universels » qui pourraient être stockés et utilisés à la demande [10]. Le décès du premier malade traité dans le cadre d’un essai clinique de ce produit vient de provoquer son arrêt, mais bien sûr cette voie offrirait de nombreux avantages et aiderait à la diffusion de ce type d’immunothérapie. Par ailleurs on peut espérer que l’on apprenne à mieux gérer ses sérieux effets toxiques (notamment l’« orage de cytokines ») et peut-être à les minimiser grâce, par exemple, à des CAR-T dont l’action serait limitée dans le temps. Rien de tout cela n’est acquis, mais les succès déjà enregistrés augurent bien de l’avenir de ces thérapies très innovantes. Il restera à faire en sorte qu’elles ne ruinent pas les patients ou les systèmes de santé ! Dernière minute Le 18 octobre 2017, la FDA a approuvé le traitement CAR-T mis au point par l’entreprise Kite pour le traitement de certains lymphomes B dits « à grandes cellules ». Il s’agit donc là du deuxième traitement CAR-T approuvé aux États-Unis. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
2.
Champiat S, Soria JC. Nouvelles pratiques en immuno-oncologie : une révolution et un immense défi scientifique et médical . Med Sci (Paris). 2017; ; 33 : :563.–564. 3.
Kochenderfer JN, Wilson WH, Janik JE, et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19 . Blood. 2010; ; 116 : :4099.–4102. 4.
Brudno JN, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for lymphoma . Nat Rev Clin Oncol. 2017 Aug 31; . doi: 10.1038/nrclinonc.2017.128. 5.
Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia . N Engl J Med. 2014; ; 371 : :1507.–1517. 9.
Jordan B. Les débuts de CRISPR en thérapie génique . Med Sci (Paris). 2016; ; 32 : :1035.–1037. 10.
Poirot L, Philip B, Schiffer-Mannioui C, et al. Multiplex genome-edited T-cell manufacturing platform for “Off-the-Shelf” adoptive T-cell immunotherapies . Cancer Res. 2015; ; 75 : :3853.–3864. |