| |
| Med Sci (Paris). 33(12): 1026–1029. doi: 10.1051/medsci/20173312003.Mesure de la dégradation bio-mécanique d’une fibre d’ADN sous l’effet des rayons X thérapeutiques Grégoire Perret,1,2,3 Thomas Lacornerie,4 Fabio Manca,2 Stefano Giordano,2 Momoko Kumemura,1,3 Nicolas Lafitte,1 Laurent Jalabert,1 Mehmet C. Tarhan,1,3 Eric F. Lartigau,3,4 Fabrizio Cleri,2,3 Hiroyuki Fujita,1,3 and Dominique Collard1,3a 1LIMMS (Laboratory of integrated micro-mechatronic systems)/CNRS-IIS, Unité Mixte Internationale 2820, Institut des sciences industrielles, Université de Tokyo, 4-6-1 Komaba Meguro Ku, Tokyo153-8505, Japon 2IEMN (Institut d’électronique et de microélectronique et de nanotechnologie), UMR8520, CNRS, Avenue Poincaré, cité scientifique, BP 60069, Villeneuve d’Ascq, Cedex 59652, France 3CNRS/IIS/COL/Lille 1 projet SMMiL-E, CNRS délégation Nord-Pas de Calais et Picardie, 2, rue de Canonniers, Lille, Cedex 59046, France 4Centre Oscar Lambret, Université de Lille, département universitaire de radiothérapie, Centre Oscar Lambret, Lille59000, France MeSH keywords: |
La destruction des cellules tumorales par des faisceaux de photons, en radiothérapie du cancer, est aujourd’hui fondée sur une compréhension typiquement empirique des mécanismes de l’endommagement de l’ADN par les rayonnements. Il est bien établi que les photons induisent des cassures de l’ADN simple et double brin, par plusieurs mécanismes dont les détails et l’efficacité restent mal connus [1]. Les techniques expérimentales existantes comparent l’intégrité de l’ADN avant et après son irradiation. Ces mesures (taux de cassures) sont indirectes – de multiples altérations peuvent résulter de la technologie employée – et ne donnent pas d’information sur la cinétique de l’endommagement [2, 3]. Notre hypothèse est que les dommages produits par les irradiations peuvent être évalués par la détection des altérations et des caractéristiques mécaniques des molécules irradiées. La réponse mécanique de l’ADN, l’importance de sa séquence, son élasticité et sa plasticité sont étudiées à la fois sur les plans expérimentaux et théoriques. La spectroscopie de force est une excellente approche pour l’étude de la dynamique moléculaire des interactions ADN-rayonnements. Toutefois, les instruments classiques – pinces optiques [4], magnétiques [5], ou les MFA (microscope de force atomique) – présentent un encombrement important, qui est peu compatible avec le confinement du faisceau. Ils seraient également peu opérationnels dans l’environnement électromagnétique sévère produit par le rayonnement ionisant. Les dispositifs MEMS (micro-electro-mechanical systems) [6] représentent une solution adaptée à la manipulation moléculaire sous rayonnement : ils peuvent s’insérer aisément dans le cône d’irradiation, grâce à leur taille réduite (inférieure à 1 cm2), et leur micro-fabrication en technologie SOI (silicon on insulator) préserve leurs capacités de mesure dans l’environnement électromagnétique sévère du faisceau. Nous avons, dans cette étude, étendu le concept de MEMS avec la réalisation d’une nanopincette en silicium, le SNT (silicon nano tweezers) [7], capable de maintenir une fibre moléculaire et d’en mesurer les caractéristiques mécaniques. Une fibre d’ADN est capturée entre les pointes du SNT qui la maintiennent en tension dans une cavité fluidique [8]. L’un des bras de la nanopincette est mis en résonance mécanique. La variation de sa fréquence de résonance indique, en temps réel, la perte de rigidité de la fibre résultant des cassures induites par le rayonnement. Une modélisation théorique, qui relie l’élasticité de la fibre d’ADN aux taux de cassures induites dans la fibre, complète ce volet expérimental. Quatre années de travail ont été nécessaires pour aboutir à la première démonstration de faisabilité. |
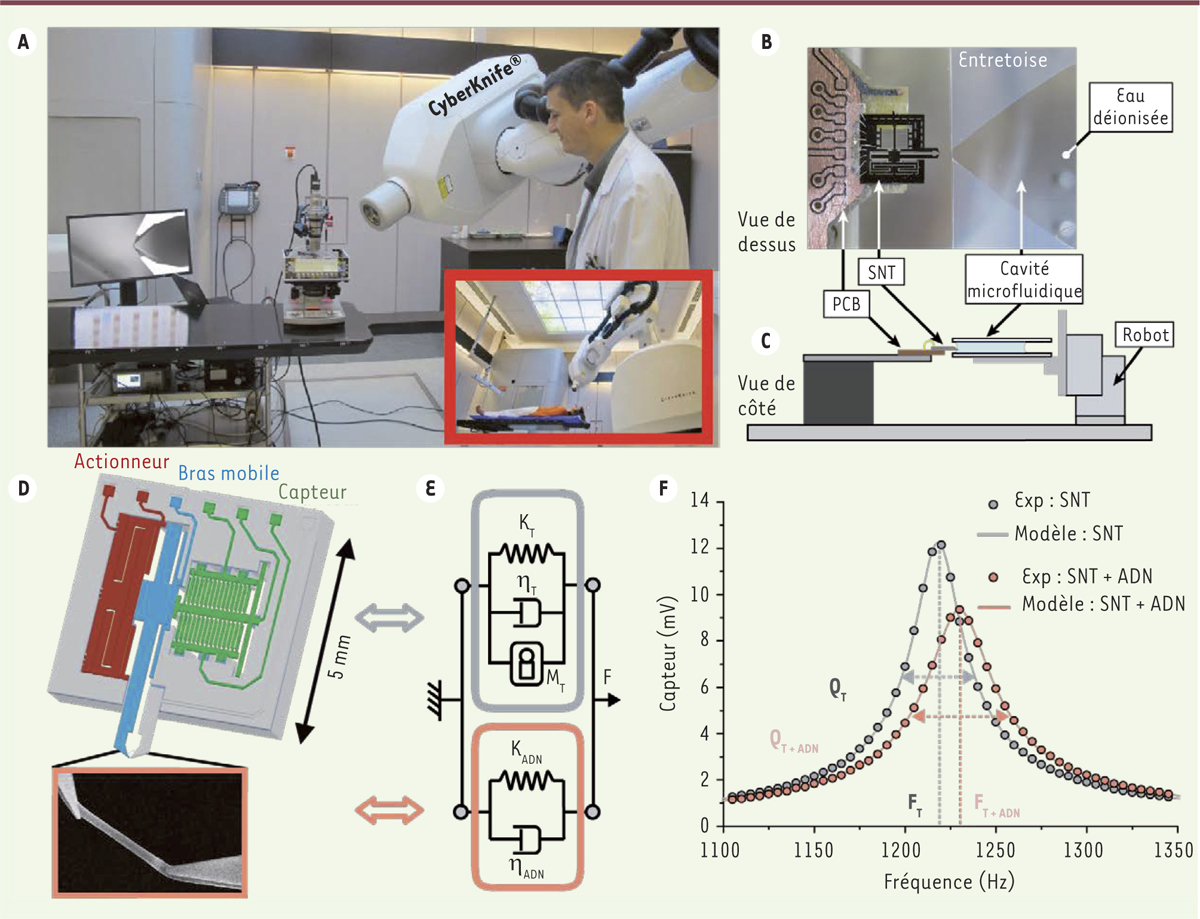
Le dispositif expérimental La nanopincette (ou SNT) (Figure 1D) dispose de deux bras qui se terminent par des pointes en vis-à-vis, qui permettent de fixer et de maintenir la fibre moléculaire. Les pointes sont insérées dans une goutte de solution contenant l’ADN (provenant du phage λ) et la fibre se forme entre les 2 pointes par diélectrophorèse1 [9]. Cette fibre, maintenue entre les 2 pointes, est ensuite insérée dans une cavité fluidique (Figure 2B–C). Le rayon est focalisé sur la cavité et les bras du SNT (Figure 2A). Le SNT comporte un actionneur2,, qui met le bras mobile en vibration par un étirement léger de la fibre, et un capteur de déplacement. L’actionneur et le capteur de déplacement sont reliés à une électronique, afin de maintenir le bras en résonance [7]. La rigidité de la fibre est évaluée à partir de la fréquence de résonance, mesurée en temps réel, par le modèle de résonateur amorti, avec comme référence, la fréquence de résonance du système à vide (Figure 2E–F) [10].
 | Figure 1.
Méthode et installation du dispositif expérimental au sein de l'hôpital. A. L'instrumentation, qui comprend le SNT ( silicon nano tweezers), la cavité microfluidique et le microscope pour le contrôle et l'électronique de traitement, est placée sur le lit du patient (l'encadré montre la configuration classique de la salle durant une séance de radiothérapie). Le physicien médical focalise le faisceau du Cyberknife ® sur les bras du SNT. B. Cette vue de dessus montre l’alignement du SNT devant la cavité fluidique, les pointes maintenant la fibre d'ADN sont prêtes à être introduites dans la cavité. C. La vue schématique de côté précise les positions du SNT et de la cavité durant les irradiations. D. Le SNT comprend les 2 pointes en vis-à-vis, l’une est fixe tandis que la seconde (représentée en bleu) est mobile. La partie mobile est mise en résonance par un actionneur électrostatique (en rouge) et sa vibration est mesurée par le capteur de déplacement (en vert). L'encadré montre la fibre d'ADN capturée entre les deux pointes. E. Le SNT (en gris) et la fibre d'ADN (en orange) se comportent mécaniquement comme des résonateurs amortis, caractérisés par la masse (M), les rigidités (K) et leurs amortissements (η). F. La réponse en fréquence du SNT avec fibre (orange) est comparée avec celle du SNT seul (gris) ; les mesures de la fréquence de résonance (F) et du coefficient de qualité (Q) durant les irradiations permettent de calculer la rigidité mécanique de la fibre en temps réel [ 8]. |
 | Figure 2.
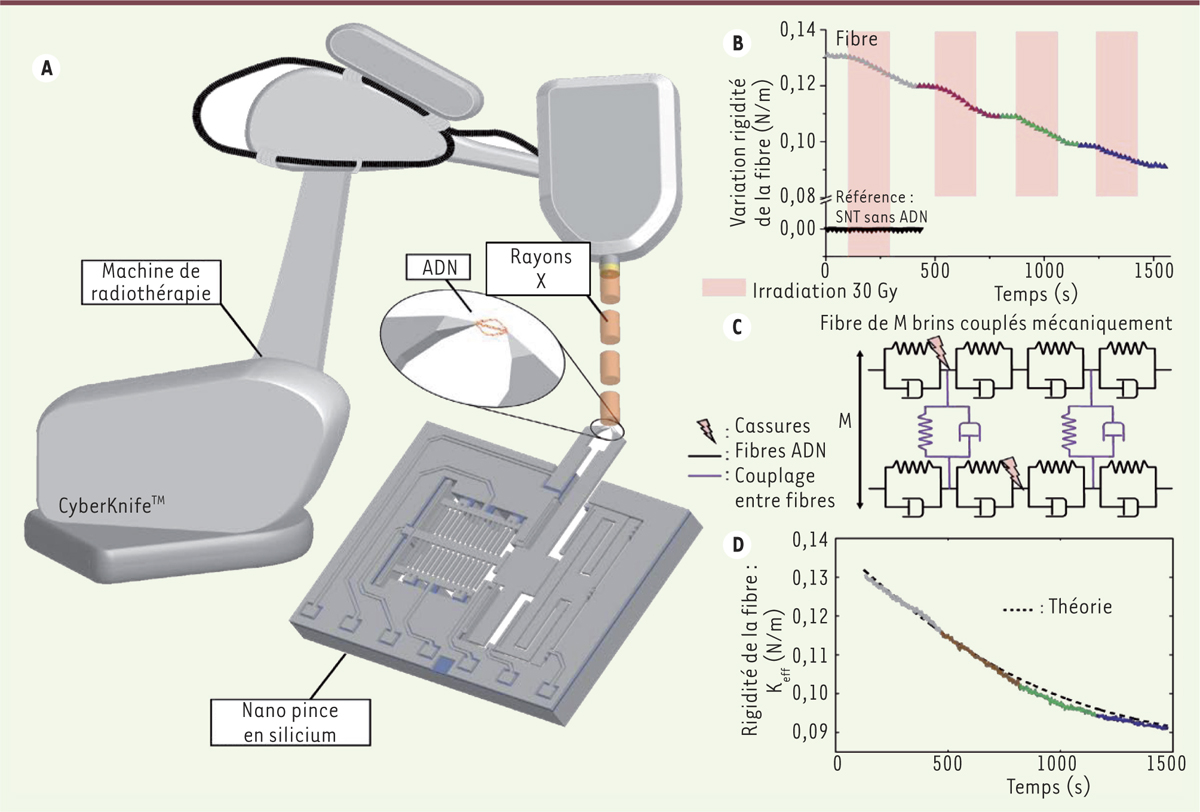
Protocole expérimental. A. Le faisceau du Cyberknife ® irradie la fibre d'ADN qui est maintenue dans la cavité fluidique (non représentée) entre les pointes du SNT ( silicon nano tweezers). La pointe mobile est mise en vibration sur sa fréquence de résonance. B. L'irradiation produit des cassures dans la fibre, qui se traduisent pas une réduction de la fréquence de résonance, donnée à partir de laquelle la variation en temps réel de la rigidité de la fibre est calculée [ 8]. Dans cette expérience l'ADN subit 4 irradiations de 30 Gy. B. La dégradation de la rigidité de la fibre d'ADN durant l'expérience intervient essentiellement durant les phases d'irradiation suite aux cassures induites. C. La fibre d'ADN est modélisée par un nombre M de molécules placées en parallèle qui se comportent comme des éléments viscoélastiques. Le confinement de la fibre induit également des couplages viscoélastiques (en bleu) entre les molécules. Les cassures sont simulées en introduisant des coupures aléatoires dans les chaînes moléculaires (en noir). D. La modélisation permet avec des paramètres réalistes (un nombre de molécule M de 1 800), de reproduire la variation de la rigidité de la fibre en considérant un taux d'introduction de cassures constant (1 s -1) durant les phases d'irradiations (juxtaposition des parties colorées de la courbe expérimentale) [ 11]. |
|
Le département de radiothérapie du centre Oscar Lambret, à Lille, a mis à notre disposition un Cyberknife®, un appareil de radiothérapie stéréotaxique robotisé : la source de photons, LINAC (linear accelerator) de 6 MV, montée sur un bras robotisé, se termine par un collimateur circulaire réglable (de 5 à 60 mm) permettant de focaliser le rayon. Le débit de dose est de 8 Gy min-1 à 80 cm pour la plus grande ouverture du collimateur. Pour chaque cycle d’irradiation, la dose est calculée en fonction de la position du SNT et de l’ouverture du collimateur. La focalisation la plus forte (soit un diamètre de 5 mm) permet de minimiser le bruit électronique généré par l’irradiation du SNT lui-même. L’électronique de traitement a été éloignée du faisceau (d’un mètre environ). La manipulation du robot dans les trois dimensions simplifie le positionnement du montage expérimental sous le rayon (Figure 1A). De multiples expériences ont permis de s’assurer d’une part que la mesure de la fréquence de résonance du SNT n’est pas altérée sous l’irradiation et qu’elle reste stable, même lors des très longues sessions, et, d’autre part, qu’en l’absence d’irradiation, la fréquence de résonance du SNT – pointes immergées dans la solution contenant ou non l’ADN – reste également stable [11]. |
Irradiations multiples d’une fibre d’ADN Une fibre d’ADN est reliée entre les pointes du SNT. Elle est irradiée dans la cavité fluidique contenant de l’eau déionisée, durant 4 sessions de 210 secondes, chacune délivrant une dose de 30 Gy, et suivies d’une période de récupération de 180 secondes (Figure 2A). Le bras mobile du SNT est maintenu en résonance durant toute l’expérience. Les variations de la fréquence de résonance (réduction durant les sessions d’irradiation) permettent de mesurer en temps réel l’altération de la rigidité mécanique de la fibre (Figure 2B). Les réductions successives de rigidité de la fibre moléculaire apparaissent principalement durant les phases d’irradiation, les variations restent relativement faibles durant les temps de récupération. La réponse mécanique de la fibre résultant d’effets complexes d’ionisation produits par l’irradiation, nous proposons un modèle quantitatif, qui permet de reproduire ces effets (Figure 2C). La fibre simule des brins d’ADN mis en parallèle et des éléments de couplage reproduisent les frictions entre les molécules. Le rayonnement introduit des cassures des brins qui sont distribuées aléatoirement dans la fibre et altèrent la rigidité totale du système. En juxtaposant les mesures des 4 sessions, la modélisation (Figure 2D) reproduit fidèlement la décroissance de rigidité qui est observée sur l’ensemble de l’expérience avec des valeurs de paramètres réalistes. Cette modélisation met en évidence une corrélation entre les irradiations et la réduction de la rigidité de la fibre qui est cohérente. Cependant, elle ne permet pas, actuellement, de traduire les altérations mécaniques en une succession d’événements moléculaires, comme les cassures directes double brin, les cassures induites par des espèces oxydantes (générées dans la solution), ou la conformation de l’ADN. |
Cette étude [11] est la première observation en temps réel de la dégradation mécanique d’une fibre d’ADN sous rayonnement thérapeutique. Le protocole expérimental et la modélisation ouvrent la voie aux études fondamentales et cliniques des mécanismes de dégradation de l’ADN sous faisceaux ionisants en vue de l’amélioration des traitements des tumeurs par radiothérapie. Le faible coût et l’intégration à grande échelle des dispositifs MEMS à base de silicium, tels que le SNT permettent d’entrevoir des traitements de radiothérapie spécifiques pour chaque patient [12] (→).
(→) Voir la Synthèse de N. Foray et al, m/s n° 4, avril 2013, page 397
Une biopsie réalisée chez le patient pourrait ainsi être mise en culture, l’ADN extrait placé dans la lyse cellulaire puis irradié afin d’évaluer l’efficacité potentielle de l’irradiation. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail collaboratif (LIMMS/CNRS-IIS UMI 2820) a été développé dans le cadre du projet SMMiL-E et a permis la conception et la réalisation des SNT. Les irradiations ont été conduites au centre de radiothérapie Oscar Lambret de Lille. Les études théoriques, comme le transfert de technologie SNT, ont été menées à l’IEMN UMR8520.
|
Footnotes |
1.
Sonntag C. The chemical basis of radiation biology . London: : Taylor and Francis; , 1987. 2.
Henle ES, Roots R, Holley WR, et al. DNA strand breakage is correlated with unaltered base release after gamma irradiation . Radiat Res. 1995; ; 143 : :144.–150. 3.
Bernhard WA, Mroczka N, Barnes J. Combination is the dominant free radical process initiated in DNA by ionizing radiation: an overview based on solid-state EPR studies . Int J Radiat Biol. 1994; ; 66 : :491.–497. 4.
Smith S, Cui Y, Bustamante C. Overstretching B-DNA: the elastic response of individual double-stranded and single-stranded DNA molecules . Science. 1996; ; 271 : :795.–799. 5.
Strick T, Allemand J, Bensimon D, et al. The elasticity of a single supercoiled DNA molecule . Science. 1996; ; 271 : :1835.–1837. 6.
Petersen KE. Silicon as a mechanical material . Proc IEEE. 1982; ; 70 : :420.–457. 7.
Yamahata C, Collard D, Legrand B, et al. Silicon nanotweezers with subnanometer resolution for the micromanipulation of biomolecules . J Microelectromech Sys. 2008; ; 17 : :623.–631. 8.
Tarhan MC, Lafitte N, Tauran Y, et al. A rapid and practical technique for real-time monitoring of biomolecular interactions using mechanical responses of macromolecules . Sci Rep. 2016; ; 6 : :28001.. 9.
Hashiguchi G, Goda T, Hosogi M, et al. DNA manipulation and retrieval from an aqueous solution with micromachined nanotweezers . Anal Chem. 2003; ; 75 : :4347.–4350. 10.
Tilmans HAC. Equivalent circuit representation of electromechanical transducers. I. Lumped parameter systems . J Micromech Microeng. 1996;; 6 : :157.–176. 11.
Perret G, Lacornerie T, Manca F, et al. Real-time mechanical characterization of DNA degradation under therapeutic X-rays and its theoretical modeling . Microsystems Nanoengineering. 2016; ; 2 : :16062.. 12.
Foray N, Colin C, Bourguignon M. Radiosensibilité L’évidence d’un facteur individuel . Med Sci (Paris). 2013; ; 29 : :397.–403. |