| |
| Med Sci (Paris). 33(12): 1032–1035. doi: 10.1051/medsci/20173312005.La face cachée du poumon : une usine à plaquettes et une réserve de progéniteurs sanguins Emma Lefrançais1a and Mark Roberts Looney1 1Université de Californie, San Francisco HSE 1355A – 513 parnassus ave, San Francisco, CA-94143-0130, États-Unis MeSH keywords: |
La circulation pulmonaire est une usine à plaquettes Les plaquettes sont des cellules dépourvues de noyau qui circulent dans le sang et participent activement à la coagulation, à l’intégrité vasculaire et à l’immunité. En moyenne, 150 à 400 milliards de plaquettes par litre de sang circulent chez l’homme (1 000 milliards chez la souris). La durée de vie de ces cellules étant de quelques jours, cent milliards de plaquettes sont produites quotidiennement afin de maintenir un niveau sanguin constant. Ces plaquettes proviennent de larges cellules appelées mégacaryocytes, qui ont été décrites pour la première fois en 1890 par Howell [1, 2] (→). (→) Voir la Nouvelle de N. Debili et W. Vainchenker, m/s n° 5, mai 2008, page 467 Si le rôle du mégacaryocyte dans la formation des plaquettes proposé par Wright, en 1906, a été rapidement admis [3], les questions du mécanisme et du lieu de leur production sont restées plus controversées. Les mégacaryocytes se développent dans la moelle osseuse, et l’on suppose que la production des plaquettes, aussi appelée thrombopoïèse, s’y produit également chez l’adulte [4] (→).
(→) Voir la synthèse de L. Lebreton et al., m/s n° 3, mars 2016, page 290
En 1937, Howell et Donahue observèrent l’existence de deux populations de mégacaryocytes : l’une dans la moelle osseuse et l’autre dans les poumons. Ils proposèrent alors que des plaquettes pouvaient être produites par fragmentation, dans la circulation pulmonaire [5]. Cette hypothèse faisait écho à un nombre important d’observations mettant en évidence la présence de mégacaryocytes au niveau des poumons chez l’homme, mais également chez les animaux. La contribution du poumon en tant que site actif de la thrombopoïèse est cependant demeurée débattue par manque de preuve directe. Grâce au développement de la technique de microscopie intravitale bi-photonique pour le poumon [6], nous avons pu observer des poumons de souris in vivo et nous fournissons, pour la première fois, la preuve directe que la libération de plaquettes s’y produit physiologiquement [7]. Ces données ont été générées en utilisant des lignées de souris (les souris PF4-GFP) qui expriment la GFP (green fluorescent protein) placée sous le contrôle du promoteur du facteur-4 (PF4), une protéine plaquettaire qui lie l’héparine. Ce gène rapporteur permet de détecter aisément les plaquettes et les mégacaryocytes chez ces souris. Nous avons pu ainsi observer des mégacaryocytes et de larges fragments cytoplasmiques piégés dans la circulation pulmonaire, libérant chacun, durant 20 à 60 minutes, entre 500 et 1 000 plaquettes (Figure 1). En extrapolant à l’ensemble du volume pulmonaire, on peut donc estimer que la moitié de la production des plaquettes, chez la souris, peut être attribuée à une thrombopoïèse pulmonaire.
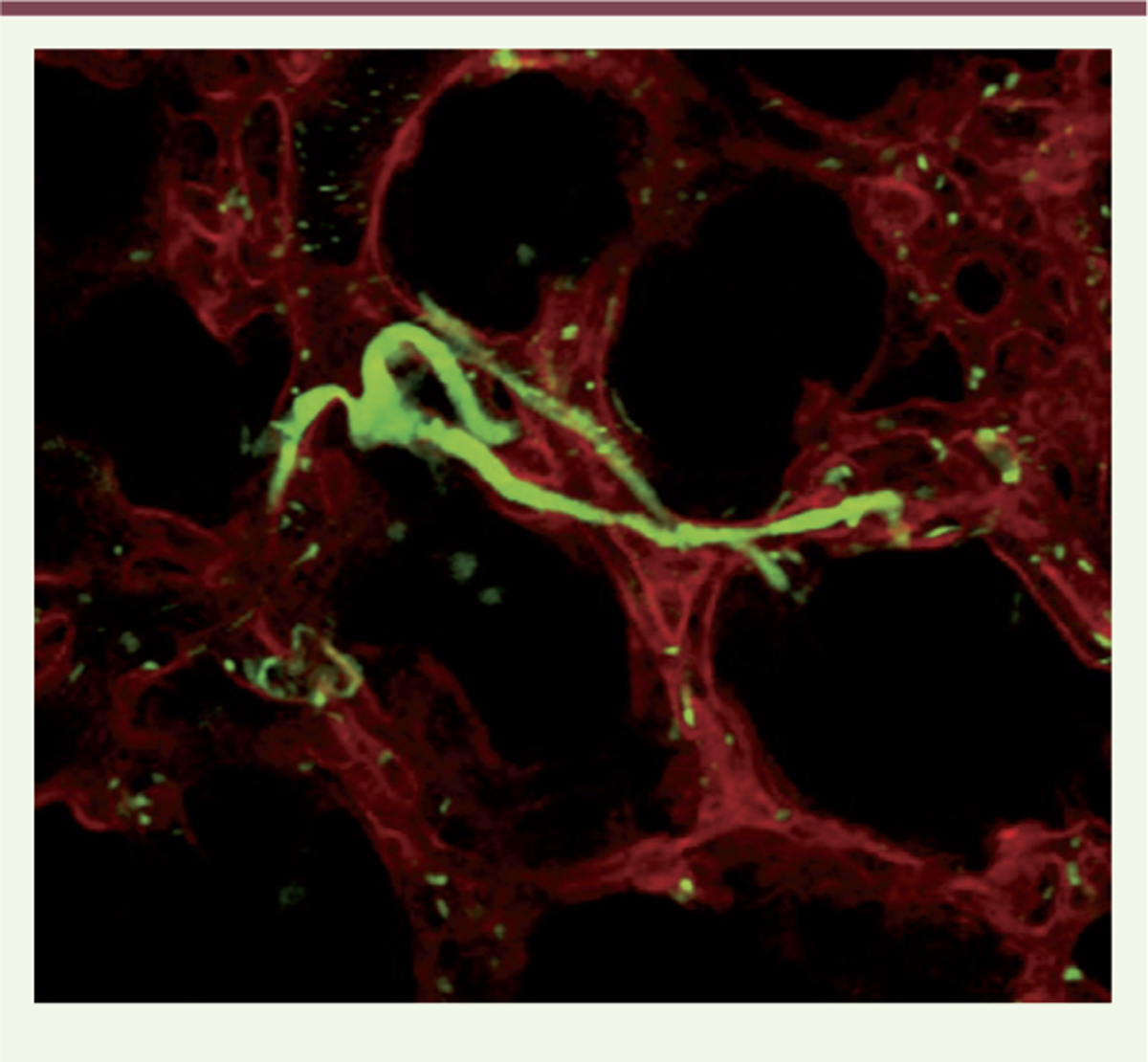
 | Figure 1.
Microscopie intravitale 2-photons dans le poumon. Production de plaquettes à partir de mégacaryocytes (visualisées grâce au gène rapporteur GFP [green fluorescent protein], en vert) dans la circulation pulmonaire (en rouge) observée par microscopie intravitale, chez la souris. |
Quelle est l’origine de ces mégacaryocytes ? En transplantant des poumons de souris n’exprimant pas la GFP dans les souris PF4-GFP, nous avons montré que les mégacaryocytes producteurs de plaquettes dans la circulation pulmonaire provenaient d’autres organes. En effet, la visualisation directe, à l’aide du gène rapporteur fluorescent, met en évidence la présence de mégacaryocytes résidants au niveau de la rate et de la moelle osseuse, où ils libèrent de grands fragments cytoplasmiques, comme cela avait été montré en 2007 [8]. Nous avons également observé des mégacaryocytes qui quittent la moelle osseuse et entrent dans la circulation sanguine, confirmant ainsi le modèle selon lequel les mégacaryocytes, et de larges fragments cytoplasmiques, sortent de la moelle osseuse (et/ou de la rate) et circulent jusqu’aux poumons où ils libèrent les plaquettes (Figure 2A). Les contraintes physiques dues aux étroits vaisseaux pulmonaires, premier lit vasculaire rencontré par les mégacaryocytes, favorisent la libération des plaquettes ; des interactions et signaux spécifiques entre cellules pulmonaires et mégacaryocytes, qui rendraient le poumon propice à la thrombopoïèse, ne peuvent toutefois être exclus. La poursuite de ces études est donc nécessaire afin de rechercher et valider l’existence de tels signaux. L’étude des mécanismes impliqués dans la formation des plaquettes dans le poumon permettra, de plus, une meilleure compréhension de leur régulation.
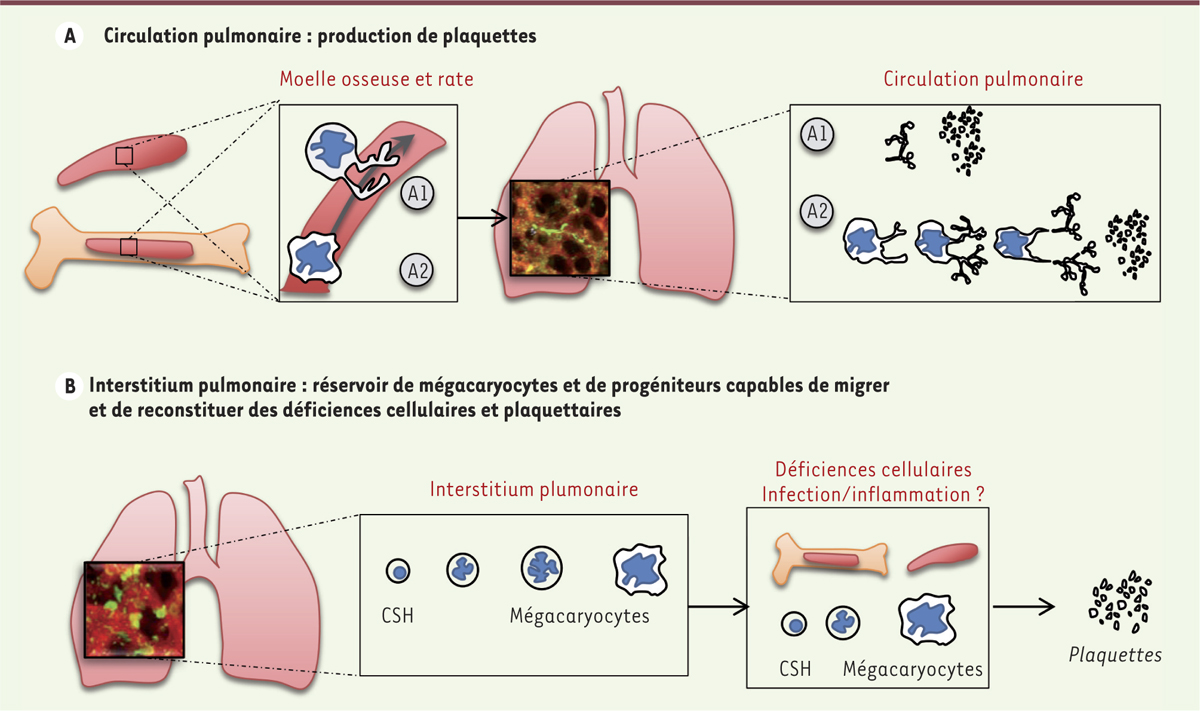
 | Figure 2.
Rôle du poumon dans la biogenèse des plaquettes. Le rôle du poumon est double et la biogenèse des plaquettes se produit dans deux compartiments différents. A. Production de plaquettes dans la circulation pulmonaire. Après avoir été libérés de la moelle osseuse ou de la rate, les proplaquettes (A1) et les mégacaryocytes (A2) sont retenus dans les vaisseaux du poumon, le premier lit capillaire rencontré, où l’extension des proplaquettes et la libération finale des plaquettes sont observées. B. L’insterstitium pulmonaire est un réservoir de mégacaryocytes, et de progéniteurs capables de migrer et de restaurer des déficiences cellulaires et plaquettaires. Il présente de nombreux mégacaryocytes matures et immatures, ainsi que des cellules souches hématopoïétiques (CSH) capables de migrer hors du poumon. |
|
Rôle du poumon dans l’hématopoïèse et l’inflammation À côté de cette population de mégacaryocytes intravasculaires productrice de plaquettes, nous avons identifié une deuxième population de mégacaryocytes, majoritairement plus immatures, qui résident dans l’interstitium pulmonaire (Figure 2B). Ces mégacaryocytes extravasculaires dérivés du poumon sont plus exposés aux pathogènes que les mégacaryocytes dérivés de la moelle osseuse. Ils expriment ainsi de nombreux gènes associés à l’immunité innée, à l’inflammation et à la reconnaissance des pathogènes. Ce résultat particulièrement intéressant suggère donc une fonction dans l’inflammation pour ces cellules qui sont stratégiquement positionnées dans le poumon. Afin de déterminer le rôle de ces cellules résidentes dans la production de plaquettes, nous avons transplanté des poumons perfusés sains dans des animaux thrombocytopéniques, déficients en plaquettes et en cellules souches hématopoïétiques. Les cellules présentes dans le poumon, provenant des animaux sains, sont capables de migrer vers la moelle osseuse des animaux thrombocytopéniques où elles reconstituent un nombre de plaquettes normal. Elles contribuent également à l’hématopoïèse de plusieurs lignées cellulaires, et cela, plusieurs mois après la transplantation (Figure 2B), indiquant l’existence, dans le poumon, non seulement de mégacaryocytes, mais également de progéniteurs de cellules sanguines. La présence de ces cellules souches hématopoïétiques au sein du poumon, a été confirmée par l’analyse en cytométrie de flux, de marqueurs spécifiques (Lin-[marqueur spécifique de lignage]/CD45+/Sca1+[stem cell antigen-1]/Ckit+ [stem cell factor receptor]/CD48-). Le poumon est donc non seulement un organe servant à la respiration, mais il constitue également un organe hématopoïétique à l’origine de cellules sanguines. Cette découverte apparaît particulièrement importante, notamment au cours des greffes. Cependant l’origine de ces cellules, les mécanismes de leur migration, ainsi que leur rôle exact dans le poumon, en conditions physiologiques et pathologiques, restent à élucider. |
Production de plaquettes dans le poumon chez l’homme ? La contribution du poumon dans la formation des plaquettes est-elle importante chez l’homme ? Observer la circulation pulmonaire chez l’homme est difficile. Plusieurs preuves indirectes indiquant que le poumon joue un rôle important dans la thrombopoïèse humaine existent cependant. Comme ceux de la souris, les poumons humains hébergent en effet des mégacaryocytes et le nombre de plaquettes dans le sang est plus élevé à la sortie du poumon que celui contenu dans le flux entrant [5]. Les patients ayant subi un pontage cardiopulmonaire ont également un faible nombre de plaquettes. Et le nombre de mégacaryocytes circulants est augmenté chez ces patients (ceci avait été attribué au rôle du lit vasculaire pulmonaire dans la thrombopoïèse) [9]. De plus, Fuentes et al. [10] ont montré que des mégacaryocytes humains infusés chez des souris, étaient piégés, de manière transitoire, dans les poumons, et qu’ils libéraient une onde de plaquettes dans un délai similaire à celui que nous avons décrit [11]. Le piégeage des mégacaryocytes au sein du poumon est donc, potentiellement, un mécanisme de libération des plaquettes. |
Perspectives thérapeutiques Ces résultats ouvrent de nouvelles voies pour améliorer les traitements des thrombocytopénies, des maladies qui affectent des millions de patients dans le monde. Le développement des transfusions de plaquettes obtenues à partir de mégacaryocytes cultivés in vitro, a suscité un grand intérêt, mais leur qualité n’est pas comparable à celle des plaquettes provenant de donneurs [12]. Comprendre comment la vascularisation pulmonaire contribue à la libération des plaquettes pourrait donc conduire au développement de bioréacteurs plus physiologiques. Alternativement, des infusions directes de mégacaryocytes chez les patients pourraient être proposées, en laissant au poumon du receveur, le soin d’agir comme bioréacteur de la production de plaquettes matures. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Howell WH. Observations upon the occurrence, structure, and function of the giant cells of the marrow . J Morphol. 1890; ; 4 : :117.–130. 2.
Debili N, Vainchenker W. De macro à micro : l’histoire de la plaquette . Med Sci (Paris). 2008; ; 24 : :467.–469. 3.
Wright J. The origin and nature of blood platelets . Boston Med Surg J. 1906; ; 154 : :643.–645. 4.
Lebreton L, Tuffigo M, Pillois X, Fiore M. L’intégrine αIIbβ3 : une actrice insoupçonnée dans la formation des plaquettes sanguines . Med Sci (Paris). 2016; ; 32 : :290.–296. 5.
Howell WH, Donahue DD. The production of blood platelets in the lungs . J Exp Med. 1937; ; 65 : :177.–203. 6.
Looney MR, Thornton EE, Sen D, et al. Stabilized imaging of immune surveillance in the mouse lung . Nat Methods. 2011; ; 8 : :91.–96. 7.
Lefrancais E, Ortiz-Munoz G, Caudrillier A, et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors . Nature. 2017; ; 544 : :105.–109. 8.
Junt T, Schulze H, Chen Z, et al. Dynamic visualization of thrombopoiesis within bone marrow . Science. 2007; ; 317 : :1767.–1770. 9.
Lill MC, Perloff JK, Child JS. Pathogenesis of thrombocytopenia in cyanotic congenital heart disease . Am J Cardiol. 2006; ; 98 : :254.–258. 10.
Fuentes R, Wang Y, Hirsch J, et al. Infusion of mature megakaryocytes into mice yields functional platelets . J Clin Invest. 2010; ; 120 : :3917.–3922. 11.
Wang Y, Hayes V, Jarocha D, et al. Comparative analysis of human ex vivo-generated platelets vs megakaryocyte-generated platelets in mice: a cautionary tale . Blood. 2015; ; 125 : :3627.–3636. 12.
Sim X, Poncz M, Gadue P, French DL. Understanding platelet generation from megakaryocytes: implications for in vitro-derived platelets . Blood. 2016; ; 127 : :1227.–1233. |