Activité physique et pathologies
2008
| ANALYSE |
18-
Maladies respiratoires
Ce chapitre présente tout d’abord quelques notions sur les principales maladies respiratoires à propos desquelles l’activité physique peut jouer un rôle. De rares travaux se sont intéressés à l’activité physique comme moyen de prévention dans les maladies respiratoires. En revanche, l’utilisation de l’activité physique comme outil thérapeutique dans la broncho-pneumopathie chronique obstructive est validée et ses bases physiologiques bien établies.
L’analyse des résultats de différentes modalités de cette prise en charge en souligne les limites et plus particulièrement les mécanismes qui peuvent les expliquer. Pour terminer le chapitre, les risques liés à l’activité physique seront évoqués. Quasiment nuls lorsque l’activité physique est utilisée à titre thérapeutique, ils peuvent devenir majeurs lorsque cette même activité devient un sport de haut niveau.
Principales maladies respiratoires
La broncho-pneumopathie chronique obstructive (BPCO), les cancers du poumon et l’asthme bronchique sont les affections respiratoires les plus courantes dans nos contrées. Ces pathologies bénéficient de l’activité physique comme d’autres maladies respiratoires à la prévalence moins importante.
La BPCO est une maladie respiratoire d’apparition progressive que l’on peut traiter et prévenir. Elle est caractérisée par une limitation des débits bronchiques qui n’est pas complètement réversible. C’est une maladie inflammatoire liée aux particules nocives, contenues en particulier dans le tabac. Son évolution se caractérise par l’apparition d’altérations systémiques (musculaires, cardiovasculaires, endocriniennes, psychologiques…) (Celli et MacNee, 2004 ). Autrement dit, il s’agit d’une maladie broncho-pulmonaire initiale (maladie primaire) entraînant progressivement des atteintes systémiques (maladie secondaire) qui conditionneront le pronostic. On peut dire aujourd’hui que la BPCO est une maladie générale à point de départ respiratoire dont l’augmentation continuelle de la prévalence en fait un problème de santé publique majeur (Murray et Lopez, 1997a
). Autrement dit, il s’agit d’une maladie broncho-pulmonaire initiale (maladie primaire) entraînant progressivement des atteintes systémiques (maladie secondaire) qui conditionneront le pronostic. On peut dire aujourd’hui que la BPCO est une maladie générale à point de départ respiratoire dont l’augmentation continuelle de la prévalence en fait un problème de santé publique majeur (Murray et Lopez, 1997a et b
et b ). L’activité physique va essentiellement avoir pour rôle de traiter les atteintes systémiques et par ce biais d’améliorer considérablement l’état de santé du patient (Nici et coll., 2006
). L’activité physique va essentiellement avoir pour rôle de traiter les atteintes systémiques et par ce biais d’améliorer considérablement l’état de santé du patient (Nici et coll., 2006 ). Le nombre de travaux à ce sujet est remarquable, les premières méta-analyses étant apparues en 1996 et ayant systématiquement donné des résultats positifs. L’activité physique est actuellement intégrée à part entière dans le traitement de la BPCO. C’est la seule thérapeutique de niveau A en termes d’« evidence-based medicine »1
, avec l’oxygénothérapie pour les malades les plus graves, dans la prise en charge de cette maladie (MacIntyre, 2001
). Le nombre de travaux à ce sujet est remarquable, les premières méta-analyses étant apparues en 1996 et ayant systématiquement donné des résultats positifs. L’activité physique est actuellement intégrée à part entière dans le traitement de la BPCO. C’est la seule thérapeutique de niveau A en termes d’« evidence-based medicine »1
, avec l’oxygénothérapie pour les malades les plus graves, dans la prise en charge de cette maladie (MacIntyre, 2001 ).
).
 ). Autrement dit, il s’agit d’une maladie broncho-pulmonaire initiale (maladie primaire) entraînant progressivement des atteintes systémiques (maladie secondaire) qui conditionneront le pronostic. On peut dire aujourd’hui que la BPCO est une maladie générale à point de départ respiratoire dont l’augmentation continuelle de la prévalence en fait un problème de santé publique majeur (Murray et Lopez, 1997a
). Autrement dit, il s’agit d’une maladie broncho-pulmonaire initiale (maladie primaire) entraînant progressivement des atteintes systémiques (maladie secondaire) qui conditionneront le pronostic. On peut dire aujourd’hui que la BPCO est une maladie générale à point de départ respiratoire dont l’augmentation continuelle de la prévalence en fait un problème de santé publique majeur (Murray et Lopez, 1997a et b
et b ). L’activité physique va essentiellement avoir pour rôle de traiter les atteintes systémiques et par ce biais d’améliorer considérablement l’état de santé du patient (Nici et coll., 2006
). L’activité physique va essentiellement avoir pour rôle de traiter les atteintes systémiques et par ce biais d’améliorer considérablement l’état de santé du patient (Nici et coll., 2006 ). Le nombre de travaux à ce sujet est remarquable, les premières méta-analyses étant apparues en 1996 et ayant systématiquement donné des résultats positifs. L’activité physique est actuellement intégrée à part entière dans le traitement de la BPCO. C’est la seule thérapeutique de niveau A en termes d’« evidence-based medicine »1
, avec l’oxygénothérapie pour les malades les plus graves, dans la prise en charge de cette maladie (MacIntyre, 2001
). Le nombre de travaux à ce sujet est remarquable, les premières méta-analyses étant apparues en 1996 et ayant systématiquement donné des résultats positifs. L’activité physique est actuellement intégrée à part entière dans le traitement de la BPCO. C’est la seule thérapeutique de niveau A en termes d’« evidence-based medicine »1
, avec l’oxygénothérapie pour les malades les plus graves, dans la prise en charge de cette maladie (MacIntyre, 2001 ).
).La maladie asthmatique est une maladie inflammatoire des voies aériennes. Elle induit une limitation des débits bronchiques, réversible, ainsi qu’une hyper-réactivité des voies aériennes. Celle-ci conduit à des épisodes récurrents de dyspnée aiguë réversibles spontanément ou sous traitement. La maladie asthmatique résulte de la conjonction entre facteurs congénitaux et environnementaux (National Heart, Lung and Blood Institute et World Health Organization, 1995 ). Jusque dans la deuxième moitié du XXe siècle, le sport voire l’activité physique étaient contre-indiqués dans cette maladie, ce qui serait actuellement une faute professionnelle. Depuis, l’activité physique et la majorité des sports sont conseillés chez l’asthmatique ; au XXIe siècle, ils ne peuvent être considérés comme une thérapeutique mais comme une prévention.
). Jusque dans la deuxième moitié du XXe siècle, le sport voire l’activité physique étaient contre-indiqués dans cette maladie, ce qui serait actuellement une faute professionnelle. Depuis, l’activité physique et la majorité des sports sont conseillés chez l’asthmatique ; au XXIe siècle, ils ne peuvent être considérés comme une thérapeutique mais comme une prévention.
 ). Jusque dans la deuxième moitié du XXe siècle, le sport voire l’activité physique étaient contre-indiqués dans cette maladie, ce qui serait actuellement une faute professionnelle. Depuis, l’activité physique et la majorité des sports sont conseillés chez l’asthmatique ; au XXIe siècle, ils ne peuvent être considérés comme une thérapeutique mais comme une prévention.
). Jusque dans la deuxième moitié du XXe siècle, le sport voire l’activité physique étaient contre-indiqués dans cette maladie, ce qui serait actuellement une faute professionnelle. Depuis, l’activité physique et la majorité des sports sont conseillés chez l’asthmatique ; au XXIe siècle, ils ne peuvent être considérés comme une thérapeutique mais comme une prévention.Le cancer broncho-pulmonaire est une maladie dont la prévalence augmente également de manière préoccupante. Comme tous les cancers, il bénéficie à titre de prévention et à titre pronostique de l’activité physique. Le cancer broncho-pulmonaire est traité dans un chapitre consacré aux cancers.
D’autres maladies respiratoires telles que les pneumopathies interstitielles diffuses, les dilatations des bronches, la mucoviscidose… peuvent bénéficier de l’activité physique mais les travaux à leur sujet sont trop peu nombreux pour en extraire des recommandations (Nici et coll., 2006 ).
).
 ).
).Activités physiques et prévention des maladies respiratoires
Les travaux portant sur la prévention des maladies respiratoires (en particulier sur la BPCO) par l’activité physique sont rares. Il faut insister sur une étude récente ayant suivi 6 790 sujets sur 11 ans. Cette étude montre que les fumeurs pratiquant une activité physique égale ou supérieure à deux heures par semaine, quelle que soit son intensité, ont un risque réduit de développer une BPCO comparativement aux fumeurs réalisant moins de deux heures d’activité physique par semaine (Odds ratio=0,77 ; IC 95 % [0,61-0,97]) (Garcia-Aymerich et coll., 2007 ).
).
 ).
).Concernant le rôle de l’activité physique pour prévenir les complications de la BPCO, la même équipe a suivi, pendant 20 ans, 2 386 patients atteints de cette maladie. Une activité physique de type marche ou vélo à raison de deux heures ou plus par semaine entraîne une diminution des hospitalisations et de la mortalité d’origine respiratoire pouvant atteindre 40 % (Garcia-Aymerich et coll., 2006 ).
).
 ).
).Bases physiopathologiques des effets de l’activité physique dans la BPCO
Historiquement, l’intolérance à l’effort caractéristique des malades présentant une BPCO était considérée comme la conséquence de la maladie respiratoire. La fonction respiratoire était l’élément limitant de la capacité d’exercice, caractérisé par une dyspnée d’effort d’origine purement respiratoire (Jones et coll., 1971 ). Toutefois, il était constaté, dès cette époque, que l’activité physique réduisait les atteintes musculaires de la dyspnée chronique des patients, améliorait leur tolérance à l’effort sans modifier leur fonction respiratoire. Ceci amena en 1983 au modèle théorique de Young (Young, 1983
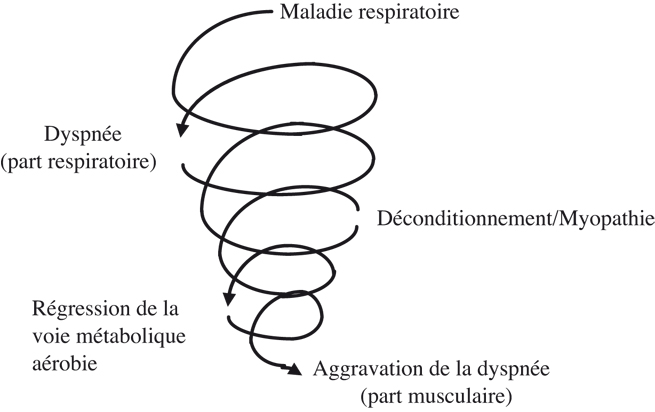
). Toutefois, il était constaté, dès cette époque, que l’activité physique réduisait les atteintes musculaires de la dyspnée chronique des patients, améliorait leur tolérance à l’effort sans modifier leur fonction respiratoire. Ceci amena en 1983 au modèle théorique de Young (Young, 1983 ) dit de la spirale du déconditionnement ou du cercle vicieux de la dyspnée. Dans ce modèle (figure 18.1
) dit de la spirale du déconditionnement ou du cercle vicieux de la dyspnée. Dans ce modèle (figure 18.1 ), la dyspnée (part respiratoire), engendrée par la maladie respiratoire, induit une sédentarisation du patient. D’un point de vue histo-pathologique apparaît un déconditionnement c’est-à-dire une diminution du nombre de fibres musculaires oxydatives (dites de type I). Pour un effort donné, le système anaérobie lactique (fibres de type II) prend le relais du système oxydatif défaillant avec pour conséquence une libération accrue et précoce d’acide lactique. Directement ou indirectement, cette lactacidémie entraîne une augmentation de la ventilation et donc une aggravation de la dyspnée (part musculaire) (Young, 1983
), la dyspnée (part respiratoire), engendrée par la maladie respiratoire, induit une sédentarisation du patient. D’un point de vue histo-pathologique apparaît un déconditionnement c’est-à-dire une diminution du nombre de fibres musculaires oxydatives (dites de type I). Pour un effort donné, le système anaérobie lactique (fibres de type II) prend le relais du système oxydatif défaillant avec pour conséquence une libération accrue et précoce d’acide lactique. Directement ou indirectement, cette lactacidémie entraîne une augmentation de la ventilation et donc une aggravation de la dyspnée (part musculaire) (Young, 1983 ; Préfaut et coll., 1995
; Préfaut et coll., 1995 ).
).
 ). Toutefois, il était constaté, dès cette époque, que l’activité physique réduisait les atteintes musculaires de la dyspnée chronique des patients, améliorait leur tolérance à l’effort sans modifier leur fonction respiratoire. Ceci amena en 1983 au modèle théorique de Young (Young, 1983
). Toutefois, il était constaté, dès cette époque, que l’activité physique réduisait les atteintes musculaires de la dyspnée chronique des patients, améliorait leur tolérance à l’effort sans modifier leur fonction respiratoire. Ceci amena en 1983 au modèle théorique de Young (Young, 1983 ) dit de la spirale du déconditionnement ou du cercle vicieux de la dyspnée. Dans ce modèle (figure 18.1
) dit de la spirale du déconditionnement ou du cercle vicieux de la dyspnée. Dans ce modèle (figure 18.1 ), la dyspnée (part respiratoire), engendrée par la maladie respiratoire, induit une sédentarisation du patient. D’un point de vue histo-pathologique apparaît un déconditionnement c’est-à-dire une diminution du nombre de fibres musculaires oxydatives (dites de type I). Pour un effort donné, le système anaérobie lactique (fibres de type II) prend le relais du système oxydatif défaillant avec pour conséquence une libération accrue et précoce d’acide lactique. Directement ou indirectement, cette lactacidémie entraîne une augmentation de la ventilation et donc une aggravation de la dyspnée (part musculaire) (Young, 1983
), la dyspnée (part respiratoire), engendrée par la maladie respiratoire, induit une sédentarisation du patient. D’un point de vue histo-pathologique apparaît un déconditionnement c’est-à-dire une diminution du nombre de fibres musculaires oxydatives (dites de type I). Pour un effort donné, le système anaérobie lactique (fibres de type II) prend le relais du système oxydatif défaillant avec pour conséquence une libération accrue et précoce d’acide lactique. Directement ou indirectement, cette lactacidémie entraîne une augmentation de la ventilation et donc une aggravation de la dyspnée (part musculaire) (Young, 1983 ; Préfaut et coll., 1995
; Préfaut et coll., 1995 ).
).Il a fallu attendre la fin du XXe siècle et le début du XXIe pour que cette atteinte musculaire périphérique soit documentée. Tout d’abord, la fonction musculaire est extrêmement altérée tout au moins en ce qui concerne le quadriceps qui a fait l’objet de la grande majorité des travaux. Ainsi, la force musculaire est diminuée de 33 % en moyenne (Bernard et coll., 1998 ; Marquis et coll., 2002
; Marquis et coll., 2002 ; Couillard et coll., 2003
; Couillard et coll., 2003 ; Debigare et coll., 2003
; Debigare et coll., 2003 ; Allaire et coll., 2004
; Allaire et coll., 2004 ). Compte tenu de la relation étroite entre force et masse musculaire, cela implique une diminution d’un tiers de cette même masse musculaire. Ceci a été confirmé en 1998 par l’équipe québécoise de Maltais (Bernard et coll., 1998
). Compte tenu de la relation étroite entre force et masse musculaire, cela implique une diminution d’un tiers de cette même masse musculaire. Ceci a été confirmé en 1998 par l’équipe québécoise de Maltais (Bernard et coll., 1998 ). La même équipe a montré quelques années plus tard qu’une altération sévère de la fonction ventilatoire lorsqu’elle était associée à une atrophie importante du quadriceps entraînait une espérance de vie à 5 ans de 30 % alors qu’elle était de 75 % si l’atrophie était seulement modérée (Marquis et coll., 2002
). La même équipe a montré quelques années plus tard qu’une altération sévère de la fonction ventilatoire lorsqu’elle était associée à une atrophie importante du quadriceps entraînait une espérance de vie à 5 ans de 30 % alors qu’elle était de 75 % si l’atrophie était seulement modérée (Marquis et coll., 2002 ). La capacité d’endurance du quadriceps, fonction physiologique fondamentale, est altérée de façon majeure avec une diminution moyenne de 57 % (Serres et coll., 1998a
). La capacité d’endurance du quadriceps, fonction physiologique fondamentale, est altérée de façon majeure avec une diminution moyenne de 57 % (Serres et coll., 1998a ; Couillard et coll., 2003
; Couillard et coll., 2003 ; Debigare et coll., 2003
; Debigare et coll., 2003 ; Allaire et coll., 2004
; Allaire et coll., 2004 ; Coronell et coll., 2004
; Coronell et coll., 2004 ; Koechlin et coll., 2004a
; Koechlin et coll., 2004a ;). C’est la baisse de l’endurance qui majore la dyspnée, diminue la tolérance à l’effort et altère au quotidien la qualité de vie des patients atteints de BPCO.
;). C’est la baisse de l’endurance qui majore la dyspnée, diminue la tolérance à l’effort et altère au quotidien la qualité de vie des patients atteints de BPCO.
 ; Marquis et coll., 2002
; Marquis et coll., 2002 ; Couillard et coll., 2003
; Couillard et coll., 2003 ; Debigare et coll., 2003
; Debigare et coll., 2003 ; Allaire et coll., 2004
; Allaire et coll., 2004 ). Compte tenu de la relation étroite entre force et masse musculaire, cela implique une diminution d’un tiers de cette même masse musculaire. Ceci a été confirmé en 1998 par l’équipe québécoise de Maltais (Bernard et coll., 1998
). Compte tenu de la relation étroite entre force et masse musculaire, cela implique une diminution d’un tiers de cette même masse musculaire. Ceci a été confirmé en 1998 par l’équipe québécoise de Maltais (Bernard et coll., 1998 ). La même équipe a montré quelques années plus tard qu’une altération sévère de la fonction ventilatoire lorsqu’elle était associée à une atrophie importante du quadriceps entraînait une espérance de vie à 5 ans de 30 % alors qu’elle était de 75 % si l’atrophie était seulement modérée (Marquis et coll., 2002
). La même équipe a montré quelques années plus tard qu’une altération sévère de la fonction ventilatoire lorsqu’elle était associée à une atrophie importante du quadriceps entraînait une espérance de vie à 5 ans de 30 % alors qu’elle était de 75 % si l’atrophie était seulement modérée (Marquis et coll., 2002 ). La capacité d’endurance du quadriceps, fonction physiologique fondamentale, est altérée de façon majeure avec une diminution moyenne de 57 % (Serres et coll., 1998a
). La capacité d’endurance du quadriceps, fonction physiologique fondamentale, est altérée de façon majeure avec une diminution moyenne de 57 % (Serres et coll., 1998a ; Couillard et coll., 2003
; Couillard et coll., 2003 ; Debigare et coll., 2003
; Debigare et coll., 2003 ; Allaire et coll., 2004
; Allaire et coll., 2004 ; Coronell et coll., 2004
; Coronell et coll., 2004 ; Koechlin et coll., 2004a
; Koechlin et coll., 2004a ;). C’est la baisse de l’endurance qui majore la dyspnée, diminue la tolérance à l’effort et altère au quotidien la qualité de vie des patients atteints de BPCO.
;). C’est la baisse de l’endurance qui majore la dyspnée, diminue la tolérance à l’effort et altère au quotidien la qualité de vie des patients atteints de BPCO. | Figure 18.1 Spirale de la dyspnée chez le malade respiratoire chronique (d’après Young, 1983 ; Préfaut et coll., 1995 ; Préfaut et coll., 1995 |
Les altérations fonctionnelles sont sous-tendues par des modifications histochimiques majeures : diminution drastique des fibres musculaires oxydatives de type I au profit des fibres lactiques de type IIx (Gosker et coll., 2000 ; Couillard et Préfaut, 2005
; Couillard et Préfaut, 2005 ), réduction importante du nombre et de la surface des vaisseaux capillaires musculaires, diminution drastique des enzymes de la voie oxydative au profit de celles de la voie lactique (Maltais et coll., 1996
), réduction importante du nombre et de la surface des vaisseaux capillaires musculaires, diminution drastique des enzymes de la voie oxydative au profit de celles de la voie lactique (Maltais et coll., 1996 ; Serres et coll., 1998b
; Serres et coll., 1998b ; Allaire et coll., 2004
; Allaire et coll., 2004 ).
).
 ; Couillard et Préfaut, 2005
; Couillard et Préfaut, 2005 ), réduction importante du nombre et de la surface des vaisseaux capillaires musculaires, diminution drastique des enzymes de la voie oxydative au profit de celles de la voie lactique (Maltais et coll., 1996
), réduction importante du nombre et de la surface des vaisseaux capillaires musculaires, diminution drastique des enzymes de la voie oxydative au profit de celles de la voie lactique (Maltais et coll., 1996 ; Serres et coll., 1998b
; Serres et coll., 1998b ; Allaire et coll., 2004
; Allaire et coll., 2004 ).
).Les objectifs physiopathologiques du réentraînement à l’exercice chez le 436 sujet atteint de BPCO sont donc clairs. Il s’agit de remonter la spirale de la dyspnée ou du cercle vicieux du déconditionnement en créant un cercle « vertueux » de l’activité physique. Celui-ci re-développera la voie métabolique aérobie des muscles périphériques et par là même diminuera l’hyperventilation, c’est-à-dire la part musculaire de la dyspnée, augmentera la tolérance à l’effort et améliorera la qualité de vie.
Prescription de l’activité physique chez le sujet atteint de BPCO
La prescription de l’activité physique chez le sujet atteint de BPCO comporte 4 composantes : le réentraînement à l’exercice en endurance ou pierre angulaire de cette thérapeutique (45±15 minutes de vélo, marche, natation…), le travail musculaire contre résistance, les étirements musculaires et le travail en équilibre. Cette prescription se décline selon 4 paramètres : la durée d’une session, le nombre de celles-ci, la fréquence hebdomadaire et l’intensité de travail.
L’ensemble du monde scientifique, comme cela est rapporté dans le « task force » commun des Sociétés européennes et américaines des maladies respiratoires (Nici et coll., 2006 ), est unanime sur le fait que le minimum de sessions pour obtenir un effet cliniquement pertinent est de 20. Il est bien entendu qu’il faut poursuivre celles-ci le plus longtemps possible et d’un point de vue idéal toute la vie. Le nombre de sessions par semaine doit être égal ou supérieur à 3. Une session complète – débutant par un échauffement et des étirements se terminant par de la relaxation – se déroule sur 90 minutes.
), est unanime sur le fait que le minimum de sessions pour obtenir un effet cliniquement pertinent est de 20. Il est bien entendu qu’il faut poursuivre celles-ci le plus longtemps possible et d’un point de vue idéal toute la vie. Le nombre de sessions par semaine doit être égal ou supérieur à 3. Une session complète – débutant par un échauffement et des étirements se terminant par de la relaxation – se déroule sur 90 minutes.
 ), est unanime sur le fait que le minimum de sessions pour obtenir un effet cliniquement pertinent est de 20. Il est bien entendu qu’il faut poursuivre celles-ci le plus longtemps possible et d’un point de vue idéal toute la vie. Le nombre de sessions par semaine doit être égal ou supérieur à 3. Une session complète – débutant par un échauffement et des étirements se terminant par de la relaxation – se déroule sur 90 minutes.
), est unanime sur le fait que le minimum de sessions pour obtenir un effet cliniquement pertinent est de 20. Il est bien entendu qu’il faut poursuivre celles-ci le plus longtemps possible et d’un point de vue idéal toute la vie. Le nombre de sessions par semaine doit être égal ou supérieur à 3. Une session complète – débutant par un échauffement et des étirements se terminant par de la relaxation – se déroule sur 90 minutes.Il existe des discordances qui tiennent à l’intensité à laquelle doit se dérouler le réentraînement en endurance. Selon l’école américaine et en particulier Casaburi et coll. (1997 ), l’entraînement se fait à haut niveau d’intensité : 80 % de la consommation maximale symptôme limitée d’oxygène (VO2 max) c’est-à-dire à 80 % des possibilités maximales du patient. Il s’agit là d’une approche physiologique : plus le niveau d’entraînement est élevé, plus les résultats seront probants et perdureront dans le temps. Le point faible de cette approche est qu’à l’arrêt des sessions formelles, il est difficile de pérenniser un entraînement qui provoque dyspnée et fatigue. Par ailleurs, on ne sait pas si ce type d’entraînement induit des effets latéraux, par exemple un stress oxydatif (voir ci-dessous) qui aboutirait à un effet cellulaire inverse de ce qui est espéré.
), l’entraînement se fait à haut niveau d’intensité : 80 % de la consommation maximale symptôme limitée d’oxygène (VO2 max) c’est-à-dire à 80 % des possibilités maximales du patient. Il s’agit là d’une approche physiologique : plus le niveau d’entraînement est élevé, plus les résultats seront probants et perdureront dans le temps. Le point faible de cette approche est qu’à l’arrêt des sessions formelles, il est difficile de pérenniser un entraînement qui provoque dyspnée et fatigue. Par ailleurs, on ne sait pas si ce type d’entraînement induit des effets latéraux, par exemple un stress oxydatif (voir ci-dessous) qui aboutirait à un effet cellulaire inverse de ce qui est espéré.
 ), l’entraînement se fait à haut niveau d’intensité : 80 % de la consommation maximale symptôme limitée d’oxygène (VO2 max) c’est-à-dire à 80 % des possibilités maximales du patient. Il s’agit là d’une approche physiologique : plus le niveau d’entraînement est élevé, plus les résultats seront probants et perdureront dans le temps. Le point faible de cette approche est qu’à l’arrêt des sessions formelles, il est difficile de pérenniser un entraînement qui provoque dyspnée et fatigue. Par ailleurs, on ne sait pas si ce type d’entraînement induit des effets latéraux, par exemple un stress oxydatif (voir ci-dessous) qui aboutirait à un effet cellulaire inverse de ce qui est espéré.
), l’entraînement se fait à haut niveau d’intensité : 80 % de la consommation maximale symptôme limitée d’oxygène (VO2 max) c’est-à-dire à 80 % des possibilités maximales du patient. Il s’agit là d’une approche physiologique : plus le niveau d’entraînement est élevé, plus les résultats seront probants et perdureront dans le temps. Le point faible de cette approche est qu’à l’arrêt des sessions formelles, il est difficile de pérenniser un entraînement qui provoque dyspnée et fatigue. Par ailleurs, on ne sait pas si ce type d’entraînement induit des effets latéraux, par exemple un stress oxydatif (voir ci-dessous) qui aboutirait à un effet cellulaire inverse de ce qui est espéré.La deuxième approche, plus européenne, proposée par Clark et coll. (1996 ) et Vallet et coll. (1997
) et Vallet et coll. (1997 ), est d’ordre comportemental. Le sujet est entraîné soit au niveau de son seuil ventilatoire (entraînement individualisé) c’est-àdire à environ 55-60 % de sa VO2 symptôme limitée (terme utilisé chez les patients qui ne peuvent atteindre les critères de VO2 max), soit au niveau du seuil d’apparition de sa dyspnée. L’hypothèse est que cet entraînement, dont il a été montré qu’il était efficace, puisse se poursuivre plus facilement dans le temps, à la sortie du patient de son programme formel de réentraînement.
), est d’ordre comportemental. Le sujet est entraîné soit au niveau de son seuil ventilatoire (entraînement individualisé) c’est-àdire à environ 55-60 % de sa VO2 symptôme limitée (terme utilisé chez les patients qui ne peuvent atteindre les critères de VO2 max), soit au niveau du seuil d’apparition de sa dyspnée. L’hypothèse est que cet entraînement, dont il a été montré qu’il était efficace, puisse se poursuivre plus facilement dans le temps, à la sortie du patient de son programme formel de réentraînement.
 ) et Vallet et coll. (1997
) et Vallet et coll. (1997 ), est d’ordre comportemental. Le sujet est entraîné soit au niveau de son seuil ventilatoire (entraînement individualisé) c’est-àdire à environ 55-60 % de sa VO2 symptôme limitée (terme utilisé chez les patients qui ne peuvent atteindre les critères de VO2 max), soit au niveau du seuil d’apparition de sa dyspnée. L’hypothèse est que cet entraînement, dont il a été montré qu’il était efficace, puisse se poursuivre plus facilement dans le temps, à la sortie du patient de son programme formel de réentraînement.
), est d’ordre comportemental. Le sujet est entraîné soit au niveau de son seuil ventilatoire (entraînement individualisé) c’est-àdire à environ 55-60 % de sa VO2 symptôme limitée (terme utilisé chez les patients qui ne peuvent atteindre les critères de VO2 max), soit au niveau du seuil d’apparition de sa dyspnée. L’hypothèse est que cet entraînement, dont il a été montré qu’il était efficace, puisse se poursuivre plus facilement dans le temps, à la sortie du patient de son programme formel de réentraînement.En fait, l’étude la plus convaincante à ce sujet vient d’un groupe québécois (Maltais et coll., 1997 ) qui a demandé aux patients d’augmenter de paliers d’intensité chaque fois que le palier précédent était bien supporté en termes de dyspnée et de fréquence cardiaque. L’objectif était d’atteindre une intensité de 80 % de la VO2 symptôme limitée mais avec la possibilité de plafonner à un niveau de confort. Parmi les patients, 10 % ont atteint et sont restés à 80 %, la moyenne atteinte par les autres était de 60 % c’est-à-dire celle du seuil ventilatoire ou du seuil de dyspnée, préconisé par les Européens et repris dans les recommandations.
) qui a demandé aux patients d’augmenter de paliers d’intensité chaque fois que le palier précédent était bien supporté en termes de dyspnée et de fréquence cardiaque. L’objectif était d’atteindre une intensité de 80 % de la VO2 symptôme limitée mais avec la possibilité de plafonner à un niveau de confort. Parmi les patients, 10 % ont atteint et sont restés à 80 %, la moyenne atteinte par les autres était de 60 % c’est-à-dire celle du seuil ventilatoire ou du seuil de dyspnée, préconisé par les Européens et repris dans les recommandations.
 ) qui a demandé aux patients d’augmenter de paliers d’intensité chaque fois que le palier précédent était bien supporté en termes de dyspnée et de fréquence cardiaque. L’objectif était d’atteindre une intensité de 80 % de la VO2 symptôme limitée mais avec la possibilité de plafonner à un niveau de confort. Parmi les patients, 10 % ont atteint et sont restés à 80 %, la moyenne atteinte par les autres était de 60 % c’est-à-dire celle du seuil ventilatoire ou du seuil de dyspnée, préconisé par les Européens et repris dans les recommandations.
) qui a demandé aux patients d’augmenter de paliers d’intensité chaque fois que le palier précédent était bien supporté en termes de dyspnée et de fréquence cardiaque. L’objectif était d’atteindre une intensité de 80 % de la VO2 symptôme limitée mais avec la possibilité de plafonner à un niveau de confort. Parmi les patients, 10 % ont atteint et sont restés à 80 %, la moyenne atteinte par les autres était de 60 % c’est-à-dire celle du seuil ventilatoire ou du seuil de dyspnée, préconisé par les Européens et repris dans les recommandations.Résultats du réentraînement à l’exercice chez le sujet atteint de BPCO
La première méta-analyse concernant les résultats du réentraînement à l’effort, c’est-à-dire cette reprise formalisée de l’activité physique, date de 1996. Tous les travaux de ce type ou en termes d’evidence-based medicine réalisés depuis ont confirmé ces résultats (Lacasse et coll., 1996 ; Ries et coll., 1997
; Ries et coll., 1997 ; Lacasse et coll., 2001
; Lacasse et coll., 2001 ; Nici et coll., 2006
; Nici et coll., 2006 ).
).
 ; Ries et coll., 1997
; Ries et coll., 1997 ; Lacasse et coll., 2001
; Lacasse et coll., 2001 ; Nici et coll., 2006
; Nici et coll., 2006 ).
).Les différents objectifs physiopathologiques sont atteints et pour chacun d’entre eux le niveau de preuve est A.
C’est ainsi que la dyspnée est systématiquement améliorée et que cette amélioration est cliniquement pertinente.
Concernant la tolérance à l’effort, elle est améliorée en termes de résultats aux tests d’endurance, de marche de 6 minutes, et en terme de consommation maximale d’oxygène symptôme limitée, la première méthodologie étant de loin la plus sensible.
Finalement, la qualité de vie est elle-même profondément améliorée et dans un remarquable travail de Griffiths et coll. (2000 ) tous les items des deux questionnaires spécifiques de qualité de vie utilisés chez le patient atteint de BPCO sont cliniquement améliorés.
) tous les items des deux questionnaires spécifiques de qualité de vie utilisés chez le patient atteint de BPCO sont cliniquement améliorés.
 ) tous les items des deux questionnaires spécifiques de qualité de vie utilisés chez le patient atteint de BPCO sont cliniquement améliorés.
) tous les items des deux questionnaires spécifiques de qualité de vie utilisés chez le patient atteint de BPCO sont cliniquement améliorés.En dehors des objectifs physiopathologiques, la reprise formalisée de l’activité physique a entraîné une diminution franche du nombre d’hospitalisations. En moyenne, sur l’ensemble des études, le nombre de jours d’hospitalisation dans l’année voire les années qui suivent est divisé par deux, ce qui diminue le coût de santé de cette affection (Griffiths et coll., 2001 ; Hui et Hewitt, 2003
; Hui et Hewitt, 2003 ; Bourbeau et coll., 2006
; Bourbeau et coll., 2006 ).
).
 ; Hui et Hewitt, 2003
; Hui et Hewitt, 2003 ; Bourbeau et coll., 2006
; Bourbeau et coll., 2006 ).
).Les effets secondaires, les risques encourus après le réentraînement à l’effort sont quasiment nuls. Au-delà des douleurs musculaires et articulaires, inhérentes à la reprise d’une activité physique, aucun décès y compris de cause cardiaque n’a été publié dans la littérature concernant la BPCO (ou les autres maladies respiratoires).
Le réentraînement à l’exercice est considéré comme une thérapeutique très efficace et sans effet secondaire (Nici et coll., 2006 ).
).
 ).
).Limites du réentraînement à l’exercice
Nous insisterons sur deux points : le suivi des patients et l’évolution des connaissances.
Les résultats du réentraînement à l’exercice chez les patients atteints de BPCO sont tellement cliniquement évidents que les patients quittent le centre de réentraînement, qu’il soit institutionnel ou ambulatoire, avec beaucoup de confiance, persuadés qu’ils vont pouvoir poursuivre chez eux sans difficultés. Le problème est en fait la première exacerbation de la mala-die qui finira par arriver et qui signera souvent le glas des espoirs du malade. L’un des objectifs essentiels de tout réentraînement à l’exercice quelle que soit la pathologie chronique concernée est le maintien des acquis. On peut discerner deux phases dans celui-ci.
La première phase se déroule dans le centre dit « de rééducation ». La rééducation est simplement l’association de toutes les techniques médicales qui tournent autour du réentraînement à l’exercice (kinésithérapie, activités physiques adaptées, nutrition…) et de la prise en charge psychosociale, dont la pierre angulaire est l’éducation thérapeutique. Cette éducation thérapeutique est primordiale : le patient comprend sa thérapeutique et essaie progressivement de changer ses comportements, le premier d’entre eux étant l’arrêt de l’intoxication tabagique (Nici et coll., 2006 ). Il ne devrait pas y avoir de réentraînement à l’exercice s’il n’est pas associé à l’éducation thérapeutique adaptée à la pathologie.
). Il ne devrait pas y avoir de réentraînement à l’exercice s’il n’est pas associé à l’éducation thérapeutique adaptée à la pathologie.
 ). Il ne devrait pas y avoir de réentraînement à l’exercice s’il n’est pas associé à l’éducation thérapeutique adaptée à la pathologie.
). Il ne devrait pas y avoir de réentraînement à l’exercice s’il n’est pas associé à l’éducation thérapeutique adaptée à la pathologie.La deuxième phase est le suivi après le retour au domicile des patients. La meilleure méthode semble celle des associations de patients, locales réunies en réseau par exemple régional avec un comité de pilotage médical de référence. Ce dernier est discret, n’intervenant qu’en cas de besoin, le maître mot étant l’autonomisation des patients. Dans un travail récent, il a été montré que ce type d’associations qui fournit des prestations régulières aux patients (y compris sociales) entraîne une amélioration supplémentaire à 1 an (par rapport à un groupe témoin) ainsi qu’une réduction des journées d’hospitalisation (Moullec et coll., 2007 ).
).
 ).
).La deuxième limite du réentraînement à l’exercice est d’ordre conceptuel. Le principe du réentraînement à l’effort est d’inverser le cercle vicieux du déconditionnement. Chez le sujet normal désentraîné, l’exercice induit une augmentation du nombre de fibres aérobies de type I (Hortobagyi et coll., 2000 ). Dans le cas de la BPCO, les trois études qui à ce jour se sont intéressées à la typologie du quadriceps après réentraînement à l’effort n’ont montré aucune modification du nombre de fibres de type I. Les améliorations obtenues concernent l’augmentation du diamètre des fibres musculaires, des enzymes de la voie oxydative et de la capillarisation (Whittom et coll., 1998
). Dans le cas de la BPCO, les trois études qui à ce jour se sont intéressées à la typologie du quadriceps après réentraînement à l’effort n’ont montré aucune modification du nombre de fibres de type I. Les améliorations obtenues concernent l’augmentation du diamètre des fibres musculaires, des enzymes de la voie oxydative et de la capillarisation (Whittom et coll., 1998 ; Koechlin et coll., 2004b
; Koechlin et coll., 2004b ; Guerrero et coll., 2005
; Guerrero et coll., 2005 ; Vogiatzis et coll., 2005
; Vogiatzis et coll., 2005 ). Toutefois, au-delà du déconditionnement, il y a probablement une atteinte intrinsèque du muscle du sujet atteint de BPCO. Il a pu être montré qu’il était effectivement le siège du stress oxydant (Couillard et coll., 2003
). Toutefois, au-delà du déconditionnement, il y a probablement une atteinte intrinsèque du muscle du sujet atteint de BPCO. Il a pu être montré qu’il était effectivement le siège du stress oxydant (Couillard et coll., 2003 ) et que la diminution de ce stress améliorait la fonction musculaire (Koechlin et coll., 2004b
) et que la diminution de ce stress améliorait la fonction musculaire (Koechlin et coll., 2004b ). Ceci nous a amené à émettre l’hypothèse qu’au-delà du déconditionnement les muscles des sujets atteints de BPCO étaient l’objet d’une myopathie probablement en relation avec le couple inflammation-stress oxydant (Couillard et Préfaut, 2005
). Ceci nous a amené à émettre l’hypothèse qu’au-delà du déconditionnement les muscles des sujets atteints de BPCO étaient l’objet d’une myopathie probablement en relation avec le couple inflammation-stress oxydant (Couillard et Préfaut, 2005 ). Ces notions sont importantes car facteur d’évolution des thérapeutiques associées au réentraînement à l’exercice.
). Ces notions sont importantes car facteur d’évolution des thérapeutiques associées au réentraînement à l’exercice.
 ). Dans le cas de la BPCO, les trois études qui à ce jour se sont intéressées à la typologie du quadriceps après réentraînement à l’effort n’ont montré aucune modification du nombre de fibres de type I. Les améliorations obtenues concernent l’augmentation du diamètre des fibres musculaires, des enzymes de la voie oxydative et de la capillarisation (Whittom et coll., 1998
). Dans le cas de la BPCO, les trois études qui à ce jour se sont intéressées à la typologie du quadriceps après réentraînement à l’effort n’ont montré aucune modification du nombre de fibres de type I. Les améliorations obtenues concernent l’augmentation du diamètre des fibres musculaires, des enzymes de la voie oxydative et de la capillarisation (Whittom et coll., 1998 ; Koechlin et coll., 2004b
; Koechlin et coll., 2004b ; Guerrero et coll., 2005
; Guerrero et coll., 2005 ; Vogiatzis et coll., 2005
; Vogiatzis et coll., 2005 ). Toutefois, au-delà du déconditionnement, il y a probablement une atteinte intrinsèque du muscle du sujet atteint de BPCO. Il a pu être montré qu’il était effectivement le siège du stress oxydant (Couillard et coll., 2003
). Toutefois, au-delà du déconditionnement, il y a probablement une atteinte intrinsèque du muscle du sujet atteint de BPCO. Il a pu être montré qu’il était effectivement le siège du stress oxydant (Couillard et coll., 2003 ) et que la diminution de ce stress améliorait la fonction musculaire (Koechlin et coll., 2004b
) et que la diminution de ce stress améliorait la fonction musculaire (Koechlin et coll., 2004b ). Ceci nous a amené à émettre l’hypothèse qu’au-delà du déconditionnement les muscles des sujets atteints de BPCO étaient l’objet d’une myopathie probablement en relation avec le couple inflammation-stress oxydant (Couillard et Préfaut, 2005
). Ceci nous a amené à émettre l’hypothèse qu’au-delà du déconditionnement les muscles des sujets atteints de BPCO étaient l’objet d’une myopathie probablement en relation avec le couple inflammation-stress oxydant (Couillard et Préfaut, 2005 ). Ces notions sont importantes car facteur d’évolution des thérapeutiques associées au réentraînement à l’exercice.
). Ces notions sont importantes car facteur d’évolution des thérapeutiques associées au réentraînement à l’exercice.Maladie asthmatique et autres maladies respiratoires
Historiquement, le sport était contre-indiqué chez l’enfant asthmatique pour éviter la crise d’asthme induite par l’exercice, avec pour conséquences quelques générations d’enfants asthmatiques chétifs, surprotégés et déconditionnés. Dans les années 1990, il était donc normal de prescrire l’activité physique à ces enfants en sachant que cette dernière repoussait vers des puissances de travail supérieures le seuil d’apparition de l’asthme induit par l’exercice (Varray et coll., 1991 ; Counil et coll., 2003
; Counil et coll., 2003 ). Parallèlement, il a fallu informer le monde médical et celui de l’éducation physique qu’au-delà même des activités dites non asthmogènes, il était indispensable de faire pratiquer des activités physiques aux enfants asthmatiques et avec plus de sollicitations que chez les autres enfants. Une revue récente de la Cochrane Library confirme d’ailleurs l’efficacité du réentraînement chez les enfants asthmatiques sans effet secondaire (Ram et coll., 2005
). Parallèlement, il a fallu informer le monde médical et celui de l’éducation physique qu’au-delà même des activités dites non asthmogènes, il était indispensable de faire pratiquer des activités physiques aux enfants asthmatiques et avec plus de sollicitations que chez les autres enfants. Une revue récente de la Cochrane Library confirme d’ailleurs l’efficacité du réentraînement chez les enfants asthmatiques sans effet secondaire (Ram et coll., 2005 ).
).
 ; Counil et coll., 2003
; Counil et coll., 2003 ). Parallèlement, il a fallu informer le monde médical et celui de l’éducation physique qu’au-delà même des activités dites non asthmogènes, il était indispensable de faire pratiquer des activités physiques aux enfants asthmatiques et avec plus de sollicitations que chez les autres enfants. Une revue récente de la Cochrane Library confirme d’ailleurs l’efficacité du réentraînement chez les enfants asthmatiques sans effet secondaire (Ram et coll., 2005
). Parallèlement, il a fallu informer le monde médical et celui de l’éducation physique qu’au-delà même des activités dites non asthmogènes, il était indispensable de faire pratiquer des activités physiques aux enfants asthmatiques et avec plus de sollicitations que chez les autres enfants. Une revue récente de la Cochrane Library confirme d’ailleurs l’efficacité du réentraînement chez les enfants asthmatiques sans effet secondaire (Ram et coll., 2005 ).
).Le vrai problème n’est pas de réentraîner les enfants asthmatiques à l’exception de ceux présentant un asthme difficile soit moins de 10 % de la population. Il est de leur faire pratiquer régulièrement un sport d’intensité modérée. Les recommandations vont jusqu’à préciser qu’un sport d’équipe est souhaitable (Basaran et coll., 2006 ).
).
 ).
).Concernant les autres affections respiratoires comme la dilatation des bronches, la mucoviscidose, les pneumopathies interstitielles diffuses, les ablations chirurgicales pulmonaires, les travaux sont trop peu nombreux pour réaliser des méta-analyses (Boas, 1997 ; Gulmans et coll., 1999
; Gulmans et coll., 1999 ; Newall et coll, 2005
; Newall et coll, 2005 ). Quoiqu’il en soit, les résultats semblent superposables à ceux obtenus dans la BPCO et les recommandations (niveau C) sont de réhabiliter toutes les affections respiratoires chroniques (Nici et coll., 2006
). Quoiqu’il en soit, les résultats semblent superposables à ceux obtenus dans la BPCO et les recommandations (niveau C) sont de réhabiliter toutes les affections respiratoires chroniques (Nici et coll., 2006 ).
).
 ; Gulmans et coll., 1999
; Gulmans et coll., 1999 ; Newall et coll, 2005
; Newall et coll, 2005 ). Quoiqu’il en soit, les résultats semblent superposables à ceux obtenus dans la BPCO et les recommandations (niveau C) sont de réhabiliter toutes les affections respiratoires chroniques (Nici et coll., 2006
). Quoiqu’il en soit, les résultats semblent superposables à ceux obtenus dans la BPCO et les recommandations (niveau C) sont de réhabiliter toutes les affections respiratoires chroniques (Nici et coll., 2006 ).
).Sport de haut niveau et risques pulmonaires
Deux « complications » du sport méritent d’être mentionnées. Il s’agit de l’hypoxémie induite par l’exercice chez les athlètes de haut niveau et de l’asthme du sportif.
Deux athlètes jeunes de type endurant (courses de fond, cyclisme, natation…) sur trois, dont la VO2 max est supérieure à 60 ml/min/kg, présentent une hypoxémie induite par l’exercice c’est-à-dire une chute de la pression partielle de l’oxygène dans leur sang artériel (PaO2) d’au moins 10 mmHg, en moyenne de 20 mmHg et pouvant aller jusqu’à 30 mmHg (Préfaut et coll., 2000 ). Tous les sportifs vétérans du même type (ski de fond, cyclotourisme…) présentent cette même hypoxie (Préfaut et coll., 2000
). Tous les sportifs vétérans du même type (ski de fond, cyclotourisme…) présentent cette même hypoxie (Préfaut et coll., 2000 ). Le facteur essentiel responsable de l’hypoxémie est la quantité d’activité physique réalisée mais si elle est considérable pour les athlètes jeunes, il suffit de 1 000 km de cyclotourisme par an pour qu’elle apparaisse chez un vétéran. L’hypothèse qui prévaut actuellement pour expliquer la diminution de pression d’O2 dans le sang est celle de l’apparition d’un « stress failure » c’est-à-dire des vaisseaux pulmonaires devenant perméables puis pouvant être localement détruits qui laissent passer du liquide induisant par la même un sub-œdème pulmonaire (Dempsey et Wagner, 1999
). Le facteur essentiel responsable de l’hypoxémie est la quantité d’activité physique réalisée mais si elle est considérable pour les athlètes jeunes, il suffit de 1 000 km de cyclotourisme par an pour qu’elle apparaisse chez un vétéran. L’hypothèse qui prévaut actuellement pour expliquer la diminution de pression d’O2 dans le sang est celle de l’apparition d’un « stress failure » c’est-à-dire des vaisseaux pulmonaires devenant perméables puis pouvant être localement détruits qui laissent passer du liquide induisant par la même un sub-œdème pulmonaire (Dempsey et Wagner, 1999 ; Préfaut et coll., 2000
; Préfaut et coll., 2000 ). Les athlètes ne prennent pas conscience de cette hypoxémie induite par l’exercice qui n’entraîne aucun effet cliniquement décelable, sauf à diminuer la performance en compétition, et dont on ne connaît aucune conséquence à long terme.
). Les athlètes ne prennent pas conscience de cette hypoxémie induite par l’exercice qui n’entraîne aucun effet cliniquement décelable, sauf à diminuer la performance en compétition, et dont on ne connaît aucune conséquence à long terme.
 ). Tous les sportifs vétérans du même type (ski de fond, cyclotourisme…) présentent cette même hypoxie (Préfaut et coll., 2000
). Tous les sportifs vétérans du même type (ski de fond, cyclotourisme…) présentent cette même hypoxie (Préfaut et coll., 2000 ). Le facteur essentiel responsable de l’hypoxémie est la quantité d’activité physique réalisée mais si elle est considérable pour les athlètes jeunes, il suffit de 1 000 km de cyclotourisme par an pour qu’elle apparaisse chez un vétéran. L’hypothèse qui prévaut actuellement pour expliquer la diminution de pression d’O2 dans le sang est celle de l’apparition d’un « stress failure » c’est-à-dire des vaisseaux pulmonaires devenant perméables puis pouvant être localement détruits qui laissent passer du liquide induisant par la même un sub-œdème pulmonaire (Dempsey et Wagner, 1999
). Le facteur essentiel responsable de l’hypoxémie est la quantité d’activité physique réalisée mais si elle est considérable pour les athlètes jeunes, il suffit de 1 000 km de cyclotourisme par an pour qu’elle apparaisse chez un vétéran. L’hypothèse qui prévaut actuellement pour expliquer la diminution de pression d’O2 dans le sang est celle de l’apparition d’un « stress failure » c’est-à-dire des vaisseaux pulmonaires devenant perméables puis pouvant être localement détruits qui laissent passer du liquide induisant par la même un sub-œdème pulmonaire (Dempsey et Wagner, 1999 ; Préfaut et coll., 2000
; Préfaut et coll., 2000 ). Les athlètes ne prennent pas conscience de cette hypoxémie induite par l’exercice qui n’entraîne aucun effet cliniquement décelable, sauf à diminuer la performance en compétition, et dont on ne connaît aucune conséquence à long terme.
). Les athlètes ne prennent pas conscience de cette hypoxémie induite par l’exercice qui n’entraîne aucun effet cliniquement décelable, sauf à diminuer la performance en compétition, et dont on ne connaît aucune conséquence à long terme.L’asthme du sportif est une conséquence beaucoup plus invalidante du sport de haut niveau. C’est une nouvelle forme clinique de l’asthme bronchique observée chez des athlètes de type endurant ayant pratiqué plusieurs années à haut niveau (âge moyen 23-25 ans) sans aucun antécédent de terrain allergique ou de maladie asthmatique. Cet asthme serait la conséquence d’une abrasion de la muqueuse bronchique consécutive à des heures d’hyperventilation pendant les séances d’entraînement et ce durant de nombreuses années. Cette muqueuse abrasée, donc inflammatoire, répond anormalement aux différents stimuli, comme celle d’un asthmatique. Cet asthme est difficile à gérer, induit des contre-performances, mais régresse avec l’arrêt de l’entraînement (Kippelen et coll., 2003 ; Randolph, 2006
; Randolph, 2006 ). Il est donc a priori sans conséquences à long terme, mais nous n’avons pas encore assez de recul pour en juger.
). Il est donc a priori sans conséquences à long terme, mais nous n’avons pas encore assez de recul pour en juger.
 ; Randolph, 2006
; Randolph, 2006 ). Il est donc a priori sans conséquences à long terme, mais nous n’avons pas encore assez de recul pour en juger.
). Il est donc a priori sans conséquences à long terme, mais nous n’avons pas encore assez de recul pour en juger.
En conclusion, la première thérapeutique des maladies respiratoires en général et de la broncho-pneumopathie chronique obstructive en particulier est l’arrêt total du tabac.
Toutefois, chez les fumeurs invétérés, une quantité d’activité physique aussi faible que 2 heures par semaine, à un niveau d’intensité modérée (marche rapide), limite voire prévient l’apparition d’une broncho-pneumopathie chronique obstructive, réduit le nombre d’exacerbations et donc de jours d’hospitalisation.
L’élément le plus extraordinaire est que l’activité physique, sous le terme de réentraînement à l’effort, est une thérapeutique de niveau A (evidence-based medicine) pour diminuer la dyspnée dans les activités de la vie quotidienne, pour améliorer la tolérance à l’effort et la qualité de vie, pour réduire le nombre d’exacerbations et de journées d’hospitalisation chez les sujets atteints de BPCO. Ce réentraînement à l’exercice ne peut s’appliquer que dans un programme général de rééducation personnalisé et doit donc être associé à un programme d’éducation pour la santé. Enfin, tout malade impliqué dans un programme de rééducation doit pouvoir bénéficier d’un suivi afin de maintenir ses acquis.
L’activité physique qui peut être si positive dans la prévention et le traitement des maladies respiratoires à « posologie » raisonnable et individualisée, peut être délétère lorsqu’elle est pratiquée de manière excessive comme chez les athlètes de haut niveau. En effet, chez ces derniers, elle peut entraîner des hypoxémies, mais également induire une forme particulière et difficile à gérer d’asthme, dit asthme du sportif.
Bibliographie
[1] allaire j, maltais f, doyon jf, noel m, leblanc p, et coll.. Peripheral muscle endurance and the oxidative profile of the quadriceps in patients with COPD.
Thorax. 2004;
59:673- 678

[2] basaran s, guler-uysal f, ergen n, seydaoglu g, bingol-karakoç g, altintas du. Effects of physical exercise on quality of life, exercise capacity and pulmonary function in children with asthma.
J Rehabil Med. 2006;
38:130- 135

[3] bernard s, leblanc p, whittom f, carrier g, jobin j, et coll.. Peripheral muscle weakness in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 1998;
158:629- 634

[4] bourbeau j, collet jp, schwartzman k, ducruet t, nault d, bradley c. Economic benefits of self-management education in COPD.
Chest. 2006;
130:170- 1711

[5] boas sr. Exercise recommendations for individuals with cystic fibrosis.
Sports Med. 1997;
1:17- 37

[6] casaburi r, porszasz j, burns m, carithers er, chanez rsy, cooper cb. Physiologic benefits of exercise training in rehabilitation of patients with severe chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 1997;
155:1541- 1551

[7] celli br, macnee w. Standards for the diagnosis and treatment of patients with 442 COPD; a summary of the ATS/ERS position paper.
ERJ. 2004;
23:932- 946

[8] clark cj, cochrane l, mackay e. Low intensity peripheral muscle conditioning improves exercise tolerance and breathlessness in COPD.
Eur Respir J. 1996;
9:2590- 2596

[9] coronell c, orozco-levi m, ramirez-sarmiento a, galdiz jb, gea j. Relevance of assessing quadriceps endurance in patients with COPD.
Eur Respir J. 2004;
24:129- 136

[10] couillard a, préfaut c. From muscle disuse to myopathy in COPD : potential contribution of oxidative stress.
Eur Respir J. 2005;
26:703- 719

[11] couillard a, maltais f, saey d, debigare r, michaud a, et coll.. Exercise-induced quadriceps oxidative stress and peripheral muscle dysunction in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 2003;
167:1664- 1669

[12] counil fp, varray a, matecki s, beureu a, marchal p, et coll.. Training of aerobic and anaerobic fitness in children with asthma.
J Pediatr. 2003;
142:179- 184

[13] debigare r, cote ch, hould fs, leblanc p, maltais f. In vitro and in vivo contractile properties of the vastus lateralis muscle in males with COPD.
Eur Respir J. 2003;
21:273- 278

[15] garcia-aymerich j, lange p, benet m, schnohr p, anto jm. Regular physical activity reduces hospital admission and mortality in chronic obstructive pulmonary disease: a population based cohort study.
Thorax. 2006;
61:772- 778

[16] garcia-aymerich j, lange p, benet m, schnorh p, anto jm. Regular physical activity modifies smoking-related lung function decline and reduces risk of chronic obstructive pulmonary disease. A population-based cohort study.
Am J Respir Crit Care Med. 2007;
175:458- 463

[17] gosker hr, wouters ef, van der vusse gj, schols am. Skeletal muscle dysfunction in chronic obstructive pulmonary disease and chronic heart failure: underlying mechanicsms and therapy perspective.
Am J Clin Nutr. 2000;
71:1033- 1047

[18] griffiths tl, burr ml, campbell ia, lewis-jenkins v, mullins j, et coll.. Results at 1 year of outpatient multidisciplinary pulmonary rehabilitation : a randomised controlled trial.
Lancet. 2000;
355:362- 368

[19] griffiths tl, philips cj, davies s, burr ml, campbell ja. Cost effectiveness of an outpatient mutidisciplinary puomonary rehabilitation programme.
Thorax. 2001;
56:779- 784

[20] guerrero k, wuyam b, mezin p, vivodtzev i, vendelin m, et coll.. Functional coupling of adenine nucleotide translocase and mitochondrial creatine kinase is enhanced after exercise training in lung transplant skeletal muscle.
Am J Physiol Regul Interf Comp Physiol. 2005;
289:1144- 1154

[21] gulmans vam, de meer k, brackel hjl, faber jaj, berger r, helders pjm. Outpatient exercise training in children with cystic fibrosis; physiological effects, perceived competence and acceptability.
Pediatr Pulmonol. 1999;
28:39- 46

[22] hortobagyi t, dempsey l, fraser d, zheng d, hamilton g, et coll.. Changes in muscle strength, muscle fibre size and myofibrillar gene expression after immobilization and retraining in humans.
J Physiol. 2000;
524:293- 304

[23] hui kp, hewitt ab. A simple pulmonary rehabilitation program improves health outcomes and reduces hospital utilization in patients with COPD.
Chest. 2003;
124:94- 97

[24] jones nl, jones g, edwards rht. Exercise tolerance in chronic airway obstruction.
Am Rev Respir Dis. 1971;
103:477- 491

[26] koechlin c, couillard a, cristol jp, chanez p, hayot m, et coll.. Does systemic inflammation trigger local exercise-induced oxidative stress in COPD ?.
Eur Respir J. 2004a;
23:538- 544

[27] koechlin c, couillard a, simar d, cristol jp, bellet h, et coll.. Does oxidative stress alter quadriceps endurance in chronic obstructive pulmonary disease ?.
Am J Respir Crit Care Med. 2004b;
169:1022- 1027

[28] lacasse y, wong e, guyatt gh, cook dj, godstein rs. Meta-analysis of respiratory rehabilitation in chronic obstructive pulmonary disease.
Lancet. 1996;
348:1115- 1119

[29] lacasse y, brosseau l, milne s, martin s, wong e, et coll.. Pulmonary rehabilitation for chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2001;
3:CD003793

[30] macintyre nr. Chronic obstructive pulmonary disease management : the evidence base.
Respir Care. 2001;
46:1294- 1303

[31] maltais f, leblanc p, simard c, jobin j, berube c, et coll.. Skeletal muscle adaptation to endurance training in patients with chronique obstructive pulmonary disease.
Am J Respir Crit Care Med. 1996;
154:442- 447

[32] maltais f, leblanc p, jobin j, bérubé c, bruneau j, et coll.. Intensity of training and physiologic adaptation in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 1997;
155:555- 561

[33] marquis k, debigare r, lacasse y, leblanc p, jobin j, et coll.. Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 2002;
166:809- 813

[34] moullec g, ninot g, varray a, desplan j, hayot m, préfaut c. Innovative maintenance program based on self-help associations in a healthcare network.
2007 submitted. ;


[35] murray cj, lopez ad. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study.
Lancet. 1997a;
17:1436- 1442

[36] murray cj, lopez ad. Alternative projections of mortality and disability by cause 444 1990-2020: Global Burden of Disease Study.
Lancet. 1997b;
24:1498- 1504

[37]national heart, lung, and blood institute and world health organization. Global Initiative for Asthma.
National Institutes of Health pub n°95-3659. Bethesda, MD:1995;


[38] newall c, stockey ra, hill sl. Exercise training and inspiratory muscle training in patients with bronchiectasis.
Thorax. 2005;
60:943- 948

[39] nici l, donner c, wouters e, zuwallack r, ambrosino n, et coll.. American Thoracic Society/European Respiratory Society statement on pulmonary rehabilitation.
Am J Respir Crit Care Med. 2006;
173:1390- 1413

[40] préfaut ch, varray a, vallet g. Pathophysiological basis of exercise training in patients with chronic obstructive lung disease.
Eur Respir Rev. 1995;
5:27- 32

[41] préfaut c, durand f, mucci p, caillaud c. Exercise-induced arterial hypoxaemia in athletes : a review.
Sports Med. 2000;
30:47- 61

[42] ram fsf, robinson sm, black pn, picot j. Physical training for asthma.
The Cochrane Database of Systematic Reviews. 2005;
Issue 4. Art. N° : CD001116.pub2. DOI : 10.1002/14651858. CD001116.pub2. 

[43] randolph cc. Allergic rhinitis and asthma in the athlete.
Allergy Asthma Proc. 2006;
27:104- 109

[44] ries al, carlin bw, carrieri-kohl-man v, casaburi r, celli br, et coll.. Pulmonary rehabilitation. Joint ACCP/AACVPR. Evidence Based Medicine.
Chest. 1997;
112:1363- 1396

[45] sackett dl, rosenberg wm, gray ja, haynes rb, richardson ws, . Evidence based medicine: what it is and what it isn’t.
BMJ. 1996;
312:71- 72

[46] serres i, gautier v, varray a, préfaut c. Impaired skeletal muscle endurance related to physical inactivity and altered lung function in COPD patients.
Chest. 1998a;
113:900- 905

[47] serres i, hayot m, prefaut c, mercier j. Skeletal muscle abnormalities in patients with COPD : contribution to exercise intolerance.
Med Sci Sports Exerc. 1998b;
30:1019- 1027

[48] vallet g, ahmaidi s, serres i, fabre c, bourgouin d, et coll.. Comparison of two training programs in CAL patients standardized versus individualized method.
Europ Respir J. 1997;
10:114- 122

[49] varray al, mercier jg, terral cm, préfaut cg. Individualized aerobic and high intensity training for asthmatic children an exercise readaptation program. Is training always helpful for better adaptation to exercise?.
Chest. 1991;
99:579- 586

[50] vogiatzis i, terzis g, nanas s, stratakos g, simoes dc, et coll.. Skeletal muscle adaptations to interval training in patients with advanced COPD.
Chest. 2005;
128:3838- 3845

[51] whittom f, jobin j, simard pm, leblanc p, simard c, et coll.. Histochemical and morphological characteristics of the vastus lateralis muscle in patients with chronic obstructive pulmonary disease.
Med Sci Sports Exerc. 1998;
30:1467- 1474

→ Aller vers SYNTHESE