| |
| Med Sci (Paris). 34(1): 21–24. doi: 10.1051/medsci/20183401006.KCNQ1 : un nouveau régulateur de la transition épithélio-mésenchymateuse dans les cancers du côlon Raphael Rapetti-Mauss,1* Franck Borgese,1 Brian J. Harvey,2 and Olivier Soriani1** 1Université Côte d'Azur, CNRS, Inserm, Institut de biologie Valrose, 06108Nice Cedex 2, France 2Department of molecular medicine, Royal college of surgeons in Ireland (RCSI), Education and Research Centre, Beaumont hospital, Dublin 9, Irlande MeSH keywords: Animaux, Tumeurs colorectales, Cellules épithéliales, Transition épithélio-mésenchymateuse, Canal potassique KCNQ1, Souris, Protéines suppresseurs de tumeurs, Voie de signalisation Wnt, anatomopathologie, physiopathologie, physiologie |
Durant ces 20 dernières années, l’importance des canaux ioniques et notamment des canaux potassium [K+] a émergé dans la biologie des cancers. Il est maintenant admis que ces protéines transmembranaires, antérieurement impliquées dans des phénomènes d’excitabilité cellulaire et de transport d’électrolytes, participent aux mécanismes cancéreux. Bien que l’expression aberrante de certains canaux ioniques et leur implication dans des processus cellulaires, tels que la prolifération ou la migration, ait été décrite, encore trop peu d’études se sont intéressées aux voies de signalisation auxquelles ils sont associés dans les cancers. Cependant, la compréhension du rôle des canaux K+ dans les voies de signalisations qui gouvernent le comportement des cellules cancéreuses est un enjeu crucial pour découvrir de nouvelles voies thérapeutiques [1]. |
Rôle de KCNQ1 dans la sécrétion de chlore et d’eau dans la crypte de côlon Le canal K+ KCNQ11, joue un rôle essentiel dans la physiologie des transports épithéliaux. Les mécanismes de transport font intervenir des réseaux de transporteurs et de canaux, créant et dissipant les gradients ioniques nécessaires au passage d’eau, d’électrolytes, de nutriments ou d’autres substrats à travers les épithéliums. L’activité de la pompe Na+/K+ ATPase génère ainsi la principale force motrice pour ces transports trans-épithéliaux en assurant la sortie de Na+ en échange de l’entrée de K+ dans la cellule. Dans ce contexte, les canaux K+ assurent deux fonctions principales : le maintien du potentiel de membrane et le recyclage basolatéral du K+ garantissant ainsi le maintien des gradients électrochimiques. Dans le côlon, KCNQ1, associé à la sous-unité régulatrice KCNE32,, joue un rôle essentiel au niveau des cryptes de Leiberkühn3 en maintenant la force électromotrice nécessaire à la sécrétion apicale de Cl- et d’eau (Figure 1) [2]. 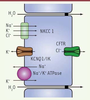 | Figure 1 Figure 1. Sécrétion de chlorure et d’eau dans la crypte de côlon. Le Cl-entre dans la cellule, par le co-transporteur basolatéral NKCC1, accompagné du K+ et du Na+. Le Cl-est alors sécrété par le cystic fibrosis transmembrane regulator (CFTR) au niveau de la membrane apicale. La force électromotrice pour cette sécrétion de Cl- est fournie par la pompe Na+/K+-ATPase qui permet, de manière active, la sortie de Na+ contre une entrée de K+ qui sera recyclé par les canaux KCNQ1 et IK au niveau basolatéral. L’eau est alors sécrétée par la voie para-cellulaire en suivant le mouvement net des ions Cl-. |
|
Émergence de KCNQ1 comme suppresseur de tumeur dans les cancers colorectaux Une étude récente a révélé un lien inattendu entre KCNQ1 et les cancers colorectaux (CCR). En s’appuyant sur des modèles murins, les auteurs ont montré que la perte d’expression de KCNQ1 favorise le développement d’adénocarcinomes au niveau du côlon. La faible expression de KCNQ1 a été associée à un mauvais pronostic de survie chez des patients présentant des métastases hépatiques [3]. En concordance avec ces résultats, une autre étude a révélé que chez des patients atteints de cancer du côlon au stade II et III, une faible expression de KCNQ1 est associée à un faible pronostic de survie [4]. Ce canal apparaît donc comme un marqueur pronostic intéressant pour les stades précoces de la maladie ainsi que pour les prédictions des récidives. Ces études suggèrent également que KCNQ1 agit comme un suppresseur de tumeur dans les CCR. Comment expliquer cette nouvelle fonction anti-tumorale de KCNQ1 au regard de son rôle dans la physiologie du transport épithélial ? Des fonctions alternatives du canal pourraient-elles sous-tendre les corrélations observées entre l’expression du canal et le développement des CCR ? Un premier élément de réponse émerge de la comparaison de l’expression de KCNQ1 dans des lignées de CCR plus ou moins différenciées. La présence de KCNQ1 est en effet associée à la conservation du caractère épithélial [5]. Inversement, le canal disparaît dans les lignées les plus dédifférenciées. Ces données posent l’hypothèse d’un lien fonctionnel entre KCNQ1 et le niveau de différenciation des cellules cancéreuses. |
La transition épithélio-mésenchymateuse, un mécanisme au cœur des cancers épithéliaux Les cancers épithéliaux révèlent un phénomène de dédifférenciation des cellules qui évoluent d’un état épithélial, différencié, vers un état mésenchymateux non différencié. Le degré d’engagement de ce processus, appelé transition épithélio-mésenchymateuse (TEM), est généralement associé au degré d’agressivité de la tumeur. Les épithéliums sains se caractérisent par l’existence de jonctions adhérentes qui garantissent l’intégrité morphologique et fonctionnelle en assurant la cohésion entre les cellules. Ces jonctions adhérentes (JA) se signalent notamment par l’ancrage, à la membrane plasmique, de complexes β-caténine/ε-cadhérine qui sont des marqueurs des tissus épithéliaux [6](➔). (➔) Voir la Nouvelle de S. Dufour, m/s n° 5, mai 2005, page 459 Quatre-vingt-dix pour cent des cancers colorectaux (CCR) sont associés à des mutations à l’origine d’une activation chronique de la voie Wnt4/β-caténine [7] (➔). (➔) Voir la Nouvelle de C. Blanpain, m/s n° 1, janvier 2007, page 34 Celle-ci, très finement régulée dans le côlon sain, est en effet l’une des principales forces motrices de la tumorigenèse colorectale. Cette voie de signalisation agit notamment en déplaçant l’équilibre entre les formes membranaires et cytosoliques de la β-caténine en faveur de la forme cytosolique, ce qui stimule l’activation des gènes cibles de Wnt tout en réduisant la stabilité des complexes β-caténine/ε-cadhérine à la membrane plasmique. Ces mécanismes participent ainsi à l’engagement du processus de TEM à la faveur de la disparition des JA [8]. La corrélation observée entre le niveau d’expression de KCNQ1 et le stade de différenciation des lignées de cellules de CCR pose ainsi la question du rôle potentiel du canal dans le maintien des JA et l’engagement de la TEM. |
KCNQ1 participe au maintien des jonctions adhérentes et intervient dans le contrôle de la voie Wnt L’exploration des cryptes intestinales, par des techniques couplant l’immunocytochimie et l’immunoprécipitation in situ (proximity ligation assay), apporte des données nouvelles : KCNQ1 est directement associé au complexe β-caténine/E-cadhérine dans les JA. Au niveau fonctionnel, l’extinction de l’expression de KCNQ1 dans des lignées cellulaires de côlon produit une disparition du complexe, ainsi qu’une dégradation de l’intégrité de l’architecture épithéliale par la rupture des JA. Ceci se traduit ensuite par une baisse de la résistance électrique épithéliale et une perte de la capacité des cellules à former des sphères polarisées in vitro. Ces résultats dévoilent un rôle nouveau pour KCNQ1 : parallèlement à sa fonction de régulateur des transports transépithéliaux, ce canal joue un rôle prédominant dans le maintien de l’intégrité architecturale du tissu. Les résultats que nous avons obtenus révèlent également que l’inhibition pharmacologique ou moléculaire de KCNQ1, en augmentant le niveau cytosolique de la β-caténine, entraîne une potentialisation de la voie Wnt qui se traduit par l’activation de gènes cibles impliqués dans la TEM. L’influence de KCNQ1 est prépondérante dans ce contrôle puisque l’extinction du canal dans des lignées CCR encore très différenciées (c’est-à-dire possédant les caractéristiques d’une cellule épithéliale) déclenche la TEM. Parallèlement, la réexpression de KCNQ1 dans des lignées CCR de type « mésenchymateux » restaure complètement le phéno-type épithélial, comme la présence des JA et la capacité à former des sphères polarisées in vitro. Ces résultats permettent d’éclairer sous un jour nouveau la corrélation entre le taux d’expression de KCNQ1 et le devenir clinique des patients atteints de CCR. En effet, des niveaux élevés d’expression du canal garantissent, avec le maintien des JA, la séquestration de la β-caténine à la membrane, la répression de la voie Wnt/ β-caténine, et finalement une réduction de l’engagement du processus de TEM. La stabilisation du complexe β-caténine/ E-cadhérine/KCNQ1 dans les JA permet de comprendre le rôle du canal en tant que « suppresseur de tumeur ». Ce dernier jouerait-il seulement un rôle de protéine d’ancrage pour le complexe β-caténine/E-cadhérine, ou bien le flux hyperpolarisant de K+ induit par KCNQ1 est-il important dans la stabilisation du complexe ? La réponse est apportée par des expériences dans lesquelles on provoque, dans des cellules CCR exprimant KCNQ1, des dépolarisations expérimentales (des chocs extracellulaires de KCl par exemple). Ce protocole, qui mime la dépolarisation membranaire qui ferait suite à la disparition ou à l’inhibition du canal, provoque l’accumulation cytosolique de la β-caténine, suggérant la potentialisation de la voie Wnt/β-caténine. Ces résultats démontrent l’existence d’un lien entre la signature électrique de la cellule cancéreuse et les voies de signalisation qui contrôlent la différenciation (Figure 2). Ces données sont cohérentes avec celles d’une étude récente qui montrent que la voie de signalisation K-Ras/RAF/MAPK est directement contrôlée par le potentiel de membrane [9]. 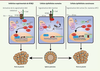 | Figure 2 Figure 2. Modèle du mécanisme d’interaction bidirectionnelle entre la voie Wnt/fi-caténine et KCNQ1. Dans la cellule épithéliale normale, le canal KCNQ1 est associé au complexe E-cadhérine/β-caténine au niveau des jonctions adhérentes. Le canal contribue alors au maintien de la β-caténine à la membrane et à l’intégrité de l’épithélium (au centre). Lorsque la fonction de KCNQ1 est inhibée, l’équilibre entre la β-caténine membranaire et la β-caténine cytosolique est déplacé, et la β-caténine s’accumule dans le cytoplasme permettant l’activation de la voie Wnt. La présence de KCNQ1 à la membrane exerce donc un contrôle négatif sur l’activité de la voie Wnt (à gauche). Dans le cas d’une activation de la voie Wnt due, par exemple, à une mutation sur la protéine APC (adenomatous polyposis coli), la répression de KCNQ1 participe pleinement à l’émergence d’un phénotype cellulaire mésenchymateux (TEM) et à une perte de l’intégrité épithéliale (à droite). |
|
KCNQ1 est un gène cible de la voie Wnt Les données qui décrivent le rôle anti-tumoral de KCNQ1 ne peuvent cependant à elles seules expliquer l’origine de la disparition du canal dans les cellules de phénotype mésen-chymateux, et dans les stades évolués de CCR. La réponse à cette question apparaît lorsqu’on stimule expérimentalement la voie Wnt/β-caténine par des moyens pharmacologiques ou moléculaires. Ces expériences démontrent en fait que l’expression de KCNQ1 est régulée négativement par cette voie. En effet, la β-caténine ainsi que le facteur de transcription TCF-4 (membre de la famille TCF/LEF [T-cell factor/lymphoid enhancer-binding factor], qui régule l’expression des gènes cibles de la voie Wnt) se lient directement au promoteur de KCNQ1 et provoquent la répression de son expression. Ces résultats révèlent ainsi que le gène du canal KCNQ1 est une nouvelle cible de la voie Wnt dont la répression intervient dans le processus de TEM selon un mécanisme jusqu’alors inconnu. En dévoilant l’interaction bidirectionnelle entre la voie Wnt/β-caténine et KCNQ1, ces travaux révèlent de nouvelles fonctions des canaux potassiques dans l’architecture des tissus sains, et leur implication dans le développement des tumeurs. La compréhension détaillée des fonctions alternatives des canaux pourrait ainsi contribuer à la caractérisation de nouveaux marqueurs et de cibles thérapeutiques novatrices [10] (➔). (➔) Voir la Nouvelle de E. Bon et al., m/s n° 6-7, juin-juillet 2017, page 596 |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Huang X, Jan LY. Targeting potassium channels in cancer . J Cell Biol. 2014;; 206 : :151.-62. 2. Jespersen T, Grunnet M, Olesen SP. The KCNQ1 potassium channel: from gene to physiological function . Physiology (Bethesda). 2005;; 20 : :408.-16. 3. Than BL, Goos JA, Sarver AL, et al. The role of KCNQ1 in mouse and human gastrointestinal cancers . Oncogene. 2014;; 33 : :3861.-8. 4. Den Uil SH, Coupé VM, Linnekamp JF, et al. Loss of KCNQ1 expression in stage II and stage III colon cancer is a strong prognostic factor for disease recurrence . Br J Cancer. 2016;; 115 : :1565.-74. 5. Rapetti-Mauss R, Bustos V, Thomas W, et al. Bidirectional KCNQ1:β-catenin interaction drives colorectal cancer cell differentiation . Proc Natl Acad Sci USA. 2017;; 114 : :4159.-64. 6. Dufour S, Chu YS, Thiery JP. Des cadhérines à la quantification de l’adhérence intercellulaire . Med Sci (Paris). 2005;; 21 : :459.-61. 7. Blanpain C. Importance de la voie de signalisation Wnt/β-caténine dans l’identité, l’activation et la différenciation des cellules souches épidermiques . Med Sci (Paris). 2007;; 23 : :34.-6. 8. Zhan T, Rindtorff N, Boutros M. Wnt signaling in cancer . Oncogene. 2017;; 36 : :1461.-73. 9. Zhou Y, Wong CO, Cho KJ, et al. Signal transduction. Membrane potential modulates plasma membrane phospholipid dynamics and K-Ras signaling . Science. 2015;; 349 : :873.-6. 10. Bon E, Brisson L, Chevalier S et al. Navβ4 : un suppresseur de métastases et un nouveau biomarqueur des cancers agressifs . Med Sci (Paris). 2017;; 33 : :596.-9. |