| |
| Med Sci (Paris). 34(2): 145–154. doi: 10.1051/medsci/20183402012.Les mastocytes, stakhanovistes de l’immunité Un rôle énigmatique dans les lésions radiques… Fabien Milliat1 and Agnès François1* 1Institut de radioprotection et de sureté nucléaire, Laboratoire de radiobiologie des expositions médicales, 31, avenue de la division Leclerc, 92260Fontenay-aux-Roses, France |
Vignette (Photo © Inserm - Bernadette Nabarra). Les mastocytes sont des cellules immunitaires dont la maturation, au sein du tissu hôte, est dictée par le microenvironnement tissulaire. L’avancée des recherches sur les mastocytes ces dernières années a montré que leurs fonctions vont bien au-delà des problématiques allergiques auxquelles ils ont été rapidement associés après leur découverte. La mise en évidence de leur participation aux réponses immunitaires innées ainsi qu’a la cicatrisation tissulaire a permis de comprendre leur implication dans certaines maladies. Néanmoins, il reste encore beaucoup à apprendre quant au rôle des mastocytes dans les dommages tissulaires radio-induits et, en particulier, il nous faut comprendre pourquoi certains résultats restent contradictoires. Pourtant, des outils thérapeutiques ciblant les mastocytes sont disponibles et pourraient offrir des perspectives thérapeutiques intéressantes dans la gestion des séquelles des radiothérapies. Les mastocytes sont des cellules immunitaires qui ont principalement été étudiées pour leur implication dans les réactions allergiques qui regroupent des phénomènes de gravité variable, allant de maladies allergiques chroniques aux réactions d’hypersensibilité immédiate et aux chocs anaphylactiques. Les mastocytes ne sont cependant pas uniquement les simples effecteurs de la réaction allergique. Au cours des dernières décennies, l’apparition de modèles animaux dépourvus de mastocytes a permis de mettre en évidence leur implication dans des processus physiopathologiques aussi divers que la cicatrisation tissulaire, la défense de l’organisme vis-à-vis de nombreux agents pathogènes mais également l’inflammation, la fibrose ou encore le développement tumoral [1]. |
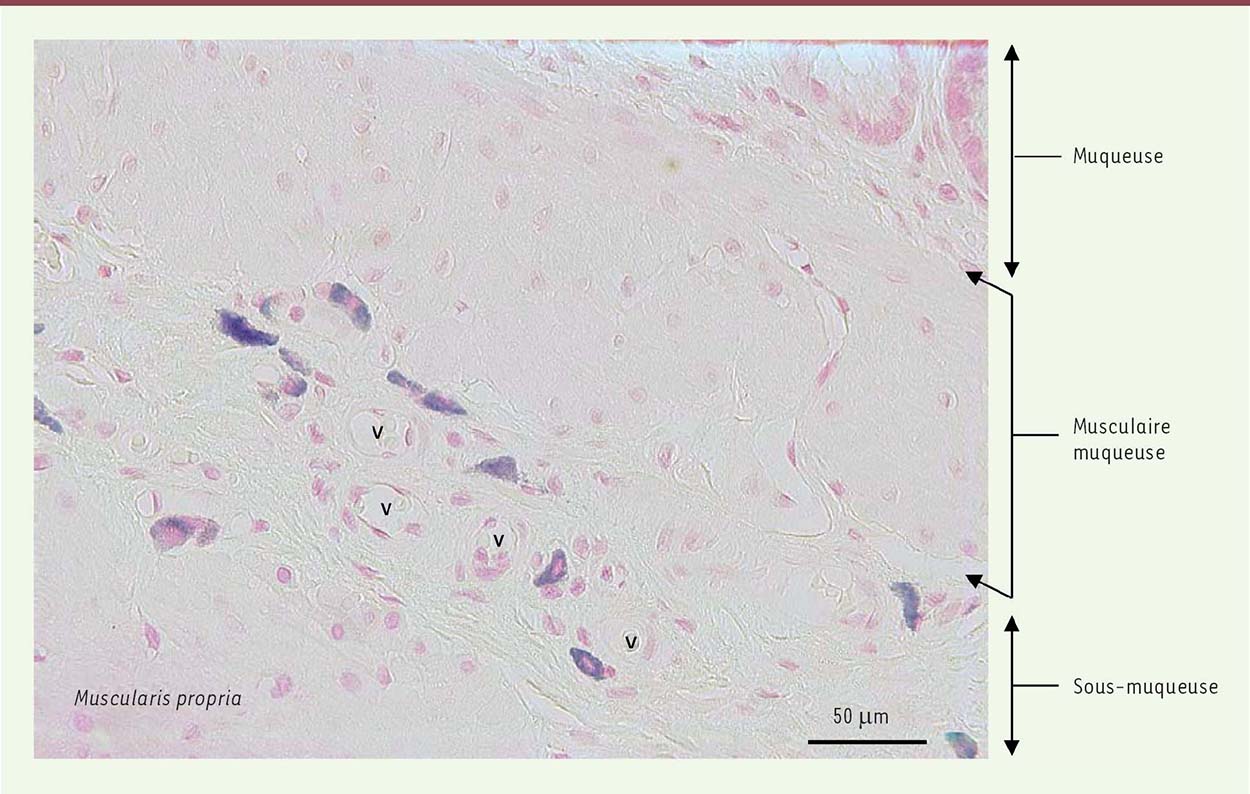
Les mastocytes : des inconnus célèbres… Paul Ehrlich, scientifique allemand, découvrit les mastocytes en 1878, durant sa thèse, alors qu’il étudiait les propriétés histologiques du bleu d’aniline. Il décela dans le tissu conjonctif de la peau, des cellules qui présentaient des granules colorés par le bleu d’aniline. Il les appela Mastzellen (du grec mastos, qui signifie mamelle) car il pensait que via leurs granules, ces cellules nourrissaient le tissu conjonctif environnant. Il observa que la coloration des granules mastocytaires par le bleu d’aniline était métachromatique, c’est-à-dire que les granules apparaissaient d’une couleur différente de celle du colorant utilisé pour les révéler. À cette époque, il était impossible de déterminer quel était le constituant des granules responsable de cet effet métachromatique, et ce n’est que de nombreuses années après la publication de leur découverte que les mastocytes ont été identifiés comme des cellules immunitaires produisant de l’histamine (responsable de l’effet métachromatique observé…) jouant un rôle déterminant dans la réponse allergique [2]. Paul Ehrlich reçu le Prix Nobel de physiologie ou médecine en 1908 pour ses travaux en hématologie et immunologie. Le mastocyte est un granulocyte à localisation essentiellement tissulaire dans sa forme mature. Il est présent dans les tissus richement vascularisés, assurant une interface avec l’environnement comme dans les poumons, la peau et le tube digestif (Figure 1). Les mastocytes et les basophiles dérivent de progéniteurs hématopoïétiques pluripotents qui expriment les marqueurs cKit (ou CD117), CD34, CD13 et le récepteur de la région Fc des immunoglobulines (Ig) E (FcERI). Aucune étude n’a réussi, aujourd’hui, a mettre en évidence, dans la moelle osseuse, une population cellulaire qui serait exclusivement progénitrice des mastocytes. L’orientation définitive des progéniteurs vers la lignée mastocytaire s’effectue donc en milieu extra-médullaire. Les progéniteurs migrent de la moelle vers les tissus périphériques via 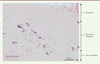 | Figure 1. Mastocytes résidents autour des vaisseaux (v) de la sous-muqueuse du rectum de rat. Les coupes tissulaires ont été colorées au bleu de Toluidine (coloration des granules mastocytaires en bleu foncé) et contre-colorées au « fast-red » (coloration de la structure globale du tissu en rose) (© coloration et photo A. François). |
la circulation sanguine. Dans le tissu hôte, les progéniteurs mastocytaires se différencient, en réponse au microenvironnement tissulaire qu’ils rencontrent, et acquièrent des phénotypes multiples, pouvant donner naissance à des populations mastocytaires qui diffèrent entre espèces, entre organes, d’un compartiment tissulaire à l’autre, ou, enfin, au sein d’un même compartiment tissulaire en fonction des conditions physiologiques ou pathologiques [3]. Des études in vitro portant sur la différenciation des progéniteurs mastocytaires ont permis de mettre en évidence le rôle prépondérant de certaines cytokines et de facteurs de transcription dans le processus de prolifération et de différenciation cellulaire, comme le stem cell factor (SCF, ligand du récepteur c-Kit), l’IL(interleukine)-3, pour les mastocytes murins, et l’IL-4, pour les mastocytes humains [4, 5]. C-Kit est fortement exprimé au niveau des cellules souches et des progéniteurs hématopoïétiques. Il joue un rôle important dans l’hématopoïèse [6]. Alors que les autres lignées hématopoïétiques perdent l’expression du récepteur c-Kit au cours de leur maturation, les mastocytes la conservent. Le SCF est le médiateur le plus important intervenant dans la régulation des fonctions mastocytaires. Il promeut la survie, la croissance et l’adhérence des mastocytes à la matrice extracellulaire [7]. Récemment, en 2016, Dahlin et al. ont pu mettre en évidence, chez l’homme, une population de cellules circulantes présentant toutes les caractéristiques de mastocytes immatures. Ces cellules pourraient constituer les premiers progéniteurs mastocytaires circulants identifiés [8]. Les mastocytes sont des cellules sécrétrices capables de stocker et de libérer, via un processus de dégranulation, de multiples médiateurs de l’inflammation, facteurs de croissance et protéases (Tableau I), en conditions physiologiques, et en réponse à de nombreuses situations pathologiques, telles que les traumatismes, les brûlures, l’irradiation (rayonnements ultra-violet et ionisants), ou encore à la fixation d’IgE sur les récepteurs qu’ils expriment. Ils sont également impliqués dans la reconnaissance d’antigènes bactériens, de venins, etc. Il existe plusieurs types de mastocytes. Dans l’intestin, on distingue ainsi, chez la souris, des mastocytes muqueux (mucosal mast cells, MMC) et des mastocytes séreux (connective tissue mast cells, CTMC). Cette distinction est fondée sur leur localisation tissulaire mais aussi sur leur phénotype, en particulier sur le type de médiateurs qu’ils synthétisent [9]. Les mastocytes de la muqueuse intestinale des rongeurs sont dits dépendants des lymphocytes T parce que leur développement est favorisé par des cytokines produites par ces derniers, en particulier les IL-3, -4, -9 et -10 [10]. Cette dépendance vis-à-vis des lymphocytes T a pu être démontrée par l’absence d’augmentation du nombre de MMC à la suite d’une infection par Trichinella spiralis chez des souris athymiques (dépourvues de thymus, organe de maturation des lymphocytes T), alors que les souris sauvages développent une mastocytose muqueuse réactive [11]. Les CTMC que l’on trouve essentiellement dans la sous-muqueuse intestinale, la peau et la cavité péritonéale, sont, eux, dits indépendants des lymphocytes T. Leur développement dépend essentiellement du SCF produit par les cellules stromales, comme les fibroblastes, mais aussi par les cellules musculaires lisses et les cellules endothéliales [10]. Tableau I.
| Médiateurs préformés stockés dans les granules |
Médiateurs néoformés |
|
Dérivés lipidiques |
|
PGE2, PGD2 |
| Histamine |
LTB4, LTC4 |
| Héparine et/ou chondroïtine sulfates |
PAF |
| Protéases neutres : chymase et tryptase |
Cytokines et facteurs de croissance |
| Carboxypeptidases |
GM-CSF, IFNa, IL-1a, IL-1 β, IL-1RA, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, |
| Cathepsine G |
IL-15, IL-16, IL-18, IL-25, LIF, LTβ, M-CSF, MIF, SCF, TGFβ, TNF, bFGF, EGF, PDGF-AA, PDGF-BB, VPF/ |
| Major basic protein (MBP) |
VEGF |
| Hydrolases acides |
Chemokines |
| peroxydase |
CCL2 (MCP-1), CCL3 (MIP-1a), CCL4 (MIP-1β), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (MCP-2), CCL11 (eotaxine), CCL13 (MCP-4), CCL16 (LEC/HCC4), CCL17 (TARC), CCL20 (LARC), CCL22 (MDC), CXCL2 (Groβ/MIP-2), CXCL3 (Groy), CXCL10 (IP-10), CXCL11 (I-TAC), XCL1 (lymphotactine) |
Principaux médiateurs mastocytaires. Certains sont préformés et stockés dans les granules cytoplasmiques, d’autres sont néoformés sous certaines conditions de stimulation (d’après [46]). PG : prostaglandine; LT : leucotriène; PAF : facteur d’activation plaquettaire; GM-CSF : granulocyte macrophage colony stimulating factor; IFN : interferon; IL- : interleukine; LIF : leukemia inhibitory factor; M-CSF : macrophage colony stimulating factor; MIF : macrophage migration inhibitory factor; SCF : stem cell factor; TGFβ : transforming growth factor beta; TNF : tumor necrosis factor; bFGF : basic fibroblast growth factor; EGF : epidermal growth factor; PDGF : platelet derived growth factor; VPF/VEGF : vascular permeability factor/vascular endothelial growth factor; CCL : chemokine ligand; CXCL : chemokine (C-X-C) motif ligand; XCL1 : XC motif ligand 1. |
Chez l’homme, l’hétérogénéité des mastocytes est déterminée par l’expression de deux sérines protéases, la chymase et la tryptase. On distingue ainsi les mastocytes n’exprimant que la tryptase (les MCT) de ceux qui expriment à la fois tryptase et chymase, ainsi que la carboxy-peptidase A3 et la cathepsine G (les MCTC). Une troisième population, numériquement minoritaire, et décrite plus récemment, n’exprime que la chymase (les MCC) [9, 12]. Contrairement à ce que l’on observe chez la souris, la distribution de ces sous-types ne présente pas de localisation tissulaire stricte chez l’homme. Si on établit une correspondance entre les mastocytes de souris et ceux de l’homme pour l’intestin, on peut assimiler les MCT aux MMC, et les MCTC aux CTMC [9]. Cette correspondance est renforcée par l’observation que des individus présentant des déficiences en lymphocytes T montrent une forte réduction du nombre de mastocytes exprimant la tryptase (MCT), alors que le nombre de mastocytes exprimant à la fois la chymase et la tryptase (MCTC) ne varie pas [13]. Cependant, ces distinctions sont très parcellaires et rendent difficilement compte du phénotype réel des mastocytes, étant donné le nombre important de médiateurs et de récepteurs impliqués dans l’acquisition phénotypique de la cellule. Les multiples niveaux de régulation du phénotype des mastocytes, génétique et épigénétique, une régulation par le microenvironnement tissulaire, et une régulation par le contexte physiopathologique, expliquent l’hétérogénéité et la plasticité des populations mastocytaires. Ainsi, par exemple, des mutations du gène codant le récepteur c-Kit, entraînant son activation chronique, sont observées dans 86 % des cas de mastocytoses chez l’homme. De même, des différences d’épissage de l’ARN issu de la transcription du gène codant c-Kit avant sa traduction en protéine, pourraient être responsables de désordres dans le maintien du nombre et de l’activité des mastocytes chez certains individus [14]. La diversité et la plasticité des mastocytes nourrissent la complexité et la disparité des résultats obtenus par la communauté scientifique sur leur implication dans divers contextes pathologiques. |
Quand les mastocytes rejouent « le bon, la brute et le truand… » Le bon : mastocytes et défense de l’organisme Les mastocytes sont désormais bien reconnus pour leur action déterminante dans la protection de l’organisme vis-à-vis de nombreux pathogènes ou composants pathogéniques (bactéries, parasites, venins de serpent). Résidant au sein des tissus et rapidement activés par de multiples stimulus, les mastocytes représentent des sentinelles pour l’organisme. Ils jouent un rôle prépondérant dans le recrutement précoce de cellules immunitaires telles que les neutrophiles ou les lymphocytes T, et sont la source de nombreux médiateurs inflammatoires importants dans la réponse aux infections. Une hyperplasie mastocytaire est ainsi très souvent observée aux sites d’infections bactérienne, virale et parasitaire [ 15]. La brute : les mastocytoses Les mastocytoses regroupent des pathologies hétérogènes, toutes caractérisées par une accumulation anormale de mastocytes, souvent au niveau de la peau (mastocytoses cutanées, les plus fréquentes) mais également au niveau d’autres organes (mastocytoses systémiques). Les mastocytes sont connus depuis longtemps pour être fortement impliqués dans les réactions allergiques et anaphylactiques. Généralement activés par des anticorps de type IgE, les mastocytes ont également la particularité de pouvoir être activés indépendamment de la présence d’antigènes, et être responsables de nombreuses réactions de type allergique ou de syndromes pseudo-anaphylactiques, à la suite de la prise de certains médicaments, par exemple. Récemment, un nouveau récepteur, spécifiquement exprimé par les mastocytes, le MrgprB2, équivalent au récepteur MrgprX2 chez l’homme (MAS-related protein-coupled receptor X2), a été découvert chez la souris. Il participerait aux réactions pseudoallergiques médicamenteuses et pourrait ouvrir le champ des possibles quant à la recherche de cibles thérapeutiques pour la gestion des effets secondaires associés à la prise de nombreux médicaments [16]. En plus des réactions allergiques et anaphylactiques, un certain nombre de pathologies humaines présentant un caractère auto-immun ont été reliées à la présence d’un nombre anormalement élevé de mastocytes [2]. Ainsi, la pemphigoïde bulleuse1, la sclérose en plaques, la polyarthrite rhumatoïde, la sclérodermie2 ou encore probablement le syndrome de Guillain-Barré3, la rectocolite hémorragique et la maladie de Crohn, deux maladies inflammatoires chroniques de l’intestin, et l’urticaire chronique idiopathique, présentent une composante mastocytaire majeure, même si le rôle très précis des mastocytes dans l’évolution de ces pathologies reste souvent à déterminer. Récemment, des travaux ont démontré que l’inhibition des mastocytes pouvait diminuer fortement les formations osseuses hétérotopiques dans un modèle murin de fibrodysplasie ossifiante progressive (FOP, ou maladie de l’homme de pierre), une maladie congénitale rare caractérisée par la transformation des tissus mous (tendons, muscles, ligaments) en os. Aucun traitement n’existe aujourd’hui contre la FOP et la considérer comme une mastocytose localisée pourrait offrir des possibilités thérapeutiques aux patients dans le futur [17]. Les mastocytes font également partie des nombreux types cellulaires qui sont présents au sein, ou à proximité, des tumeurs, dont ils pourraient favoriser la croissance par leurs propriétés pro-angiogéniques et pro-lymphangiogéniques [18]. Les mastocytoses cutanée ou systémique et les tumeurs localisées à mastocytes sont caractérisées par une prolifération clonale et une accumulation anarchique de mastocytes au sein de différents organes, avec des conséquences plus ou moins sévères en fonction des cas [19]. Le truand : mastocytes et lésions radiques L’utilisation de la radiothérapie dans le traitement des cancers a pour but de tirer avantage de l’importante radiosensibilité des cellules cancéreuses qui découle de leur niveau de prolifération élevé. La définition du protocole de radiothérapie (champ, dose totale, fractionnement, etc.) tient compte de plusieurs facteurs ayant trait à la tumeur elle-même (sa radiosensibilité, sa taille, son grade, les extensions éventuelles) et à sa localisation, et donc à la présence de tissus à risque à proximité. L’obtention d’une stérilisation tumorale complète est souvent limitée par la radiosensibilité des tissus sains adjacents qui sont présents dans le champ d’irradiation, ce qui limite la dose totale de radiothérapie pouvant être délivrée à la tumeur elle-même. La mise en place d’un protocole de radiothérapie est donc le fruit d’un compromis entre les bénéfices liés au contrôle tumoral et les risques associés à l’irradiation des tissus sains [ 20]. Parmi les radiothérapies, on distingue, en fonction de la localisation des tumeurs et donc des organes possiblement touchés, les radio-thérapies de la tête et du cou (pour les tumeurs oto-rhino-laryngo-logiques [ORL], cérébrales), les radiothérapies thoraciques (pour les tumeurs du sein, des poumons) et les radiothérapies abdomino-pel-viennes (pour les tumeurs gynécologiques, urologiques, rectales). En fonction des zones irradiées, les organes et/ou tissus à risque varient. Ainsi, les radiothérapies de la sphère abdomino-pelvienne sont associées à des complications digestives; celles du thorax peuvent entraîner des complications cardiaques et pulmonaires. Les conséquences tissulaires de l’exposition aux rayonnements ionisants sont caractérisées par la création de dommages à l’ADN entraînant la mort des cellules, en particulier des cellules des compar-timents souches. Ces pertes cellulaires compromettent la régénération tissulaire; l’homéostasie tissulaire est alors rompue (érosion des muqueuses, brûlures cutanées, etc.). Les pertes cellulaires ne sont pas les seules responsables des lésions tissulaires observées après radiothérapie. La réponse aux rayonnements est une réponse cicatricielle concertée, impliquant tous les compartiments tissulaires. L’activation des compartiments vasculaire et mésenchymateux (cellules endothéliales, cellules musculaires lisses, fibroblastes) perpétue l’inflammation radio-induite et favorise l’évolution de la réponse tissulaire vers une inflammation chronique, puis une fibrose, un processus post-traumatique chronique auto-entretenu et encore aujourd’hui extrêmement difficile à juguler [21, 22] (➔). (➔) Voir la Synthèse de A. François et al., m/s n° 3, mars 2009, page 267 Chez la souris, l’apparition d’un érythème cutané, 9 jours après une irradiation localisée à forte dose (40 Gy [gray, 1 rad = 1 centiGy]), repose en partie sur l’his-tamine produite par les mastocytes [23]. L’observation des cellules présentes dans des échantillons de peau provenant de femmes traitées par radiothérapie pour des cancers du sein, a permis d’observer une augmentation du nombre de cellules positives pour les principaux marqueurs des mastocytes que sont le récepteur c-Kit, la tryptase et la chymase, jusqu’à 18 mois après la radiothérapie. Ces échantillons de peau présentent également une augmentation de l’expression des pro-collagènes par les fibroblastes, et du SCF, qui pourrait être impliqué dans le recrutement des mastocytes. Des doubles marquages ont également révélé une proximité entre fibroblastes et mastocytes dans le tissu irradié [24, 25]. Ces résultats suggèrent l’implication des mastocytes dans le développement de la fibrose radique cutanée chez l’homme, même si les mécanismes restent inconnus. Après irradiation thoracique, on note, dans les lavages broncho-alvéolaires de patients, une augmentation du nombre de lymphocytes, de neutrophiles, d’éosinophiles et de mastocytes. La relation directe entre l’hyperpla-sie mastocytaire que l’on observe et le développement de l’inflammation et de la fibrose pulmonaires reste cependant incertaine [26]. Dans un modèle murin d’irradiation thoracique, une hyperplasie mastocytaire, corrélée à la sévérité des lésions fibreuses, a également été observée. L’analyse des gènes impliqués dans le développement des lésions provoquées par l’irradiation incrimine plusieurs protéases d’origine mastocytaire [27, 28]. Toujours chez la souris, l’utilisation de l’imatinib, un inhibiteur des récepteurs à tyrosine kinase, comme c-Kit exprimé par les mastocytes, a permis de diminuer l’influx de mastocytes dans les poumons après une irradiation thoracique de 18 Gy avec, pour conséquence, une diminution de l’inflammation pulmonaire et de la fibrose radique [29]. L’imatinib est utilisé chez l’homme pour le traitement de certaines tumeurs, comme la leucémie myéloïde chronique. Il a reçu l’accord de la Food and drug administration (FDA), aux États-Unis, pour traiter des mastocytoses systémiques chez l’adulte, à condition que le gène codant le récepteur c-Kit chez les patients ne soit pas muté [30]. Tableau II.
|
Modèle |
Organe |
Dose |
Molécule utilisée |
Rôle démontré des Mastocytes (oui/non) |
| [24, 25] |
Homme |
Peau (traitement d’un cancer mammaire) |
30 à 56 Gy Protocoles variables |
Aucune |
Non Association lésions cutanées/présence de mastocytes |
| [23] |
Souris |
Peau |
40 Gy |
Bepostatine (antagoniste des récepteurs H1 de l’histamine) Chlorphéniramine (antagoniste des récepteurs H1 de l’histamine) |
Oui Rôle délétère des mastocytes |
| [26] |
Homme |
Poumon (traitement d’un cancer mammaire métastatique) |
40 à 50 Gy |
|
Non Augmentation des mastocytes dans les lavages broncho-alvéolaires |
| [28, 27] |
Souris |
Poumon |
18 Gy thorax entier |
Aucune |
Non Association nombre de mastocytes/ atteintes pulmonaires |
| [29] |
Souris |
Poumon |
18 Gy thorax entier |
Imatinib (inhibiteur du récepteur c-kit) |
Oui Rôle délétère des mastocytes |
| [31] |
Souris Rat Macaque Rhésus |
Poumon Poumon Poumon |
10 à 16 Gy 14 et 15 Gy 10 Gy |
Aucune |
Non Pas de relation entre le nombre de mastocytes et les lésions pulmonaires |
| [32] |
Rat |
Poumon |
|
Hespéridine (flavonoïde anti-inflammatoire et antioxydant) |
Non Association effet prophylactique/diminution des mastocytes |
| [34] |
Rat déficient en mastocytes |
Cœur |
18 Gy |
Aucune |
Oui Rôle protecteur des mastocytes |
| [35] |
Rat |
Cœur |
21 Gy |
Capsaïcine (déplétion des nerfs sensoriels) |
Oui Indirectement, rôle protecteur des mastocytes |
| [37] |
Rat déficient en mastocytes |
Intestin |
21 Gy |
Aucune |
Oui Rôle protecteur des mastocytes vis-à-vis des lésions précoces, délétère vis-à-vis des lésions tardives |
| [40] |
Rat |
Intestin |
16,5 Gy |
Agoniste des récepteurs PAR-2 |
Oui Démonstration indirecte du rôle délétère des mastocytes vis-à-vis des lésions tardives |
| [41] |
Souris déficientes en mastocytes |
Rectum |
27 Gy |
Aucune |
Oui Rôle délétère des mastocytes vis-à-vis des lésions rectales précoces et tardives |
| [41] |
Homme |
Rectum |
45 Gy |
Aucune |
Non Association lésions rectales/nombre de mastocytes |
| [43] |
Rat |
Rectum |
27 Gy |
Kétotifène (antagoniste des récepteurs H1 de l’histamine) |
Oui Réduction de la douleur avec la stabilisation des mastocytes |
Synthèse des études réalisées et citées dans le texte concernant le rôle des mastocytes dans les lésions radio-induites à la peau, au poumon, au cœur, à l’intestin grêle et au rectum. |
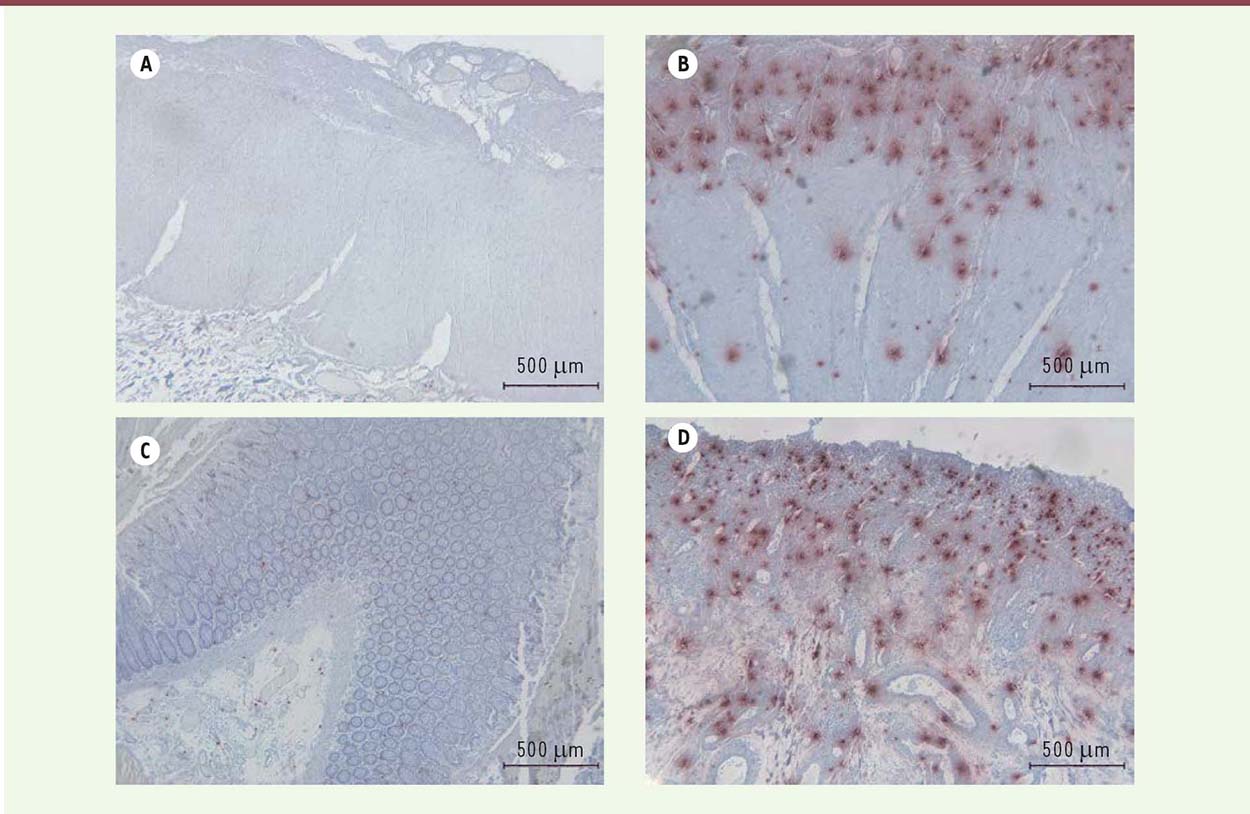
Une étude, publiée en 2013, n’a pas mis en évidence de relation entre hyperplasie mastocytaire et susceptibilités au développement de l’inflammation et de la fibrose radique pulmonaire chez plusieurs souches de souris, de rats et chez le primate non humain, exposés à des doses de radiothérapie comprises entre 10 et 16 Gy sur la totalité du thorax [31]. Pourtant, une étude récente réalisée chez le rat démontre qu’après application d’une dose plus importante au thorax (18 Gy), l’administration préventive d’hespéridine, un flavonoïde que l’on retrouve dans les fruits et les légumes, en particulier l’orange, réduisait les dommages pulmonaires radio-induits [32]. Les lésions radio-induites sont caractérisées par la présence d’un important stress oxydant et la mise en place d’une réponse inflammatoire aiguë. Les propriétés anti-oxydantes et anti-inflammatoires des flavonoïdes pourraient expliquer leur bénéfice sur les lésions pulmonaires dans cette étude. La réduction des lésions pulmonaires s’accompagne, en particulier, d’une chute du nombre de mastocytes infiltrants. La relation de cause à effet n’est pas démontrée, mais cette étude ouvre une nouvelle fois le champ des possibilités thérapeutiques contre les séquelles pulmonaires des radiothérapies. Quoiqu’il en soit, de nombreux travaux restent à réaliser afin de comprendre si les mastocytes jouent un rôle dans le développement des pneumopathies radiques, et s’il existe différentes susceptibilités à l’hyperplasie ou à l’activation mastocytaire chez l’homme après radiothérapie, peut-être en fonction de mutations du gène codant le récepteur c-Kit, de modifications épigénétiques, ou de tout autre facteur en lien avec la physiologie des mastocytes. L’irradiation des tumeurs du sein, du poumon gauche, ou du médiastin, est associée à des séquelles cardiaques comme des péricardites chroniques, une accélération des processus athérosclérotiques, des modifications des propriétés des valves cardiaques et des fibroses du péricarde et du myocarde [33]. Contrairement à leur rôle néfaste dans les lésions de la peau et des poumons, les mastocytes pourraient avoir un rôle protecteur vis-à-vis des lésions cardiaques radio-induites. Ainsi, chez le rat Ws/Ws4 (déficient en mastocytes), lors d’une irradiation localisée du cœur à 18 Gy, l’absence de mastocytes accélère les modifications structurelles et fonctionnelles du muscle cardiaque après irradiation, peut-être en lien avec le réseau nerveux sensitif [34, 35]. Aucune étude fondée sur des données humaines n’a été publiée à ce jour sur le rôle des mastocytes dans les lésions cardiaques radio-induites, mais l’intérêt de la communauté scientifique pour ces cellules et leur rôle dans le développement des séquelles cardiaques des radiothérapies demeure [36]. Le rôle des mastocytes dans le développement de l’entéropathie radique reste flou. Les résultats varient d’une étude à l’autre. Les rats Ws/Ws, dépourvus de mastocytes, présentent des lésions inflammatoires aiguës, à la suite d’une irradiation de 21 Gy localisée sur une anse d’intestin grêle, qui s’avèrent plus importantes que celles de leurs homologues sauvages mais des lésions fibreuses tardives qui se révèlent moins sévères. Les mastocytes auraient donc une action protectrice durant la phase inflammatoire (2 semaines post-irradiation) mais aussi une action délétère, en participant à la fibrose chronique que l’on observe dans la phase tardive de l’évolution des lésions radiques (6 mois après irradiation [37]). Alors que le rôle protecteur des mastocytes est attribué aux MMC (mastocytes muqueux), qui jouent un rôle important dans la régulation de l’inflammation, l’effet pro-fibrosant serait associé à l’action des CTMC (mastocytes conjonctifs), qui s’accumulent dans les zones fibreuses riches en TGF-β (transforming growth factor b). Cette accumulation dans les zones fibreuses pourrait éventuellement résulter de l’action chimioattractante du TGF-β1 sur les mastocytes [38], le TGF-β 1 étant un facteur pro-fibrosant. Alors que les rats Ws/Ws présentent de moindres quantités de collagène dans les lésions chroniques, l’expression de l’ARNm du TGF-β 1 est, en revanche, dans les tissus de ces rats, plus importante. Les mastocytes seraient donc nécessaires à l’action pro-fibrosante du TGF-β. En plus des médiateurs ayant une action profibrosante libérés par les mastocytes activés, comme l’histamine, l’IL-4, le TGF-β1, le FGF (fibroblast growth factor) et le TNF-a (tumor necrosis factor alpha), il semble que les mastocytes, via la tryptase, peuvent également stimuler les récepteurs activables par les protéases (PAR). Les PAR sont exprimés par différents types cellulaires impliqués dans le développement des lésions radiques intestinales, comme les fibroblastes, les cellules endothéliales et les cellules épithéliales. Ces récepteurs interviennent dans des fonctions biologiques importantes comme l’agrégation des plaquettes, l’inflammation, la migration et la prolifération cellulaires. Chez le rat, une augmentation de l’expression et de l’activation de PAR-2 a été mise en évidence dans les lésions radiques intestinales [39] et l’administration d’un agoniste de PAR-2, chez le rat, exacerbe les lésions radiques intestinales, 2 semaines après exposition à 16,5 Gy, confirmant le rôle de PAR-2 dans le développement des dommages intestinaux radio-induits. L’observation d’une diminution de l’activation de PAR-2 dans les lésions de rats déficients en mastocytes, a permis de mettre en évidence le rôle de ces cellules dans l’activation du récepteur, et donc probablement dans le développement des lésions radiques digestives de type fibroprolifé-ratif [40]. Chez l’homme, nous avons observé une hyperplasie mastocytaire dans le rectum, 6 semaines après radiothérapie préopératoire à 45 Gy pour une tumeur rectale (Figure 2). Les mastocytes sont nombreux au site irradié. Ils sont situés au niveau des lésions de la paroi rectale. Cependant, aucun argument ne nous permet, aujourd’hui, de savoir si l’hyperplasie mastocytaire que l’on constate est la cause ou une conséquence des lésions observées. Utilisant un modèle de rectite radique chez la souris, nous avons montré que l’irradiation du rectum entraîne une hyperplasie mastocytaire. Contrairement à ce qui a été démontré chez le rat, la déficience en mastocytes chez la souris (en utilisant des souris Kit W-sh/W-sh, déficientes en mastocytes) protège à la fois des lésions précoces et des lésions tardives radio-induites, suggérant un rôle délétère des mastocytes dans la réponse digestive aux rayonnements ionisants (Figure 3). Les mastocytes sont également capables, in vitro, de modifier le phénotype des cellules musculaires lisses de la paroi digestive, en un phénotype pro-fibrosant caractéristique du processus fibreux radio-induit [41, 42]. Chez le rat, l’irradiation du colorectum est associée à une hyperplasie et une hypertrophie des mastocytes. La stabilisation des mastocytes par le kétotifène (un anti-histaminique, antagoniste des récepteurs de l’histamine de type H1) réduit l’allodynie radio-induite, une douleur déclenchée par un stimulus normalement indolore, suggérant un rôle des mastocytes dans le développement de la douleur après irradiation du côlon [43]. 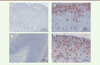 | Figure 2.Exemple d’hyperplasie mastocytaire chez l’homme. Marquage immunohistochimique des mastocytes (en rouge) par un anticorps spécifique de la tryptase sur des coupes de tissu rectal sain et irradié, 6 semaines après radiothérapie préopératoire à 45 Gy pour adénocarcinome du rectum. A: muscularis propria saine. B : muscularis propria avec envahissement mastocytaire. C : muqueuse saine. D : muqueuse avec envahissement mastocytaire (marquage K. Blirando, © photos A. François, d’après [ 45]). |
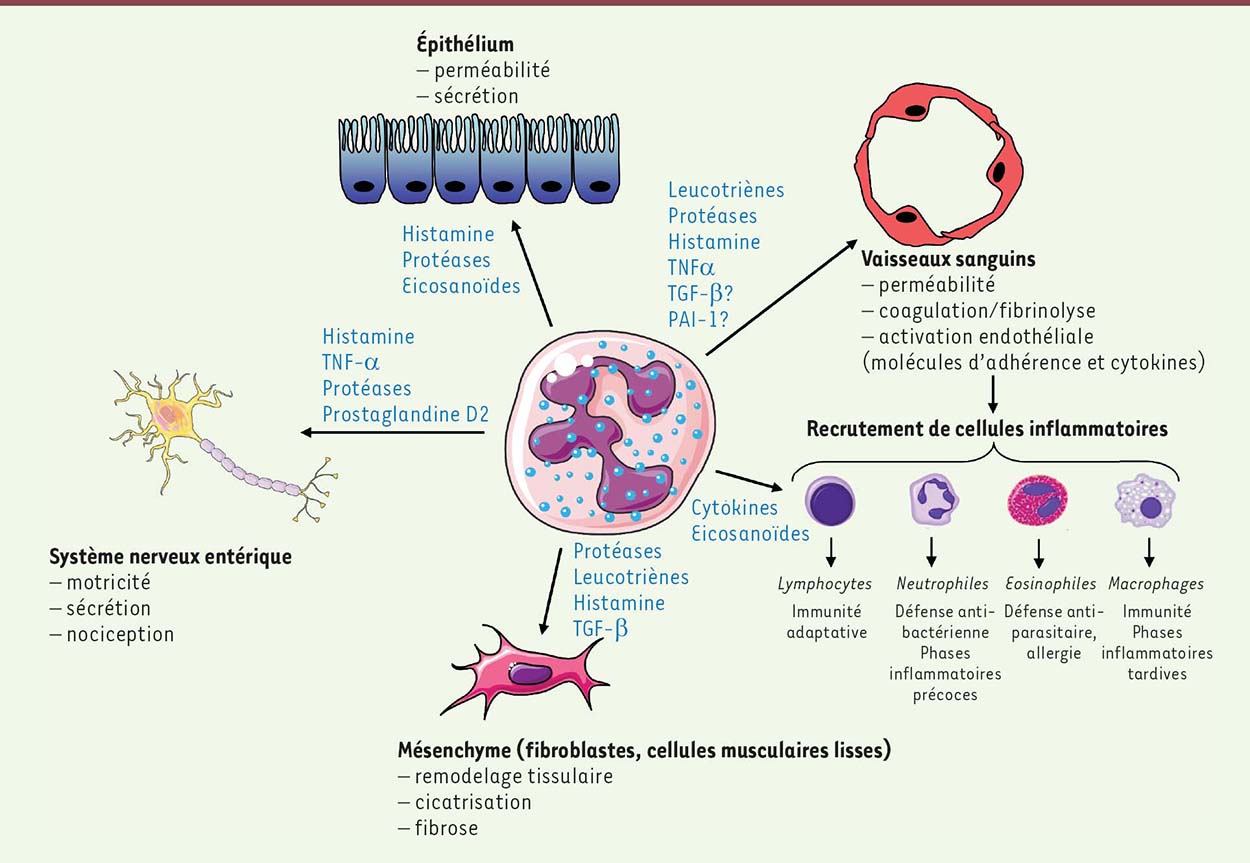
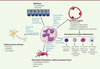 | Figure 3. Influence des mastocytes sur les différents compartiments du tissu digestif. Les mastocytes participent à la défense anti-bactérienne et anti-parasitaire par le recrutement de cellules immuno-compétentes, mais peuvent également, et ce en particulier après irradiation, favoriser la réponse inflammatoire en jouant sur les propriétés vasculaires, le recrutement de cellules inflammatoires, les propriétés de la barrière intestinale, le système nerveux entérique et enfin l’activation du mésenchyme, participant ainsi à la chronicité de la réponse inflammatoire radio-induite. |
Toutes ces études montrent qu’il est difficile de cerner précisément le rôle des mastocytes dans les lésions radiques digestives. Il n’existe à l’heure actuelle aucun argument qui pourrait expliquer les résultats disparates de la littérature. Les espèces différentes (rat ou souris) ou les organes différents (intestin grêle/rectum) pourraient suffire à expliquer ces disparités. |
L’ensemble des données dont nous avons fait état montrent l’implication importante des mastocytes dans le développement des lésions radiques de différents organes. Pourtant, de nombreuses questions restent sans réponse actuellement. Pourquoi et comment les mastocytes peuvent-ils être bénéfiques dans certains organes et délétères dans d’autres ? Considérant la diversité de ces cellules, dans quelle mesure les études in vivo, notamment chez les rongeurs, peuvent-elles nous éclairer sur ce qui est effectif chez l’homme ? Les animaux déficients en mastocytes ne développant pas de pathologie ni d’infection particulière, quel processus prend le relais alors et quelles sont les modifications apportées au système immunitaire de ces animaux ? Des modèles in vivo pertinents, possédant des mastocytes, mais dans lesquels certaines fonctions pourraient être altérées, sont nécessaires afin de répondre à ces questions. Les médiateurs mastocytaires, comme les protéases, pourraient représenter des cibles thérapeutiques intéressantes, d’autant qu’il existe déjà sur le marché des inhibiteurs de chymase et tryptase. De nombreux efforts restent à faire en recherche préclinique afin d’approfondir nos connaissances de la physiopathologie des processus cicatriciels mis en place par les tissus sains irradiés, afin de comprendre les mécanismes de recrutement et d’activation des mastocytes au sein de ces tissus, et de décrypter leurs fonctions et leurs relations avec les cellules environnantes. Il est probable que tous les aspects de la participation des mastocytes à la cicatrisation tissulaire ne soient pas délétères. Une compréhension plus fine de leur contribution à la réponse tissulaire à l’irradiation permettra la mise en œuvre de stratégies thérapeutiques plus pertinentes, avec, plus largement, une application possible aux processus de fibrose. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Galli SJ, Tsai M. Mast cells: versatile regulators of inflammation, tissue remodeling, host defense and homeostasis . J Dermatol Sci. 2008;; 49 : :7.-19. 2. Beaven MA. Our perception of the mast cell from Paul Ehrlich to now . Eur J Immunol. 2009;; 39 : :11.-25. 3. Dahlin JS, Ding Z, Hallgren J. Distinguishing mast cell progenitors from mature mast cells in mice. Stem Cells Dev. 2015;; 24 : :1703.-11. 4. Metcalfe DD, Baram D, Mekori YA. Mast cells. Physiol Rev. 1997;; 77 : :1033.-79. 5. Sasaki H, Kurotaki D, Tamura T. Regulation of basophil and mast cell development by transcription factors. Allergol Int. 2016;; 65 : :127.-34. 6. Edling CE, Hallberg B. c-Kit--a hematopoietic cell essential receptor tyrosine kinase . Int J Biochem Cell Biol. 2007;; 39 : :1995.-8. 7. Bischoff SC. Physiological and pathophysiological functions of intestinal mast cells. Semin Immunopathol. 2009;; 31 : :185.-205. 8. Dahlin JS, Malinovschi A, Ohrvik H, et al. Lin- CD34hi CD117int/hi FcepsilonRI+ cells in human blood constitute a rare population of mast cell progenitors. Blood. 2016;; 127 : :383.-91. 9. Welle M. Development, significance, and heterogeneity of mast cells with particular regard to the mast cell-specific proteases chymase and tryptase . J Leukoc Biol. 1997;; 61 : :233.-45. 10. Kitamura Y, Kasugai T, Arizono N, Matsuda H. Development of mast cells and basophils: processes and regulation mechanisms . Am J Med Sci. 1993;; 306 : :185.-91. 11. Ruitenberg EJ, Elgersma A. Absence of intestinal mast cell response in congenitally athymic mice during Trichinella spiralis infection. Nature. 1976;; 264 : :258.-60. 12. Irani AM, Schwartz LB. Human mast cell heterogeneity. Allergy Proc. 1994;; 15 : :303.-8. 13. Irani AM, Craig SS, DeBlois G, et al. Deficiency of the tryptase-positive, chymase-negative mast cell type in gastrointestinal mucosa of patients with defective T lymphocyte function . J Immunol. 1987;; 138 : :4381.-6. 14. Cruse G, Metcalfe DD, Olivera A. Functional deregulation of KIT: link to mast cell proliferative diseases and other neoplasms . Immunol Allergy Clin North Am. 2014;; 34 : :219.-37. 15. Dawicki W, Marshall JS. New and emerging roles for mast cells in host defence. Curr Opin Immunol. 2007;; 19 : :31.-8. 16. McNeil BD, Pundir P, Meeker S, et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature. 2015;; 519 : :237.-41. 17. Brennan TA, Lindborg CM, Bergbauer CR, et al. Mast cell inhibition as a therapeutic approach in fibrodysplasia ossificans progressiva (FOP). Bone. 2017. pii: S8756-3282(17)30319-8. doi: 10.1016/j.bone.2017.08.023. 18. Ribatti D, Crivellato E. Mast cells, angiogenesis and cancer. Adv Exp Med Biol. 2011;; 716 : :270.-88. 19. Valent P, Akin C, Hartmann K, et al. Advances in the Classification and Treatment of Mastocytosis: Current Status and Outlook toward the Future. Cancer Res. 2017;; 77 : :1261.-70. 20. Denham JW, Hauer-Jensen M. The radiotherapeutic injury-a complex wound. Radiother Oncol. 2002;; 63 : :129.-45. 21. Francois A, Milliat F, Jullien N, et al. Radiothérapie: quelles orientations thérapeutiques contre les séquelles digestives ? Med Sci (Paris). 2009;; 25 : :267.-72. 22. Chopra RR, Bogart JA. Radiation therapy-related toxicity (including pneumonitis and fibrosis). Emerg Med Clin North Am. 2009;; 27 : :293.-310. 23. Moriyasu S, Yamamoto K, Kureyama N, et al. Involvement of histamine released from mast cells in acute radiation dermatitis in mice . J Pharmacol Sci. 2007;; 104 : :187.-90. 24. Riekki R, Harvima IT, Jukkola A, et al. The production of collagen and the activity of mast-cell chymase increase in human skin after irradiation therapy. Exp Dermatol. 2004;; 13 : :364.-71. 25. Westbury CB, Freeman A, Rashid M, et al. Changes in mast cell number and stem cell factor expression in human skin after radiotherapy for breast cancer. Radiother Oncol. 2014;; 111 : :206.-11. 26. Majori M, Poletti V, Curti A, et al. Bronchoalveolar lavage in bronchiolitis obliterans organizing pneumonia primed by radiation therapy to the breast . J Allergy Clin Immunol. 2000;; 105 : :239.-44. 27. Lemay AM, Haston CK. Radiation-induced lung response of AcB/BcA recombinant congenic mice. Radiat Res. 2008;; 170 : :299.-306. 28. Haston CK, Begin M, Dorion G, Cory SM. Distinct loci influence radiation-induced alveolitis from fibrosing alveolitis in the mouse. Cancer Res. 2007;; 67 : :10796.-803. 29. Thomas DM, Fox J, Haston CK. Imatinib therapy reduces radiation-induced pulmonary mast cell influx and delays lung disease in the mouse . Int J Radiat Biol. 2010;; 86 : :436.-44. 30. Ustun C, DeRemer DL, Akin C. Tyrosine kinase inhibitors in the treatment of systemic mastocytosis. Leuk Res. 2011;; 35 : :1143.-52. 31. Down JD, Medhora M, Jackson IL, et al. Do variations in mast cell hyperplasia account for differences in radiation-induced lung injury among different mouse strains. , rats and nonhuman primates? Radiat Res. 2013;; 180 : :216.-21. 32. Haddadi GH, Rezaeyan A, Mosleh-Shirazi MA, et al. Hesperidin as radioprotector against radiation-induced lung damage in rat: a histopathological study . J Med Phys. 2017;; 42 : :25.-32. 33. Raghunathan D, Khilji MI, Hassan SA, Yusuf SW. Radiation-Induced Cardiovascular Disease. Curr Atheroscler Rep. 2017;; 19 : :22.. 34. Boerma M, Wang J, Wondergem J, et al. Influence of mast cells on structural and functional manifestations of radiation-induced heart disease. Cancer Res. 2005;; 65 : :3100.-7. 35. Sridharan V, Tripathi P, Sharma S, et al. Roles of sensory nerves in the regulation of radiationinduced structural and functional changes in the heart . Int J Radiat Oncol Biol Phys. 2014;; 88 : :167.-74. 36. Boerma M. Experimental radiation-induced heart disease: past, present, and future. Radiat Res. 2012;; 178 : :1.-6. 37. Zheng H, Wang J, Hauer-Jensen M. Role of mast cells in early and delayed radiation injury in rat intestine. Radiat Res. 2000;; 153 : :533.-9. 38. Gruber BL, Marchese MJ, Kew RR. Transforming growth factor-beta 1 mediates mast cell chemotaxis. J Immunol. 1994;; 152 : :5860.-7. 39. Wang J, Zheng H, Hollenberg MD, et al. Up-regulation and activation of proteinase-activated receptor 2 in early and delayed radiation injury in the rat intestine: influence of biological activators of proteinase-activated receptor 2. Radiat Res. 2003;; 160 : :524.-35. 40. Wang J, Boerma M, Kulkarni A, et al. Activation of protease activated receptor 2 by exogenous agonist exacerbates early radiation injury in rat intestine . Int J Radiat Oncol Biol Phys. 2010;; 77 : :1206.-12. 41. Blirando K, Milliat F, Martelly I, et al. Mast cells are an essential component of human radiation proctitis and contribute to experimental colorectal damage in mice. Am J Pathol. 2011;; 178 : :640.-51. 42. Bourgier C, Haydont V, Milliat F, et al. Inhibition of Rho kinase modulates radiation induced fibrogenic phenotype in intestinal smooth muscle cells through alteration of the cytoskeleton and connective tissue growth factor expression. Gut. 2005;; 54 : :336.-43. 43. Durand C, Pezet S, Eutamene H, et al. Persistent visceral allodynia in rats exposed to colorectal irradiation is reversed by mesenchymal stromal cell treatment. Pain. 2015;; 156 : :1465.-76. 44. Galli SJ, Nakae S, Tsai M. Mast cells in the development of adaptive immune responses. Nat Immunol. 2005;; 6 : :135.-42. 45. Blirando K, Milliat F, Martelly I, et al. Mast cells are an essential component of human radiation proctitis and contribute to experimental colorectal damage in mice. Am J Pathol. ; 178 : :640.-51. 46. Galli SJ, Kalesnikoff J, Grimbaldeston MA, et al. Mast cells as tunable effector and immunoregulatory cells: recent advances. Annu Rev Immunol. 2005;; 23 : :749.-86. |