| |
| Med Sci (Paris). 34(3): 208–210. doi: 10.1051/medsci/20183403006.Une activation immunitaire à l’interface fœto-maternelle précède la parturition humaine Céline Méhats,1* Louis Marcellin,1,2 and Thomas Schmitz3 1Institut Cochin, Inserm U1016, CNRS UMR8104, université Paris Descartes, 24, rue du Faubourg St Jacques, 75014Paris, France 2AP-HP, maternité Port Royal, service de gynécologie obstétrique II et médecine de la reproduction, 75014Paris, France 3AP-HP, hôpital Robert Debré, service de gynécologie obstétrique, 75019Paris, France |
La parturition est l’ensemble des phénomènes mécaniques conduisant à l’expulsion spontanée du fœtus hors de l’utérus au terme de la gestation, qui dure en moyenne dans l’espèce humaine, 40 semaines et 3 jours (40 SA, pour semaines d’aménorrhée). La parturition nécessite l’intégration coordonnée dans le temps et dans l’espace de modifications biochimiques dans les tissus gestationnels, le corps et col utérins, et les membranes fœtales1, pour aboutir aux trois événements qui caractérisent le travail obstétrical : les contractions du myomètre, la dilatation et l’effacement du col, et la rupture des membranes fœtales. La survenue désynchronisée ou non coordonnée de l’un de ces événements, parfois des trois, conduit le plus souvent à des anomalies de la durée de grossesse qui sont associées à une augmentation de la mortalité et de la morbidité périnatales. En France, 7,5 % des naissances sont prématurées (avant 37 SA), dont 40 % spontanément, et 17,1 % des naissances surviennent au-delà du terme [1]. Si la parturition peut avoir une manifestation soudaine, elle fait toutefois suite à une maturation du myomètre, du col et des membranes fœtales au cours des dernières semaines de la grossesse. |
Les tissus gestationnels se modifient progressivement en préparation à la parturition Alors que le myomètre est maintenu dans une quiescence relative tout au long de la grossesse permettant une distension compatible avec la croissance fœtale, il va produire graduellement les molécules indispensables pour générer les contractions utérines du travail. L’expression par le myomètre des récepteurs spécifiques des facteurs contracturants, tels les prostaglandines ou l’ocytocine, et de jonctions communicantes fonctionnelles entre les myocytes, augmente ainsi progressivement en fin de grossesse. Ces jonctions assurent le couplage des cellules musculaires lisses et garantissent la coordination et la propagation de la contraction à tous les myocytes utérins. La maturation du col utérin commence par son ramollissement, un processus lent et modulé, là aussi durant la fin de la grossesse. Ce ramollissement se caractérise par une augmentation de la compliance du tissu. Une réorganisation de la structure des fibrilles de collagène et l’augmentation de glycosaminoglycanes et de protéoglycanes spécifiques, formant un gel hydraté, participent à cette modification de la force élastique du col. Enfin, la rupture des membranes n’est pas simplement la conséquence physique de micro-cassures induites par l’élongation et/ou les contractions utérines. Elle fait également suite à une maturation biochimique au niveau de la région recouvrant le col [2]. Dans cette zone, un remodelage important de la matrice extracellulaire, corrélé à une fragilisation physique, est observé dans les dernières semaines de la grossesse [3]. |
Le déterminisme de la parturition humaine reste incompris à ce jour La question d’une activation soudaine des tissus gestationnels ou d’une levée de l’inhibition des mécanismes du travail reste ouverte. Depuis le début du XXe siècle, différentes expériences ont montré le lien étroit entre le taux de progestérone, sa production par le corps jaune, et le maintien de la gestation chez la lapine, la rate et la souris, identifiant ainsi la progestérone comme l’hormoneclé de la gestation. Cette hormone a un effet local sur le myomètre en entraînant une diminution de la propagation des potentiels de membranes et en bloquant le couplage excitation-contraction; l’activité contractile ne peut alors se propager et le tissu utérin générer une contraction globale et organisée [4]; c’est le « bloc progestéronique ». La levée de cette inhibition par la chute de la concentration plasmatique de la progestérone précède la mise-bas chez les rongeurs, la lapine et les ruminants. Chez les rongeurs, cette diminution brusque de progestérone est provoquée par la lutéolyse qui est déclenchée par l’augmentation de prostaglandines dans l’utérus lorsqu’un certain degré de maturation pulmonaire fœtale est atteint. Chez la brebis, la maturation de l’axe hypothalamo-hypophysaire fœtal entraîne la production surrénalienne de glucocorticoïdes : le cortisol fœtal va induire la synthèse d’une enzyme placentaire qui convertit la progestérone en précurseur des œstrogènes, diminuant ainsi sa concentration plasmatique [5]. La théorie du « bloc progestéronique » trouve ses limites pour l’espèce humaine. L’administration de progestérone ne peut en effet maintenir la grossesse à terme et la concentration plasmatique de progestérone ne diminue pas avant l’accouchement. Il a été évoqué que l’action locale de la progestérone ne dépendait pas de sa concentration sérique. Aussi, le concept d’un blocage fonctionnel périphérique de la progestérone a été formulé et plusieurs mécanismes possiblement redondants ont été proposés dans la parturition humaine : un catabolisme local de l’hormone dans la décidue2 maternelle, les membranes fœtales et/ou le myomètre; une modification de l’équilibre entre récepteurs activateurs et répresseurs de la progestérone; une modification de l’équilibre de facteurs de transcription ou co-régulateurs des récepteurs de la progestérone; et, plus récemment, des régulations possibles par des microARN [6]. On sait également que l’accouchement s’apparente à une réaction inflammatoire intra-utérine avec l’augmentation des concentrations de cytokines pro-inflammatoires dans le liquide amniotique, dans le myomètre et les membranes fœtales, et l’infiltration de neutrophiles et de macrophages dans le myomètre et le col utérin. L’initiation du travail obstétrical est ainsi actuellement décrite comme une transition d’un état quiescent vers un état pro-inflammatoire des tissus gestationnels [7]. Ces mécanismes n’apportent cependant pas d’élément permettant d’identifier le signal déclencheur de la parturition chez la femme. S’agit-il d’un signal maternel, d’un signal fœtal, d’un signal placentaire, ou le dépassement d’un seuil critique de maturation déclenchant l’accouchement ? Pour des raisons éthiques évidentes, ces questions sont difficiles à aborder de façon expérimentale. Afin de comprendre le déterminisme de la parturition, nous avons entrepris de caractériser les changements d’expression associés à la préparation à l’accouchement à partir des membranes fœtales, un tissu gestationnel facilement disponible puisqu’il est expulsé avec le placenta et peut être obtenu avant les manifestations de l’accouchement à terme ou avant terme par césarienne. |
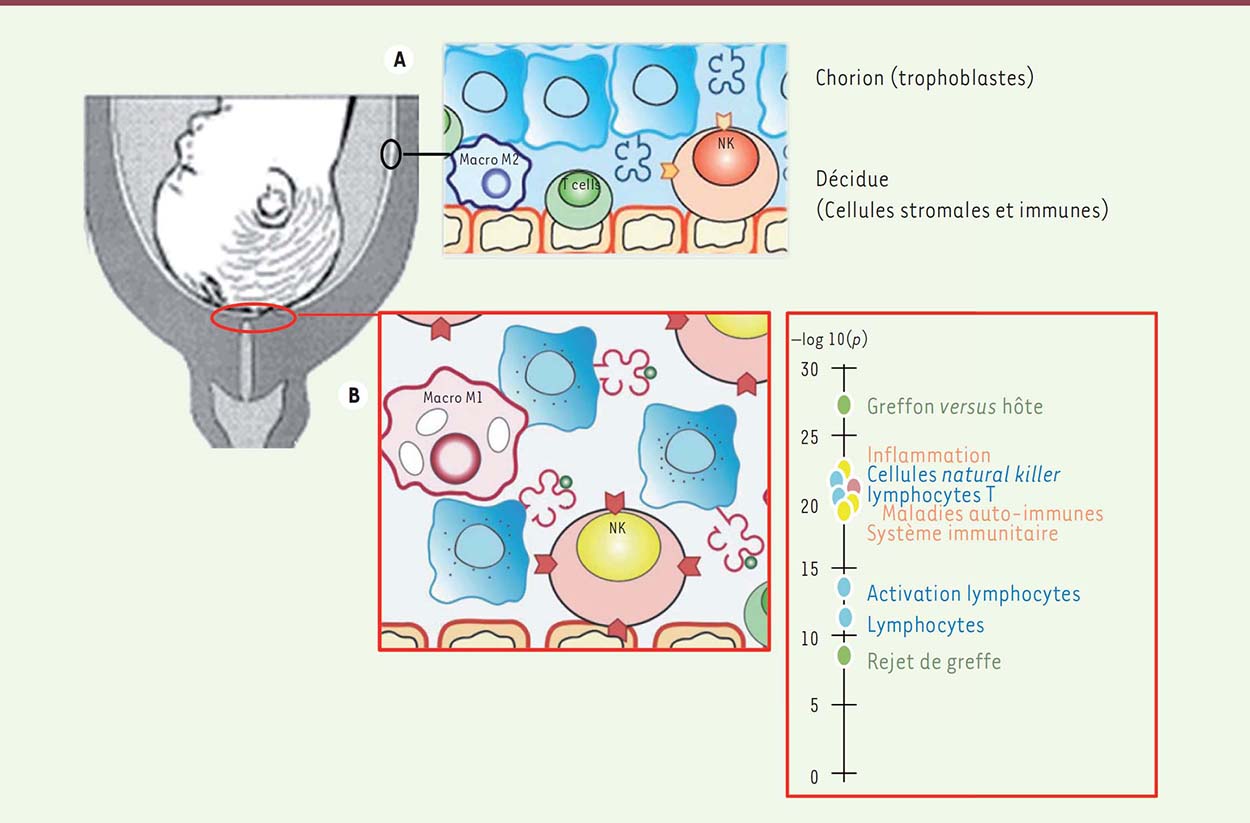
Activation des leucocytes maternels au niveau du futur site de rupture des membranes fœtales à terme Assez peu étudiées, les membranes fœtales (amnios et chorion) sont pourtant idéalement situées pour recevoir à la fois les signaux maternels et fœtaux et transmettre des signaux au myomètre et au col utérin. L’amnios a pour fonction d’assurer l’intégrité de la cavité amniotique et la résistance élastique des membranes. Le chorion est constitué des trophoblastes, apparentés aux trophoblastes du placenta, seules cellules fœtales en contact local direct avec les cellules maternelles. Le chorion et la décidue forment une interface fœto-maternelle, où se mêlent les trophoblastes et les cellules déciduales, constituées de cellules stromales endométriales « décidualisées » et de 40 % de leucocytes résidents, principalement des cellules natural killer (NK), des macrophages et des lymphocytes T régulateurs [8](➔) La fonction de ces leucocytes résidents est de réguler l’invasion trophoblastique, de participer à l’homéostasie tissulaire et d’orchestrer la tolérance materno-fœtale. (➔)Voir la Synthèse de P. Le Bouteiller et J. Tabiasco, m/s n° 8-9, août, . septembre 2006, page 745 Nous avons comparé le transcriptome de tissus isolés de la zone fragilisée des membranes fœtales située au-dessus du col utérin, avec celui de tissus situés dans une zone éloignée du col, chez des femmes enceintes ayant accouché par césarienne avant travail entre 28 et 33 SA, entre 34 et 35 SA et après 39 SA [9]. Les résultats ont été confrontés à une étude précédemment publiée décrivant le transcriptome des membranes fœtales au site de rupture après accouchement spontané par voie vaginale [10]. Nous avons mis en évidence une modification de transcrits dans la région au-dessus du col seulement au terme de la grossesse. L’analyse ontologique3, de ces données révèle : (1) qu’un enrichissement des gènes de l’inflammation aiguë peut être observé seulement après travail et accouchement; (2) que les gènes dérégulés, communs dans le chorion et la décidue, prélevés avant travail et après travail, sont ceux impliqués dans le remodelage de la matrice extracellulaire; et, enfin (3), que les gènes dérégulés dans la région au-dessus du col, à terme uniquement avant le travail, sont en relation avec l’immunité et le rejet de greffe. Ces changements transcriptomiques sont associés (1) à des changements phénotypiques des cellules NK, qui présentent de novo des marqueurs d’activation et (2) à une diminution importante des macrophages de type M24, au terme de la grossesse avant le début du travail (Figure 1). En parallèle, nous avons observé à la surface des trophoblastes une extinction de l’expression de HLA-F (human leucocyte antigen-F), une molécule du complexe majeur d’histocompatibilité (CMH) non-classique, et une augmentation de l’expression des molécules HLA-A, -B, -C classiques. Ces derniers résultats interpellent particulièrement dans la mesure où un des mécanismes, par lesquels la semi-allogreffe qu’est le fœtus échappe à la reconnaissance par le système immunitaire maternel et au rejet, est l’absence de présentation par le trophoblaste extra-placentaire de molécules du CMH très polymorphes comme HLA-A et HLA-B, remplacées par les molécules non classiques, HLA-G, HLA-E et HLA-F, très peu polymorphes.  | Figure 1. Activation lymphocytaire assimilable à un rejet de greffe au niveau du futur site de rupture des membranes au terme de la grossesse. Les trophoblastes du chorion, feuillet interne des membranes foetales qui tapissent l’utérus, interagissent directement avec les cellules de la décidue maternelle, cellules stromales et immunes tout au long de la grossesse (A). À terme, avant travail, le transcriptome de cette interface fœtomaternelle au dessus du col utérin présente une signature ontologique de rejet de greffe et d’activation lymphocytaire, corrélée à une activation des cellules natural killer (NK) et la disparition de macrophages de type M2 immuno-tolérants (B). |
|
À l’inverse des rongeurs et des ruminants, l’existence d’un signal fœtal ou placentaire et son lien avec l’activation d’événements pro-inflammatoires à l’origine de la parturition restent à établir dans l’espèce humaine. Le bon déroulement de la grossesse repose, en partie, sur un verrou immunologique qui assure une tolérance materno-fœtale pendant la grossesse. Nos résultats sont en faveur d’une levée de ce verrou à terme, précédant la réaction inflammatoire, qui pourrait se traduire par un rejet des trophoblastes à l’interface fœto-maternelle et à la parturition. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Blondel B, Coulm B, Bonnet C, et al. . Trends in perinatal health in metropolitan France from 1995 to 2016: results from the French national perinatal surveys . J Gynecol Obstet Hum Reprod. 2016;; 46 : :701.-13. 2. Arikat S, Novince RW, Mercer BM, et al. . Separation of amnion from choriodecidua is an integral event to the rupture of normal term fetal membranes and constitutes a significant component of the work required . Am J Obstet Gynecol. 2006;; 194 : :211.-7. 3. Malak TM, Bell SC. Structural characteristics of term human fetal membranes: a novel zone of extreme morphological alteration within the rupture site. Br J Obstet Gynaecol. 1994;; 101 : :375.-86. 4. Csapo A. Progesterone block . Am J Anat. 1956;; 98 : :273.-91. 5. Liggins GC. Premature parturition after infusion of corticotrophin or cortisol into foetal lambs. J Endocrinol. 1968;; 42 : :323.-9. 6. Renthal NE, Williams KC, Mendelson CR. MicroRNAs--mediators of myometrial contractility during pregnancy and labour. Nat Rev Endocrinol. 2013;; 9 : :391.-401. 7. Menon R, Bonney EA, Condon J, Mesiano S, Taylor RN. Novel concepts on pregnancy clocks and alarms: redundancy and synergy in human parturition. Hum Reprod Update. 2016;; 22 : :535.-60. 8. Le Bouteiller P, Tabiasco J. Immunologie de la grossesse : faits nouveaux . Med Sci (Paris). 2006;; 22 : :745.-50. 9. Marcellin L, Schmitz T, Messaoudene M, et al. . Immune modifications in fetal membranes overlying the cervix precede parturition in humans . J Immunol. 2017;; 198 : :1345.-56. 10. Nhan-Chang CL, Romero R, Tarca AL, et al. . Characterization of the transcriptome of chorioamniotic membranes at the site of rupture in spontaneous labor at term . Am J Obstet Gynecol. 2010;; 202 : :462 e1.-41. |