| |
| Med Sci (Paris). 34(5): 391–394. doi: 10.1051/medsci/20183405007.Carcinome hépatocellulaire après éradication du virus de l’hépatite C par les antiviraux à action directe Prochains défis Nourdine Hamdane,1,2 Thomas F. Baumert,1,2,3 and Mirjam B. Zeisel4* 1Inserm U1110, institut de recherche sur les maladies virales et hépatiques, 3, rue Koeberlé, 67000Strasbourg, France 2Université de Strasbourg, 67000Strasbourg, France 3Institut hospitalo-universitaire, pôle hépato-digestif, nouvel hôpital civil, 67000Strasbourg, France 4Inserm U1052, CNRS UMR 5286, centre de recherche sur le cancer de Lyon (CRCL), université de Lyon (UCBL), 151, cours Albert Thomas, 69424Lyon, France MeSH keywords: Antiviraux, Carcinome hépatocellulaire, Hepacivirus, Hépatite C chronique, Humains, Incidence, Tumeurs du foie, Facteurs de risque, usage thérapeutique, épidémiologie, étiologie, effets des médicaments et substances chimiques, complications, traitement médicamenteux |
L’hépatite C et le carcinome hépatocellulaire à l’ère des antiviraux à action directe L’infection chronique par le virus de l’hépatite C (VHC) est une des principales causes de maladies hépatiques chroniques (comme l’hépatite et la cirrhose) et de carcinome hépatocellulaire (CHC) dans le monde [1, 2]. Le CHC est le second cancer en terme de taux de mortalité et, contrairement à d’autres types de cancer, son incidence continue à progresser [2]. Des traitements à base d’interféron alpha (IFN-α) permettaient auparavant de guérir environ 50 % des patients atteints d’hépatite C chronique. Les nouveaux traitements antiviraux (les antiviraux à action directe [AAD]) rendent actuellement possible la guérison (obtention d’une réponse virologique soutenue [RVS]) de la grande majorité des patients [3] (→). (→) Voir la Nouvelle de L. Mailly et al., m/s n° 12, décembre 2015, page 1075 Cette révolution dans la prise en charge des patients atteints d’hépatite C chronique avait nourri l’espoir de voir disparaître les CHC conséquents à l’infection par le VHC. Cependant, les résultats du suivi de différentes cohortes de patients ont révélé que bien que les AAD permettent de diminuer le risque de développer un CHC, ils ne l’éliminent pas [4]. C’est en particulier le cas pour les patients atteints de cirrhose ou présentant d’autres facteurs de risque (comme par exemple l’âge, la consommation d’alcool, la présence d’un diabète ou le surpoids) [5-9]. Le CHC représente toujours un problème de santé publique. Il n’y a en effet, à ce jour, pas d’option thérapeutique pour ralentir la progression d’une cirrhose vers un CHC, et les stratégies curatives du CHC restent limitées [10]. Différentes observations très récentes rapportent un nombre important et inattendu de survenue (3,16 % [11]) et de récurrence (environ 28 % [10, 12]) de CHC chez des patients ayant atteint une RVS à la suite d’un traitement par AAD, en comparaison avec son occurrence après traitements par l’IFN. D’autres travaux, dont une étude française, indiquent cependant que le traitement avec AAD n’augmenterait pas la récurrence du CHC au sein de patients de cohortes ANRS (France recherche Nord & Sud Sida-hiv Hépatites) [13]. Ces résultats contradictoires ont conduit à s’interroger sur les bénéfices des AAD. |
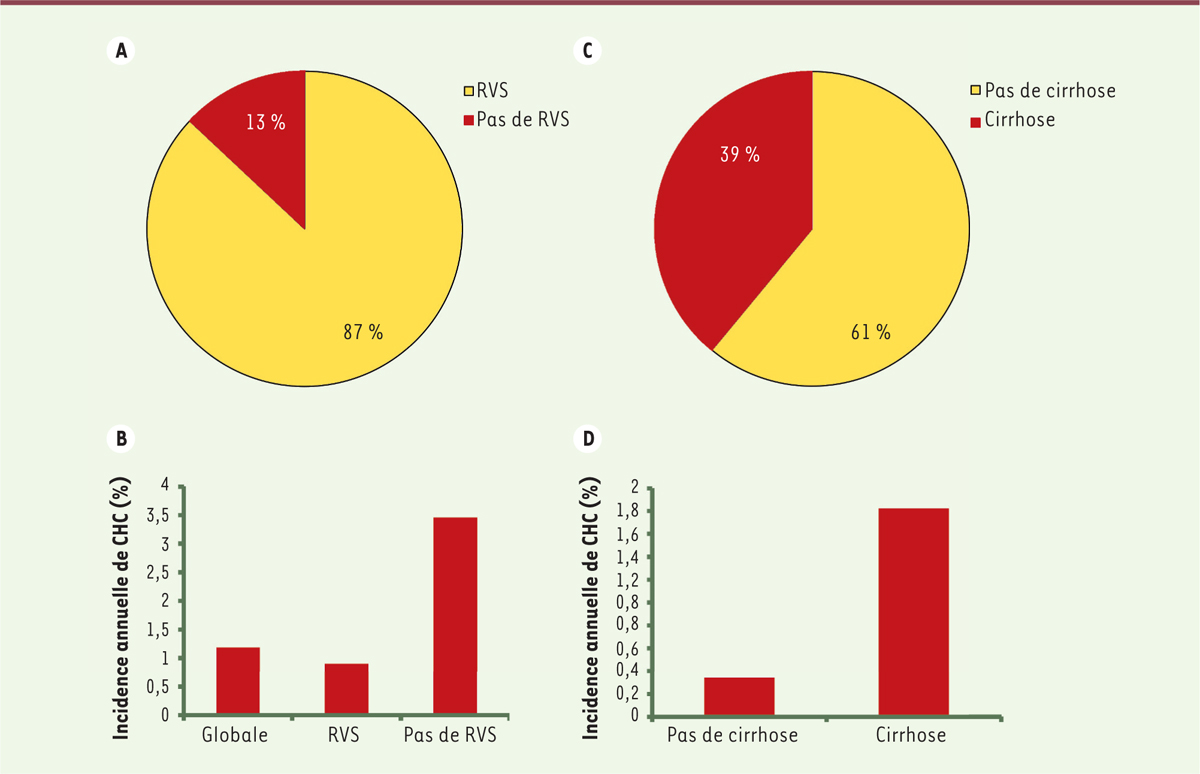
Éradication du VHC par les AAD et risque de CHC Kanwal et al. [14] ont fait progresser cette question en menant une étude rétrospective sur un très grand nombre de patients. Ils ont en effet analysé les dossiers médicaux de 22 579 anciens soldats américains (en fait 22 500, 79 ayant développé un CHC durant la période de traitement ont été exclus de l’étude), qui avaient bénéficié d’un traitement par AAD contre l’hépatite C au cours de l’année 2015, et la survenue de CHC a été évaluée à l’issue du traitement [14]. Parmi ces patients, 87 % avaient développé une RVS (Figure 1A).
 | Figure 1.
Un traitement par antiviraux à action directe réduit l’incidence de carcinome hépatocellulaire chez les patients atteints d’hépatite C chronique. A. Parmi les 22 500 patients atteints d’hépatite C chronique de la cohorte analysée par Kanwal et al. [ 4], 87 % (19 518 patients) ont atteint une réponse virologique soutenue (RVS) suite à un traitement par antiviraux à action directe (AAD). B. Dans cette cohorte, l’incidence annuelle globale de carcinome hépatocellulaire (CHC) était de 1,18 % (271 patients) alors qu’elle n’était que de 0,9 % chez les patients ayant atteint une RVS (183 patients). Le risque de CHC était le plus élevé chez les patients n’ayant pas atteint une RVS avec une incidence annuelle de 3,45 % (88 patients). C..Le pourcentage de patients atteints de cirrhose était de 39 % dans cette cohorte. D. Parmi les patients ayant atteint une RVS, l’incidence annuelle de CHC était plus forte chez les patients cirrhotiques (1,82 %) que chez les patients non cirrhotiques (0,34 %). |
Si l’incidence annuelle globale de survenue de CHC était estimée à 1,18 %, l’incidence annuelle chez les patients examinés dans cette étude et ayant atteint une RVS n’était que de 0,90 %, à comparer à l’incidence annuelle en absence de RVS qui était de 3,45 % (Figure 1B). Ces résultats montrent que le traitement par AAD a significativement réduit l’incidence de CHC au sein des patients avec RVS. Cette réduction globale a été évaluée à 76 % [14]. |
Facteurs de risque de CHC chez les patients atteints d’hépatite C chronique Kanwal et al. [14] ont ensuite analysé les facteurs pouvant augmenter le risque de CHC après RVS. Ils ont montré que parmi les patients ayant atteint une RVS, ceux développant une cirrhose avaient l’incidence annuelle la plus élevée (de 1,82 % pour les patients cirrhotiques et de 0,34 % pour les non cirrhotiques) et que leur risque de développer un CHC était multiplié par 4,7 (Figure 1C–D). Ces résultats sont en accord avec ceux obtenus dans des études précédentes qui avaient porté sur l’évaluation du risque de CHC chez des patients ayant atteint une RVS après un traitement par l’IFN [7, 15]. La consommation d’alcool avait été également associée à un risque plus élevé de développer un CHC (avec une incidence annuelle de 1,01 % chez les patients consommant de l’alcool contre 0,72 % chez ceux n’en consommant pas). Ces études relataient également que les patients afro-américains avaient moins de risque de développer un CHC que les patients blancs ou hispaniques. Ces résultats indiquent donc que le risque global de développer un CHC, après avoir atteint une RVS par un traitement par AAD, est assez faible, sauf chez les patients souffrant de fibrose avancée ou de cirrhose. Il convient cependant de souligner que le risque de développer un CHC est plus faible chez les patients cirrhotiques ayant atteint une RVS que chez les patients cirrhotiques n’ayant pas atteint une RVS indiquant un bénéfice global du traitement par AAD sur la survenue de CHC. Certaines études avaient rapporté un potentiel risque accru de récurrence de CHC au cours des premiers mois après un traitement par AAD. Kanwal et al. [14] ont donc comparé les données des patients qui avaient développé un CHC au cours du traitement par AAD (correspondant aux patients qui avaient été exclus de la première analyse) et celles des patients qui ont développé un CHC plus tardivement, au cours de la période de suivi. Ils n’ont pas pu identifier de facteur discriminant ces deux populations de patients, ni observer de différence dans la taille ou le stade du CHC chez les patients ayant développé un CHC pendant ou après le traitement par AAD. |
Conclusions et perspectives L’ensemble des résultats de cette étude portant sur la plus grande cohorte de patients traités par AAD analysée à ce jour indique donc que les traitements par AAD réduisent de manière significative l’incidence de CHC [14]. Comment expliquer alors les observations non-concordantes émanant de différents centres ? Comme l’ont évoquée Kanwal et al. [14], une raison pourrait être le changement du profil des patients atteints d’hépatite C chronique actuellement traités par AAD en comparaison de ceux traités précédemment par l’IFN. En effet, aujourd’hui, des patients qui présentent des facteurs de risque de CHC supplémentaires à l’hépatite C (comme une cirrhose, les consommateurs d’alcool et ceux d’un âge avancé) et qui n’avaient pas été traités/ou pas répondu au traitement par l’IFN peuvent bénéficier d’un traitement par AAD. Cette différence de caractéristiques des patients traités ne permet donc pas de comparer directement le risque de CHC après RVS chez les patients qui avaient été traités par l’IFN et chez ceux bénéficiant actuellement des AAD. Des études à plus long terme sont requises pour conclure quant aux bénéfices des AAD pour prévenir la survenue de CHC, et ainsi estimer le risque de développer un CHC après éradication du VHC au cours du temps. À ce titre les cohortes ANRS permettront d’apporter de précieuses informations au cours des prochaines années. Malgré le remarquable progrès que constitue le développement des AAD, des recherches restent nécessaires pour résoudre le problème du risque persistant de développer un CHC après l’éradication du VHC par ces antiviraux. Les progrès récents de la génétique pourraient apporter des réponses quant au développement de biomarqueurs pour identifier les patients les plus à risques de développer un CHC après RVS. Ils sont également susceptibles d’ouvrir la voie pour de nouvelles perspectives thérapeutiques dirigées contre les acteurs génétiques favorisant la carcinogenèse hépatique [4]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs tiennent à remercier le Pr P. Nahon et le Pr F. Carrat pour les informations concernant les cohortes ANRS.
|
1.
Chung RT, Baumert TF. Curing chronic hepatitis C: the arc of a medical triumph . N Engl J Med. 2014; ; 370 : :1576.–1578. 2.
El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma . Gastroenterology. 2012; ; 142 : :1264.–1273.e1. 3.
Mailly L, Zeisel MB, Baumert TF. Enfermé dehors ! Traitement de l’hépatite C chronique par un inhibiteur d’entrée . Med Sci (Paris). 2015; ; 31 : :1075.–1077. 4.
Baumert TF, Juhling F, Ono A, Hoshida Y. Hepatitis C-related hepatocellular carcinoma in the era of new generation antivirals . BMC Med. 2017; ; 15 : :52.. 5.
El-Serag HB. Hepatocellular carcinoma . N Engl J Med. 2011; ; 365 : :1118.–1127. 6.
Hoshida Y, Fuchs BC, Bardeesy N, et al. Pathogenesis and prevention of hepatitis C virus-induced hepatocellular carcinoma . J Hepatol. 2014; ; 61 : :S79.–S90. 7.
El-Serag HB, Kanwal F, Richardson P, Kramer J. Risk of hepatocellular carcinoma after sustained virological response in veterans with hepatitis C virus infection . Hepatology. 2016; ; 64 : :130.–137. 8.
Toyoda H, Kumada T, Tada T. Changes in patient backgrounds may increase the incidence of HCC after SVR in the era of IFN-free therapy for HCV . Hepatology. 2016; ; 64 : :1818.–1819. 9.
van der Meer AJ, Veldt BJ, Feld JJ, et al. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis . JAMA. 2012; ; 308 : :2584.–2593. 10.
European association for the study of the liver; European organisation for research and treatment of cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma . J Hepatol 2012. ; 56 : :908.–43. 11.
Conti F, Buonfiglioli F, Scuteri A, et al. Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals . J Hepatol. 2016; ; 65 : :727.–733. 12.
Reig M, Marino Z, Perello C, et al. Unexpected high rate of early tumor recurrence in patients with HCV-related HCC undergoing interferon-free therapy . J Hepatol. 2016; ; 65 : :719.–726. 13.
ANRS collaborative study group on hepatocellular carcinoma (ANRS CO22 HEPATHER, CO12 CirVir and CO23 CUPILT cohorts) . Lack of evidence of an effect of direct-acting antivirals on the recurrence of hepatocellular carcinoma: Data from three ANRS cohorts . J Hepatol. 2016; ; 65 : :734.–740. 14.
Kanwal F, Kramer J, Asch SM, et al. Risk of hepatocellular cancer in HCV patients treated with direct-acting antiviral agents . Gastroenterology. 2017; ; 153 : :996.–1005.e1. 15.
van der Meer AJ, Feld JJ, Hofer H, et al. Risk of cirrhosis-related complications in patients with advanced fibrosis following hepatitis C virus eradication . J Hepatol. 2017; ; 66 : :485.–493. |