| |
| Med Sci (Paris). 34(5): 432–438. doi: 10.1051/medsci/20183405016.Interactions neuro-immunes dans la peau Un lien entre douleur et immunité Guilhaume Debroas,1* Guillaume Hoeffel,1* Ana Reynders,2 and Sophie Ugolini1a 1Aix-Marseille-université, CNRS, Inserm, centre d’immunologie de Marseille-Luminy (CIML), 13288Marseille, France 2Aix-Marseille-université, CNRS, institut de biologie du développement de Marseille, UMR 7288, Case 907, 13288Marseille, France |
Dès le premier siècle, une des célèbres Satires du poète Juvénal (Decimus Junius Juvenalis) évoquait « mens sana in corpore sano »1, suggérant intuitivement l’existence d’une réciprocité entre l’état de santé général et l’état de santé mentale. Parallèlement, Celsus (Aulus Cornelius Celsus), décrivant les signes cardinaux qui définissent l’inflammation - rougeur, chaleur et gonflement [1] -, y associait la douleur, résultat direct de la perception de l’inflammation par le système nerveux. Avec la description des cellules capables de neutraliser des pathogènes, Ilia Ilitch Metchnikoff (1845-1916) posait les fondements de l’immunologie moderne [2]. Depuis, de nombreuses observations médicales suggèrent qu’une phase de dépression peut s’exprimer physiquement par un défaut d’immunité, et réciproquement, qu’un dérèglement inflammatoire peut être associé à des troubles psychologiques [3, 4]. Cependant, les mécanismes qui sous-tendent les interactions fonctionnelles entre le système nerveux et le système immunitaire dans des conditions physiologiques et pathologiques restent encore mal compris. Le système nerveux central (SNC) reçoit et intègre continuellement des informations transmises depuis les différents organes via le système nerveux périphérique (SNP). Il est constitué de deux structures principales, le cerveau et la moelle épinière. Le SNP est lui composé de ganglions et de nerfs qui assurent la transmission d’informations entre les tissus et le SNC. Grâce à ce réseau, les informations transitent de la périphérie vers le SNC et réciproquement, permettant au cerveau de percevoir l’état général de l’organisme, son environnement, et d’orchestrer les fonctions effectrices des tissus. Le SNP est divisé en deux parties, le SN autonome qui a un rôle majeur dans le maintien de l’homéostasie via les neurones sympathiques et parasympathiques, d’actions antagonistes [5], et le système nerveux somato-sensoriel qui détecte et répond à des stimulations provenant de l’environnement. Jusqu’à une époque relativement récente, les immunologistes voyaient le système immunitaire comme un système autonome, activé essentiellement par ses interactions avec des pathogènes et/ou des cellules infectées ou « stressées ». Cette vision est en train d’évoluer et un rôle important du système nerveux dans le contrôle de la réponse immune émerge. Tout comme le système immunitaire, le SNP détecte, intègre et répond aux stimulus externes et aux signaux de dangers [6]. Ces deux systèmes sont stratégiquement situés à l’interface avec le monde extérieur, au niveau des tissus « barrières » tels que la peau, les poumons et les intestins [7]. Cette superposition fonctionnelle et anatomique soulève la question de leur potentielle coopération dans la mise en place des défenses de l’organisme. Ce domaine de recherche est en pleine émergence et des études récentes suggèrent l’existence d’un système neuro-immun intégré assurant le maintien de l’homéostasie et la survie de l’organisme. Nous verrons dans cette revue comment système immunitaire et système nerveux s’organisent et interagissent au niveau de la peau. |
Organisation anatomique de la peau La peau est constituée de trois compartiments principaux : l’épiderme, le derme et l’hypoderme. L’épiderme, en contact direct avec le milieu extérieur, se compose de couches stratifiées de kératinocytes qui forment un tissu imperméable et difficilement franchissable pour les micro-organismes pathogènes [8]. Le derme est une structure riche en collagène produit par les fibroblastes qui soutiennent les glandes sudoripares et sébacées en charge des échanges gazeux et aqueux avec le milieu extérieur [9]. Il constitue une barrière mécanique élastique irriguée par des vaisseaux sanguins et lymphatiques. Il abrite également la base des systèmes glandulaires et pileux de la peau. Au-dessous, à la jonction entre les couches supérieures de la peau et les tissus plus profonds tels que les tissus musculaires, se situe l’hypoderme, tissu conjonctif lâche, plus ou moins adipeux et richement vascularisé. Sa composition offre une protection contre les chocs osmotiques, physiques et les variations de température. La peau est un organe sensoriel majeur richement innervé par différents types de terminaisons et structures nerveuses issues des systèmes nerveux périphériques somato-sensoriel et autonome. Les fibres nerveuses du système autonome régulent la fonction des glandes sudoripares, la vasomotricité, le flux sanguin et la thermorégulation. Les nerfs sensoriels sont responsables de la sensibilité mécanique, thermique et douloureuse (ou nociception). La peau héberge également un grand nombre de cellules immunitaires, véritables sentinelles prêtes à s’activer à la suite d’une lésion ou une infection. |
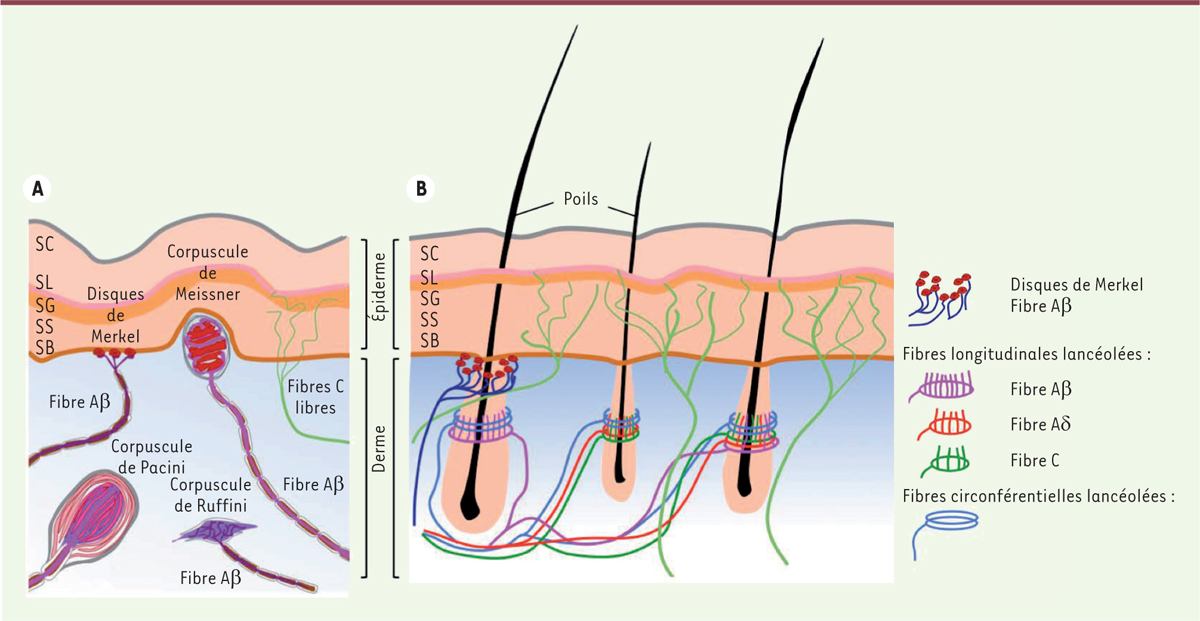
Le système nerveux sensoriel de la peau La densité et la diversité des nerfs sensoriels (NS) spécialisés dans la détection de stimulus externes comme des pressions mécaniques, des variations thermiques, l’acidité (pH) ou l’humidité, fait de la peau le plus grand organe sensoriel du corps [10, 11]. Certains de ces stimulus peuvent être considérés comme « toxiques » et conduisent aux sensations de démangeaison et de douleur, dont la perception est transmise par une classe particulière de NS appelés neurones nociceptifs [12]. Les corps cellulaires des NS sont situés au niveau des ganglions de la racine dorsale et leurs prolongements axonaux bipolaires connectent les tissus périphériques à la moelle épinière. Les NS se distinguent par une très grande hétérogénéité à la fois électrophysiologique, anatomique et moléculaire. D’un point de vue électrophysiologique, ils sont classés selon le degré de myélinisation axonale (maintenue par les cellules de Schwann) qui détermine la vitesse de conduction du potentiel d’action et la taille de la fibre nerveuse. Les fibres nerveuses peuvent ainsi être divisées en trois catégories : Aβ, Aδ et C. Les fibres Aβ sont fortement myélinisées, de gros diamètre et à grande vitesse de conduction ; les fibres Aδ sont faiblement myélinisées, de diamètre moyen et à vitesse intermédiaire de conduction ; les fibres C sont dépourvues de myéline, de petit diamètre et conduisent lentement le potentiel d’action. Au niveau de la peau, ces fibres innervent différentes structures anatomiques [10, 13] (Figure 1A). La grande majorité des fibres Aβ et Aδ intervient dans la détection des stimulations sensorielles non nocives (toucher, vibrations, températures, etc.) et innerve la peau glabre et la peau poilue au niveau du derme. Dans la peau glabre, ces fibres intègrent des structures sensorielles spécialisées : les corpuscules de Meissner proches de l’épiderme (qui détectent le toucher léger), les corpuscules de Ruffini (qui détectent pression et étirement de la peau) situés plus profondément dans le derme, et enfin les corpuscules de Pacini qui détectent les pressions et vibrations. Dans la peau poilue, des fibres Aβ, Aδ et une classe particulière de fibres C intervenant dans la détection de stimulations mécaniques à bas seuil, enlacent les follicules pileux suivant des structures en barils [10] (Figure 1B).
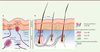 | Figure 1.
Organisation anatomique du système nerveux sensoriel cutané. Dans la peau glabre (A) : les fibres C libres innervent l’épiderme ; les fibres Aβ forment des structures spécialisées dans la détection du toucher : les corpuscules de Meissner proches de l’épiderme, les corpuscules de Ruffini et les corpuscules de Pacini, situés plus profondément dans le derme. Dans la peau poilue (B), les terminaisons nerveuses des fibres Aβ, Aδ et C enlacent les follicules pileux suivant des structures en barils. Seuls les disques de Merkel et les fibres nerveuses libres sont communs aux deux types de peau. SB :
stratum basalis ; SS : stratum spinosum ; SG : stratum granulosum ; SL : stratum lucidum ; SC : stratum corneosum (adapté de [ 10, 13]). |
Les fibres C, qui sont les plus abondantes, innervent essentiellement l’épiderme sous forme de terminaisons nerveuses dites « libres » (free nerve endings). Ces fibres sont divisées en deux grandes catégories : les fibres peptidergiques, exprimant le récepteur du NGF (nerve growth factor), TrkA (tropomyosin receptor kinase A), et produisant des neuropeptides (CGRP [calcitonin gene-related peptide], SP [substance P]), et les fibres non-peptidergiques, qui expriment Ret, le récepteur du GDNF (glial cell-derived neurotrophic factor), et ne secrètent pas de neuropeptides. Elles sont spécialisées, pour la plupart, dans la détection et la transmission de l’information sensorielle nociceptive induite, par exemple, par des lésions tissulaires, des irritants chimiques, des signaux pruritogènes, des stimulus inflammatoires, mécaniques ou thermiques [14]. Afin de répondre à une telle variété de stimulations, les fibres C nociceptives sont équipées de protéines membranaires capables de s’activer à la suite d’une stimulation nocive donnée. L’activation de ces « senseurs » membranaires entraîne une dépolarisation de la terminaison nerveuse (généralement due à un influx de calcium) qui va contribuer à la genèse de potentiels d’action, constituant ainsi la base de l’encodage de l’information sensorielle. La nature et la distribution de ces « senseurs » membranaires sur les terminaisons des fibres C nociceptives est à l’origine de leur immense hétérogénéité moléculaire. Certains sont présents uniquement sur un type de fibre donné, leur conférant ainsi une spécialisation fonctionnelle. Par exemple, la détection des stimulations thermiques nocives (lorsque la température tissulaire dépasse 43 °C) repose sur l’activation du canal TRPV1 (transient receptor potential vanilloid 1) présent sur les terminaisons cutanées des fibres C peptidergiques [15]. Lorsque la température cutanée avoisine 15 °C (perçue comme un signal douloureux), c’est le canal TRPM8 (transient receptor potential cation channel subfamily M member 8), exprimé par une petite sous-population de fibres C non-peptidergiques, qui s’active [16]. Cependant, dans d’autres contextes sensoriels, comme la détection des produits libérés à la suite d’une lésion cutanée ou une inflammation (acides, ATP, histamine, prostaglandines, etc.), les « senseurs » membranaires associés (respectivement de la famille des ASIC [acid-sensing ion channel], des récepteurs purinergiques, des récepteurs histaminiques, des récepteurs des prostaglandines, etc.) peuvent être présents à la fois sur des fibres C peptidergiques et non-peptidergiques [17]. Les mécanismes d’intégration de signaux multiples par chacun des différents types de NS, et qui définissent les perceptions sensorielles restent encore très complexes. Cette complexité est cependant de mieux en mieux appréhendée grâce aux analyses transcriptomiques en cellule unique apportant une cartographie très précise de l’expression combinatoire de gènes permettant la spécialisation fonctionnelle des sous-types de neurones [18, 19]. |
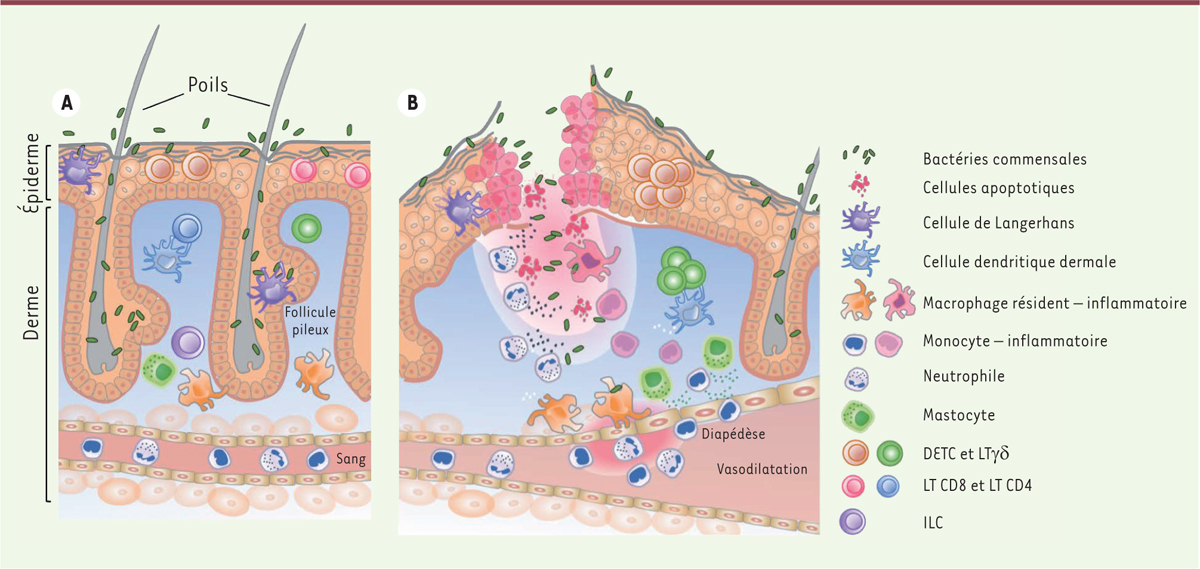
Le système immunitaire de la peau Au niveau de l’épiderme, plusieurs types de cellules immunitaires sont en étroit contact avec les kératinocytes [20]. On y trouve des phagocytes mononucléés de la famille des cellules dendritiques (DC) appelés cellules de Langerhans, des lymphocytes T CD8 résidents mémoires, et une sous-population de lymphocytes Tγδ, les DETC (dendritic epithelial T cells) (Figure 2A) [21] présents chez la souris mais absents chez l’homme.
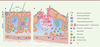 | Figure 2.
Le système immunitaire cutané. A. La peau est constituée d’une couche externe, l’épiderme et d’une couche interne, le derme. L’épiderme se compose de couches stratifiées de kératinocytes et contient des cellules de Langerhans, des lymphocytes Tγδ (LTγδ), des cellules dendritiques de l’épiderme (DETC) et des lymphocytes T (LT) CD8 mémoires. Le derme est un tissu conjonctif dans lequel résident des macrophages, des mastocytes, des LT CD4, des LTγδ du derme et des cellules lymphoïdes innées (ILC). B. À la suite d’une lésion cutanée, les macrophages périvasculaires et les mastocytes détectent les tissus lésés et favorisent la diapédèse des neutrophiles et des monocytes circulants vers les tissus endommagés. Les cellules dendritiques et les cellules de Langerhans migrent vers les organes lymphoïdes secondaires pour activer les LT naïfs. Parallèlement, les monocytes se différencient en macrophages inflammatoires ou en cellules dendritiques pour, respectivement, phagocyter les bactéries et débris apoptotiques, et activer les LT. Cette séquence d’évènements permettra d’éliminer les bactéries contaminantes puis d’induire la prolifération des kératinocytes et des fibroblastes pour générer un tissu cicatriciel (adapté de [ 22]). |
À l’état basal, les principales cellules immunitaires du derme sont des macrophages, des mastocytes, des DC et des lymphocytes T [22]. Les DC du derme peuvent être divisées en deux principales catégories, les DC classiques de type 1 (cDC1), spécialisées dans la présentation croisée des antigènes exogènes et l’activation des réponses lymphocytaires T CD8 [23], et les DC classiques de type 2 (cDC2) [24], dont le rôle est de polariser les lymphocytes T CD4 selon les types d’antigènes rencontrés. Les macrophages résidents du derme, issus de progéniteurs embryonnaires, sont capables de s’auto-renouveler tout au long de la vie [25, 26]. Ils peuvent également dériver de monocytes circulants infiltrant le derme en cas d’inflammation [27]. Grâce à leur plasticité fonctionnelle remarquable, leur champ d’action est très large [28]. En effet, en fonction des stimulus, ils peuvent devenir pro-inflammatoires, suite à la détection de pathogènes bactériens, et produire des cytokines telles que l’IL(interleukine)1-β, l’IL-6 et le TNF-α (tumor necrosis factor-alpha), ou présenter un profil inflammatoire « alternatif » favorisant les réponses de type 2 (Th2) antiparasitaires et impliquées dans la réparation tissulaire et l’angiogenèse. Ils produisent alors des facteurs de croissance tels que le VEGF (vascular endothelial growth factor), ou profibrotiques comme le TGF-β (transforming growth factor beta) [29]. Les mastocytes sont, eux, riches en granules et sont impliqués dans le remodelage tissulaire et la perméabilité vasculaire, favorisant l’infiltration d’autres leucocytes en cas d’inflammation [30]. Plusieurs cellules lymphoïdes se retrouvent également dans le derme. Parmi elles, les lymphocytes Tγδ participent à la réparation des tissus et jouent un rôle important dans la surveillance tumorale via l’expression du récepteur NKG2D (natural killer group 2D) et la production d’IFNγ (interféron gamma) et d’IL-17 [31]. Les lymphocytes T CD8 mémoires sont prêts à déclencher une réponse cytotoxique contre des cellules infectées ou cancéreuses. Nouvellement identifiées, des cellules lymphoïdes innées (innate lymphoid cells, ILC) sont également présentes dans le derme à l’état basal et en conditions inflammatoires [32]. Elles sont classées en trois groupes.
-
Les ILC de type 1 (ILC1) qui comprennent les cellules NK (natural killer) [33] et les ILC1 résidentes des tissus qui ont un rôle encore mal défini dans la peau.
-
Les ILC de type 2 (ILC2) ont, à l’état basal, un rôle immunorégulateur par leur production d’IL-13 qui modère l’activité des mastocytes. Une fois stimulées, elles peuvent néanmoins devenir pro-inflammatoires et favoriser l’afflux d’éosinophiles et l’activation des mastocytes [34]. Elles pourraient jouer un rôle dans la pathogenèse des dermatites atopiques (eczéma) [35].
-
Les ILC de type 3 (ILC3) ont été retrouvées en plus grand nombre dans la peau de patients atteints de psoriasis. Leur production d’IL-17 et d’IL-22 pourrait jouer un rôle dans l’inflammation et l’immunité de la peau [36, 56] (→).
(→) Voir la Synthèse de A. Crinier et al., m/s n° 5, mai 2017, page 534 Lorsque la peau est lésée, le microbiote cutané et les débris cellulaires produits activent les kératinocytes et les cellules myéloïdes résidentes, comme les cellules de Langerhans (LC), les DC et les macrophages du derme, qui sécrètent alors des chimiokines et des cytokines (CCL2 [C-C motif chemokine ligand 2] et CXCL1 [C-X-C motif chemokine ligand 1], IL1-β, TNFα, etc.) initiant ainsi le processus inflammatoire et attirant les premières cellules immunitaires infiltrantes (Figure 2B) [37]. Les polynucléaires neutrophiles sont les premiers effecteurs recrutés massivement dans la peau. Ils limitent la propagation d’éventuels agents infectieux en phagocytant les débris cellulaires et les bactéries, en produisant des radicaux libres, et en libérant leur chromatine par le phénomène de « NETosis »2 [38]. Des monocytes sont également recrutés au site inflammatoire où ils se différencient en macrophages capables de phagocytose, ou en DC inflammatoires qui amplifient l’activité des lymphocytes T effecteurs [39]. Ce processus permet également de reconstituer le compartiment des DC en migration. En effet, les DC et les cellules de Langerhans résidentes activées par l’inflammation migrent vers les ganglions lymphatiques drainants afin de présenter les antigènes aux lymphocytes T naïfs et déclencher une réponse adaptative effectrice [40]. Une fois les pathogènes neutralisés, le phénomène inflammatoire est modulé négativement, favorisant la réparation tissulaire. Les cellules infiltrantes, à demi-vie courte, vont disparaître, et les macrophages et les lymphocytes T régulateurs vont produire des molécules anti-inflammatoires comme le TGF-β et l’IL-10 permettant le retour à l’état homéostatique initial. |
Système nerveux nociceptif et immunité de la peau Régulation de l’inflammation et de l’immunité Les neurones nociceptifs (ou nocicepteurs) expriment des récepteurs et des canaux ioniques qui détectent des médiateurs libérés au cours de l’inflammation. Le système immunitaire et le système nerveux s’activent donc simultanément lorsque des lésions ou des infections cutanées surviennent. De récentes études montrent que les nocicepteurs participent de façon active aux réponses immunitaires anti-infectieuses [ 41] (Figure 3).
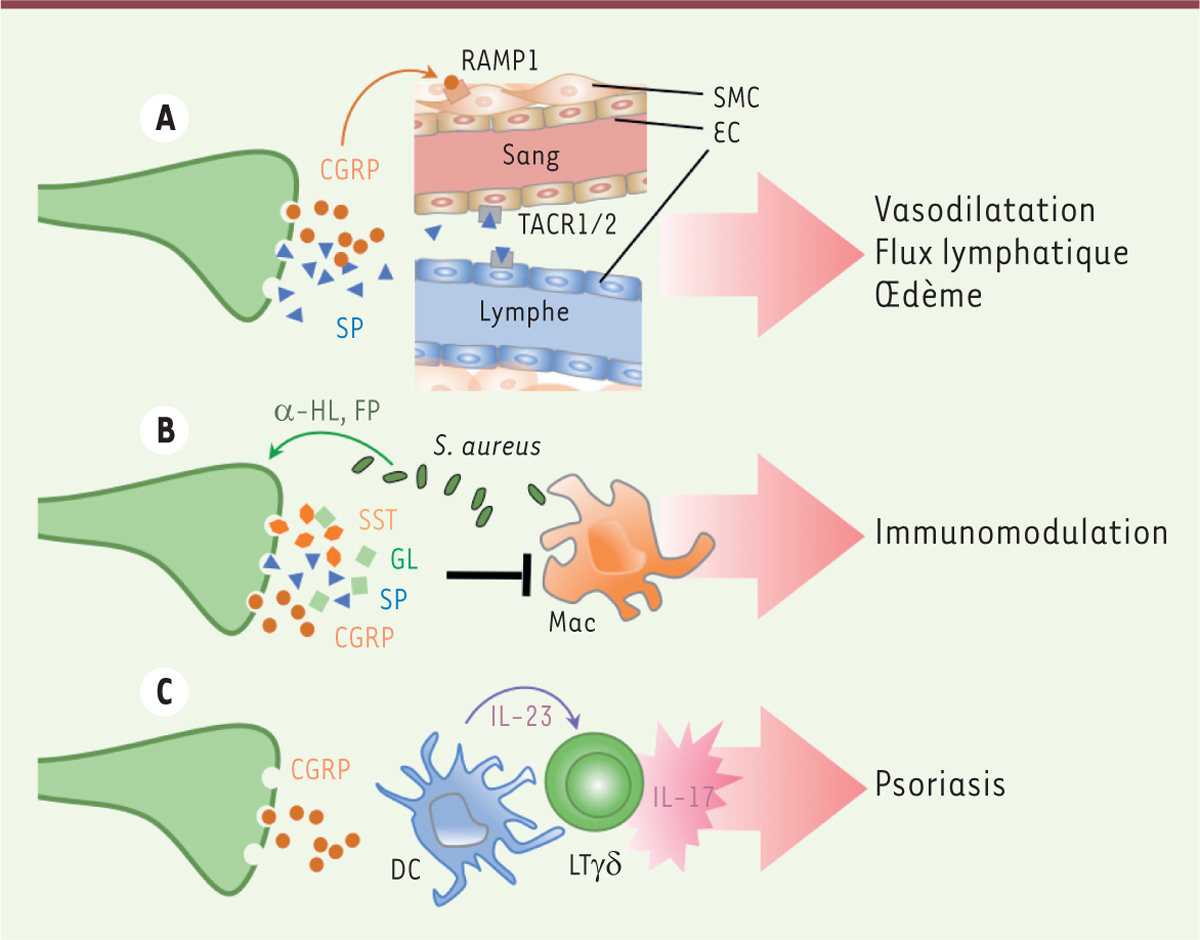
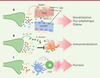 | Figure 3.
Régulation du système immunitaire par le système nerveux sensoriel. A. Le CGRP ( calcitonin gene-related peptide) et la substance P (SP) induisent vasodilatation et oedèmes en agissant sur les cellules endothéliales (EC) et musculaires lisses (SMC) des vaisseaux sanguins et lymphatiques exprimant respectivement TACR1/2 ( tachykinin receptor 1/2) et RAMP1 ( receptor activity modifying protein 1). B. Certaines bactéries telles que Staphylococcus aureus exploitent l’activité immunosuppressive des neurones sensoriels (NS) via la production de l’alpha-hémolysine (α-HL) et de peptides formylés (FP). Les NS cutanés libèrent du CGRP, de la SP, de la galanine (GL) et de la somatostatine (SST), inhibant l’activation des macrophages résidents (Mac) en réponse à S. aureus. C. Le CGRP active les cellules dendritiques du derme (DC) qui sécrétent de l’IL(interleukine)-23 initiant la production d’IL-17 par les lymphocytes Tγδ impliqués dans le psoriasis (adapté de [ 41]). |
Les premières observations reliant le système nerveux périphérique (SNP) et le processus inflammatoire montraient que la stimulation électrique d’un nerf périphérique suffit à déclencher une vasodilatation et accroît la perméabilité vasculaire, un phénomène appelé « inflammation neurogénique » [42]. De nombreux médiateurs et neuropeptides sont sécrétés par les nocicepteurs activés. Parmi ceux-ci, le CGRP et la SP favorisent les œdèmes en stimulant les cellules endothéliales des vaisseaux lymphatiques et les cellules des muscles lisses vasculaires [43]. Le rôle de ces facteurs ne se limite pas à une action sur les vaisseaux. Leurs récepteurs, comme RAMP1 (receptor activity modifying protein 1), TACR1 (tachykinin receptor 1) et VPAC1 (vasoactive intestinal peptide receptor 1), sont en effet également exprimés par des cellules immunitaires [44]. Ainsi, le CGRP favorise l’angiogenèse et la lymphangiogenèse en activant la sécrétion de VEGF par les macrophages exprimant RAMP1 [45]. Le rôle précis des médiateurs libérés par les nocicepteurs sur la migration des cellules dendritiques et l’initiation des réponses lymphocytaires T et B reste encore à être élucidé. Au cours d’une infection, les nocicepteurs détectent des cytokines secrétées par les cellules immunitaires (comme le TNF-α et l’IL1-β), des alarmines (TSLP [thymic stromal lymphopoietin], HMGB1 [high-mobility group box 1], IL-33) produites par les cellules en situation de stress [46], mais également des molécules provenant de pathogènes [41]. En effet, ils peuvent être activés directement par des composants microbiens comme le lipopolysaccharide (LPS), l’α-hémolysine, des peptides N-formylés, la flagelline, le zymosan, produits par des bactéries ou des champignons [6, 47]. Dans le contexte d’une infection cutanée par Staphylococcus aureus, l’activation des nocicepteurs par des molécules produites par la bactérie a un effet anti-inflammatoire [48]. Des souris génétiquement déficientes en nocicepteurs, et infectées par la bactérie [12], présentent ainsi une augmentation de l’infiltrat immunitaire au site infectieux, une concentration cutanée de TNF-α plus élevée, et une lymphadénopathie du ganglion drainant. Dans ce modèle infectieux, une partie du phénotype inflammatoire peut être inhibée par l’injection cutanée de CGRP, suggérant un rôle possible de ce facteur dans la régulation des réponses à S. aureus. Dans d’autres contextes infectieux ou inflammatoires, les nocicepteurs ont un rôle plutôt pro-inflammatoire. Lors d’une infection cutanée fongique par la levure Candida albicans, par exemple, la présence d’une sous-population de nocicepteurs est nécessaire pour déclencher la synthèse d’IL-23 par les cDC2 [49]. Cette production d’IL-23 est cruciale pour activer les lymphocytes Tγδ producteurs d’IL-17α qui, à leur tour, induiront la synthèse de peptiques antifongiques par les cellules endothéliales. Les nocicepteurs sont donc importants pour l’induction d’une immunité protectrice dans ce modèle infectieux. Les mécanismes en jeu restent cependant encore méconnus, mais des injections répétées de CGRP à des souris déficientes en nocicepteurs peuvent restaurer leurs défenses immunitaires, suggérant, sans le démontrer, un rôle possible de ce facteur dans la régulation de la réponse immunitaire. Rôle des nocicepteurs dans les maladies inflammatoires de la peau La douleur est un symptôme retrouvé non seulement dans des pathologies infectieuses mais également dans de nombreuses pathologies inflammatoires. En 2014, une étude utilisant un modèle murin de psoriasis (induit par l’application cutanée d’Aldara 3) révèle un rôle central des nocicepteurs exprimant le récepteur TRPV1 dans l’induction des symptômes psoriasiques [ 50]. Dans ce modèle expérimental, les neurones induisent la sécrétion d’IL-23 par les cDC2 du derme qui activent à leur tour les lymphocytes Tγδ producteurs d’IL-17α déclenchant les symptômes psoriasiformes, et favorisant une prolifération incontrôlée des kératinocytes. Les médiateurs neuronaux qui activent cette voie restent à être identifiés. Cependant, des similitudes avec les données obtenues dans le modèle d’infection fongique précédemment décrit [ 49] laissent supposer un rôle potentiel du CGRP. Une dérégulation de ces interactions neuro-immunes pourrait donc être à l’origine de certaines pathologies inflammatoires telles que le psoriasis. Le système nerveux sensoriel pourrait également jouer un rôle dans des conditions inflammatoires de type allergiques [44]. En effet, dans des modèles murins de dermatite de contact induite par l’oxazolone (agent chimique) ou par l’urushiol (allergène végétal), l’ablation génétique ou l’inhibition pharmacologique du récepteur TRPA1 permet de réduire l’œdème cutané, l’hyperplasie kératinocytaire, l’infiltration leucocytaire et le niveau de production de molécules pro-inflammatoires comme l’IL-4, l’IL-6 et le CXCL2 [51]. Les neurones qui expriment TRPA1 peuvent également produire des neuromédiateurs comme la SP qui déclenchent la dégranulation des mastocytes [52]. Cependant, le rôle du SNP dans ces pathologies est complexe. En effet, selon les modèles d’hypersensibilité de contact utilisés, le CGRP peut soit réduire l’inflammation cutanée de type Th1 induite par le 2,4,6-trinitrochlorobenzène (TCNB), soit promouvoir l’allergie (réponse de type Th2) induite par application cutanée d’isothiocyanate de fluorescéine (FITC) [53]. |
Conclusion et perspectives Les études que nous avons décrites montrent clairement que le SNP sensoriel joue un rôle important dans la régulation de la réponse immunitaire, aussi bien en conditions infectieuses, qu’inflammatoires ou allergiques. Les interactions bidirectionnelles entre systèmes nerveux et immunitaire ne se limitent pas à la peau. Elles ont été également mises en évidence dans d’autres tissus tels que les muqueuses digestives [54] ou pulmonaires [55]. Le rôle des neurones sensoriels sur la régulation de l’immunité dépend grandement des stimulus inflammatoires et infectieux rencontrés, révélant une plasticité fonctionnelle dont la complexité commence à peine à être appréhendée. Une meilleure compréhension des mécanismes moléculaires sur lesquels reposent ces relations neuro-immunes pourrait permettre de développer de nouvelles stratégies thérapeutiques contre certaines pathologies inflammatoires, infectieuses ou allergiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Verbov J. Celsus and his contributions to dermatology . Int J Dermatol. 1978; ; 17 : :521.–523. 2.
Tauber AI. Metchnikoff and the phagocytosis theory . Nat Rev Mol Cell Biol. 2003; ; 4 : :897.–901. 3.
Hodes GE, Kana V, Menard C, et al. Neuroimmune mechanisms of depression . Nat Neurosci. 2015; ; 18 : :1386.–1393. 4.
Grace PM, Hutchinson MR, Maier SF, Watkins LR. Pathological pain and the neuroimmune interface . Nat Rev Immunol. 2014; ; 14 : :217.–231. 5.
Ernsberger U. Role of neurotrophin signalling in the differentiation of neurons from dorsal root ganglia and sympathetic ganglia . Cell Tissue Res. 2009; ; 336 : :349.–384. 6.
Talbot S, Foster SL, Woolf CJ. Neuroimmunity: physiology and pathology . Annu Rev Immunol. 2016; ; 34 : :421.–447. 7.
Veiga-Fernandes H, Mucida D. Neuro-immune interactions at barrier surfaces . Cell. 2016; ; 165 : :801.–811. 8.
Candi E, Schmidt R, Melino G. The cornified envelope: a model of cell death in the skin . Nat Rev Mol Cell Biol. 2005; ; 6 : :328.–340. 9.
Fuchs E. Scratching the surface of skin development . Nature. 2007; ; 445 : :834.–842. 10.
Abraira VE, Ginty DD. The sensory neurons of touch . Neuron. 2013; ; 79 : :618.–639. 11.
Moqrich A. Peripheral pain-sensing neurons: from molecular diversity to functional specialization . Cell Rep. 2014; ; 6 : :245.–246. 12.
Abrahamsen B, Zhao J, Asante CO, et al. The cell and molecular basis of mechanical, cold, and inflammatory pain . Science. 2008; ; 321 : :702.–705. 13.
Zimmerman A, Bai L, Ginty DD. The gentle touch receptors of mammalian skin . Science. 2014; ; 346 : :950.–954. 14.
Le Pichon CE, Chesler AT. The functional and anatomical dissection of somatosensory subpopulations using mouse genetics . Front Neuroanat. 2014; ; 8 : :21.. 15.
Caterina MJ, Leffler A, Malmberg AB, et al. Impaired nociception and pain sensation in mice lacking the capsaicin receptor . Science. 2000; ; 288 : :306.–313. 16.
Dhaka A, Murray AN, Mathur J, et al. TRPM8 is required for cold sensation in mice . Neuron. 2007; ; 54 : :371.–378. 17.
Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain . Cell. 2009; ; 139 : :267.–284. 18.
Usoskin D, Furlan A, Islam S, et al. Unbiased classification of sensory neuron types by large-scale single-cell RNA sequencing . Nat Neurosci. 2015; ; 18 : :145.–153. 19.
Reynders A, Mantilleri A, Malapert P, et al. Transcriptional profiling of cutaneous MRGPRD free nerve endings and C-LTMRs . Cell Rep. 2015. pii : 52211–1247(15)00047–9. 20.
Doebel T, Voisin B, Nagao K. Langerhans cells : the macrophage in dendritic cell clothing . Trends Immunol. 2017; ; 38 : :817.–828. 21.
Heath WR, Carbone FR. The skin-resident and migratory immune system in steady state and memory: innate lymphocytes, dendritic cells and T cells . Nat Immunol. 2013; ; 14 : :978.–985. 22.
Pasparakis M, Haase I, Nestle FO. Mechanisms regulating skin immunity and inflammation . Nat Rev Immunol. 2014; ; 14 : :289.–301. 23.
Bedoui S, Whitney PG, Waithman J, et al. Cross-presentation of viral and self antigens by skin-derived CD103+ dendritic cells . Nat Immunol. 2009; ; 10 : :488.–495. 24.
Guilliams M, Ginhoux F, Jakubzick C, et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny . Nat Rev Immunol. 2014; ; 14 : :571.–578. 25.
Hoeffel G, Wang Y, Greter M, et al. Adult Langerhans cells derive predominantly from embryonic fetal liver monocytes with a minor contribution of yolk sac-derived macrophages . J Exp Med. 2012; ; 209 : :1167.–1181. 26.
Hoeffel G, Ginhoux F. Ontogeny of tissue-resident macrophages. Front Immunol. 2015; ; 6 : :486.. 27.
Tamoutounour S, Guilliams M, Montanana Sanchis F, et al. Origins and functional specialization of macrophages and of conventional and monocyte-derived dendritic cells in mouse skin . Immunity. 2013; ; 39 : :925.–938. 28.
Lawrence T, Natoli G. Transcriptional regulation of macrophage polarization: enabling diversity with identity . Nat Rev Immunol. 2011; ; 11 : :750.–761. 29.
Wynn TA, Vannella KM. Macrophages in tissue repair, regeneration, and fibrosis . Immunity. 2016; ; 44 : :450.–462. 30.
Galli SJ, Grimbaldeston M, Tsai M. Immunomodulatory mast cells: negative, as well as positive, regulators of immunity . Nat Rev Immunol. 2008; ; 8 : :478.–486. 31.
Jameson J, Ugarte K, Chen N, et al. A role for skin gammadelta T cells in wound repair . Science. 2002; ; 296 : :747.–749. 32.
Ebbo M, Crinier A, Vely F, Vivier E. Innate lymphoid cells: major players in inflammatory diseases . Nat Rev Immunol. 2017; ; 17 : :665.–678. 33.
Vivier E, Raulet DH, Moretta A, et al. Innate or adaptive immunity? The example of natural killer cells . Science. 2011; ; 331 : :44.–49. 34.
Roediger B, Kyle R, Yip KH, et al. Cutaneous immunosurveillance and regulation of inflammation by group 2 innate lymphoid cells . Nat Immunol. 2013; ; 14 : :564.–573. 35.
Salimi M, Barlow JL, Saunders SP, et al. A role for IL-25 and IL-33-driven type-2 innate lymphoid cells in atopic dermatitis . J Exp Med. 2013; ; 210 : :2939.–2950. 36.
Villanova F, Flutter B, Tosi I, et al. Characterization of innate lymphoid cells in human skin and blood demonstrates increase of NKp44+ ILC3 in psoriasis . J Invest Dermatol. 2014; ; 134 : :984.–991. 37.
Abtin A, Jain R, Mitchell AJ, et al. Perivascular macrophages mediate neutrophil recruitment during bacterial skin infection . Nat Immunol. 2014; ; 15 : :45.–53. 38.
Mantovani A, Cassatella MA, Costantini C, Jaillon S. Neutrophils in the activation and regulation of innate and adaptive immunity . Nat Rev Immunol. 2011; ; 11 : :519.–531. 39.
Jakubzick CV, Randolph GJ, Henson PM. Monocyte differentiation and antigen-presenting functions . Nat Rev Immunol. 2017; ; 17 : :349.–362. 40.
Belkaid Y, Tamoutounour S. The influence of skin microorganisms on cutaneous immunity . Nat Rev Immunol. 2016; ; 16 : :353.–366. 41.
Pinho-Ribeiro FA, Verri WA Jr., Chiu IM. Nociceptor sensory neuron-immune interactions in pain and inflammation . Trends immunol. 2017; ; 38 : :5.–19. 42.
Jancso N, Jancso-Gabor A, Szolcsanyi J. Direct evidence for neurogenic inflammation and its prevention by denervation and by pretreatment with capsaicin . Br J Pharmacol Chemother. 1967; ; 31 : :138.–151. 43.
Brain SD, Williams TJ, Tippins JR, et al. Calcitonin gene-related peptide is a potent vasodilator . Nature. 1985; ; 313 : :54.–56. 44.
Voisin T, Bouvier A, Chiu IM. Neuro-immune interactions in allergic diseases: novel targets for therapeutics . Int Immunol. 2017; ; 29 : :247.–261. 45.
Kurashige C, Hosono K, Matsuda H, et al. Roles of receptor activity-modifying protein 1 in angiogenesis and lymphangiogenesis during skin wound healing in mice . FASEB J. 2014; ; 28 : :1237.–1247. 46.
Chan JK, Roth J, Oppenheim JJ, et al. Alarmins: awaiting a clinical response . J Clin Invest. 2012; ; 122 : :2711.–2719. 47.
Veiga-Fernandes H, Freitas AA. the S(c)ensory immune system theory . Trends Immunol. 2017; ; 38 : :777.–788. 48.
Chiu IM, Heesters BA, Ghasemlou N, et al. Bacteria activate sensory neurons that modulate pain and inflammation . Nature. 2013; ; 501 : :52.–57. 49.
Kashem SW, Riedl MS, Yao C, et al. Nociceptive sensory fibers drive interleukin-23 production from CD301b+ dermal dendritic cells and drive protective cutaneous immunity . Immunity. 2015; ; 43 : :515.–526. 50.
Riol-Blanco L, Ordovas-Montanes J, Perro M, et al. Nociceptive sensory neurons drive interleukin-23-mediated psoriasiform skin inflammation . Nature. 2014; ; 510 : :157.–161. 51.
Liu B, Escalera J, Balakrishna S, et al. TRPA1 controls inflammation and pruritogen responses in allergic contact dermatitis . FASEB J. 2013; ; 27 : :3549.–3563. 52.
Jarvikallio A, Harvima IT, Naukkarinen A. Mast cells, nerves and neuropeptides in atopic dermatitis and nummular eczema . Arch Dermatol Res. 2003; ; 295 : :2.–7. 53.
Mikami N, Matsushita H, Kato T, et al. Calcitonin gene-related peptide is an important regulator of cutaneous immunity: effect on dendritic cell and T cell functions . J Immunol. 2011; ; 186 : :6886.–6893. 54.
Gabanyi I, Muller PA, Feighery L, et al. Neuro-immune interactions drive tissue programming in intestinal macrophages . Cell. 2016; ; 164 : :378.–391. 55.
Talbot S, Abdulnour RE, Burkett PR, et al. Silencing nociceptor neurons reduces allergic airway inflammation . Neuron. 2015; ; 87 : :341.–354. 56.
Crinier A, Viant C, Girard-Madoux M, Vivier E. Les cellules lymphoïdes innées. Med Sci (Paris). 2017; ; 33 : :534.–542. |