| |
| Med Sci (Paris). 34(5): 439–447. doi: 10.1051/medsci/20183405017.Que la lumière soit. Et si ce n’était plus seulement vrai ! Évolution de la cytométrie : du conventionnel à la masse (en passant par le spectre) Thierry Idziorek,1,4* Julie Cazareth,2** Catherine Blanc,3*** Nathalie Jouy,1,4 Pierre Bourdely,2 and Aurélien Corneau3 1Université de Lille, JPArc, Inserm UMR-S1172, bâtiment IRCL (Institut pour la Recherche sur le Cancer de Lille), 1, place de Verdun, 59045Lille Cedex, France 2Université Côte d’Azur, CNRS, IPMC, 660, route des Lucioles, 06560Valbonne, France 3Sorbonne Université, Plateforme de cytométrie CyPS, UMS30 - LUMIC, Site Pitié-Salpêtrière, 105, boulevard de l’Hôpital, 75651Paris Cedex 13, France 4Université de Lille, BioImaging Center of Lille, plateau de cytométrie, bâtiment IRCL (Institut pour la Recherche sur le Cancer de Lille), 1, place de Verdun, 59045Lille Cedex, France |

La cytométrie, déjà connue dans les années 1930, ne prend réellement son essor que vers la fin des années 1960 avec les travaux de Kamentsky, en 1965 et 1967 [
1,
2]. Les progrès dans la détection et le traitement du signal lumineux ont alors permis à l’équipe d’Herzenberg (1931-2013) de développer le premier cytomètre ayant une fonction de tri permettant la séparation de cellules d’intérêt grâce à un système de formation de gouttelettes reprenant le même principe que l’imprimante à jet d’encre [
3]. C’est ce principe qui a été appliqué avec de nombreuses améliorations ces dernières décennies. La cytométrie en flux, dont le nom en grec signifie « mesure de cellules » en flux, est une technique biologique qui permet l’étude multiparamétrique précise, quantitative et qualitative, de particules isolées en suspension entraînées par un flux liquide. Son expansion et son succès sont indissociables de la production d’anticorps monoclonaux, découverte par Köhler et Milstein en 1975 [
4], et de la possibilité d’y fixer de façon covalente différentes molécules fluorescentes, comme l’isothiocyanate de fluorescéine (FITC) dès 1950 [
5], auxquelles il faut leur adjoindre de nombreuses sondes fonctionnelles synthétisées notamment sous l’égide de R. Haughland [
6]. La cytométrie en flux est aujourd’hui omniprésente, aussi bien utilisée dans les laboratoires d’analyses médicales que dans les laboratoires de recherche. On la retrouve également embarquée sur des navires, voire des bouées, pour des études de biologie marine dans lesquelles les pigments naturels des micro-organismes sont les principaux critères d’identification et quantification des populations. Ces dernières années ont vu une progression importante des capacités des nouveaux appareils. La cytométrie en flux actuelle permet une collection plus importante de données et donc, des analyses plus fines et parfois plus rapides. Un saut technologique a été récemment franchi avec la cytométrie couplée à la spectrométrie de masse, dans laquelle les fluorochromes ont été remplacés par des métaux rares de la famille des lanthanides qui possède de nombreux isotopes non radioactifs de masse moléculaire différente, élargissant ainsi considérablement les possibilités de détections simultanées. Dans cette revue, nous décrirons schématiquement la cytométrie en flux conventionnelle ainsi que deux des technologies récemment développées : l’analyse spectrale et la cytométrie de masse. |
Que la lumière soit : la cytométrie en flux conventionnelle La cytométrie conventionnelle regroupe (1) un système fluidique entraînant des particules monodispersées, comme des cellules, une à une jusqu’à une, ou des, source(s) d’excitation, (2) un système de collection de la lumière émise (fluorescence), (3) une digitalisation du signal, et (4) un logiciel d’analyse permettant d’interpréter les données. Deux systèmes fluidiques existent. Ils reposent sur la circulation d’un liquide de gaine entraînant les particules jusqu’au site où elles seront analysées (la cuvette d’analyse) (Figure 1). Dans le cas de la focalisation hydrodynamique, une pression légèrement supérieure à celle du liquide de gaine est appliquée à l’échantillon pour permettre la pénétration des particules dans le flux. Cette stratégie favorise l’alignement des particules, les unes derrière les autres, à l’entrée de la chambre d’analyse. Cependant, lorsque la pression appliquée sur l’échantillon est augmentée pour accélérer la vitesse d’analyse, le flux de particules s’élargit. Celles-ci se distribuent alors plus aléatoirement dans le cœur du fluide, ce qui affecte l’homogénéité de l’excitation et de la collecte des signaux. Cela peut également permettre à plusieurs particules de traverser le faisceau laser au même moment (Figure 1A). Une variation de signal, qui dégrade la qualité de l’analyse, est alors observée. Ce problème a été résolu avec la focalisation acoustique (Attune NxT Flow cytometer, développé par ThermoFischer scientific). Grâce à une sonde de sonication adjointe à l’entrée de la cuvette d’analyse (Figure 1B), le flux devient indépendant de la pression exercée et les particules s’alignent sur le cœur du fluide, recevant alors la même excitation par les faisceaux lasers. Cette amélioration autorise des vitesses de passage de cellules beaucoup plus importantes, de l’ordre de 5 à 10 fois par rapport à la focalisation hydrodynamique (50 000 événements par seconde) et sans perte de qualité du signal.
 | Figure 1.
Système fluidique. Comparaison des focalisations hydrodynamique (A) et acoustique (B). Le différentiel de pression entre le liquide de gaine et le liquide d’échantillon forme un jet plus ou moins large qui entraîne les particules vers le faisceau laser. Lorsque la vitesse, et donc la pression appliquée à l’échantillon, est faible, le jet est étroit (cellules jaunes). Il s’élargit lorsque la pression augmente (cellules rouges). Les histogrammes montrent les résultats obtenus dans chaque condition : l’étroitesse du pic reflète la qualité de la mesure du signal. |
Les sources d’excitation ont aussi grandement évolué : les lampes à arc initialement utilisées ont été remplacées par des lasers à gaz, puis des lasers solides, et plus récemment, des diodes lasers. Aujourd’hui, les sources les plus communes sont les lasers violet (405 nm), bleu (laser argon, 488 nm) et rouge (633 nm), ainsi que les lasers jaune/vert (561 nm) et ultraviolet (355 nm). Une particule traversant le faisceau laser diffuse la lumière de ce faisceau. Ses propriétés de diffusion, selon l’axe du laser et à 90°, permettent d’évaluer sa taille et sa structure. La mesure des intensités de fluorescences émises à la suite de l’excitation par la particule repose sur des composants optiques. L’enchaînement de miroirs dichroïques et de filtres permet de morceler le spectre de la lumière émise, en fonction des maximums des pics d’émission des différentes molécules fluorescentes de l’échantillon (Figure 2A). Cette approche permet de collecter, sur un détecteur spécifique, le maximum d’émission d’une fluorescence (Figure 2C). Ainsi, suite à une excitation par le laser à 488 nm, un miroir dichroïque passe-haut 560 nm réfléchira les longueurs d’ondes inférieures à 560 nm, et transmettra celles qui sont supérieures. Des filtres passe-bandes (BP) sont également positionnés devant chaque détecteur et collectent la lumière entre deux longueurs d’ondes. Par exemple, un filtre BP 530/30 transmettra la lumière entre 515 et 545 nm, spécifique de l’émission du fluorochrome FITC exité à 488 nm, sur le détecteur A (Figure 2B et C). Une perte de photons peut apparaître selon la largeur de la bande et l’efficacité de transmission spécifique à chaque filtre. Les détecteurs sont principalement des tubes photomultiplicateurs très sensibles qui transforment les photons collectés en un signal électrique amplifié. Dans le cas où deux fluorochromes ont des spectres d’émission qui se chevauchent, un tube photomultiplicateur détectera les photons émis par deux molécules. Ces photons parasites induisent un biais d’analyse. Il est donc indispensable de corriger cette fuite spectrale afin de pouvoir mesurer la fluorescence spécifique de la molécule d’intérêt. Dans ce cas, une soustraction mathématique est possible grâce à l’utilisation de matrices de compensation, aujourd’hui automatisable. Cette étape indispensable et cruciale dans le réglage du cytomètre requiert des échantillons contrôles adaptés, appelés « mono-marqués », qui permettent d’évaluer cette fuite spectrale sur chaque détecteur. Les signaux électriques recueillis sont ensuite digitalisés. Les données obtenues peuvent être analysées avec des logiciels dédiés.
 | Figure 2.
Cytométrie conventionnelle. A. Schéma des spectres d’excitation (lignes) et des spectres d’émission (aires) de plusieurs fluorochromes entre 300 et 800 nm en fonction des lasers bleu (488 nm), vert/jaune (561 nm) et violet (405 nm). B. Comparaison des spectres d’émission de 4 fluorochromes. Les rectangles représentent la fenêtre de longueurs d’ondes des différents filtres bande-passe utilisés classiquement sur les cytomètres pour collecter les photons émis par chaque sonde sur son détecteur spécifique. Les traits en pointillés verticaux représentent les possibilités des contaminations croisées des différents fluorochromes sur chacun des autres détecteurs. C. Schéma simplifié d’un cytomètre. Le schéma montre un cytomètre possédant 3 lasers (violet, bleu et vert/jaune) décalés dans l’espace dont les faisceaux rencontrent un flux de cellules marquées par des fluorochromes différents. Plusieurs jeux de miroirs et de filtres dichroïques permettent d’adresser les fluorescences émises sur les détecteurs dédiés. Les graphiques montrent le cas d’une étude de cycle et d’apoptose sur des cellules non fixées en l’absence (panneau de gauche) ou en présence (panneau de droite) d’un inducteur de mort cellulaire (V : cellules vivantes ; M : cellules mortes ou en apoptose). |
Les avantages de la cytométrie conventionnelle L’optique Les développements technologiques récents ont permis d’améliorer grandement la conception des cytomètres. L’apparition de lasers solides, de fibres optiques et de nouveaux bancs optiques (Trigones et Octogones ; BD Bisociences) ont permis de rendre les cytomètres plus compacts et plus performants (Figure 2). Les détecteurs de type photodiode d’avalanche améliorent la détection dans le rouge et le proche infrarouge (Cytoflex ; Beckman Coulter). L’utilisation conjointe de caméras CCD ( charge coupled device) et d’objectifs à fort grossissement ont transformé un cytomètre en imageur en flux (ImageStream X ; Merck Millipore). Des images sont collectées pour chaque particule. On peut donc suivre, par exemple, l’activation cellulaire et le passage du cytoplasme au noyau de facteurs de transcription, faire des études morphologiques couplées à un phénotypage, ou encore détecter des anomalies génétiques par hybridation fluorescente in situ (FISH). Toutes ces technologies ont permis d’étendre le nombre de molécules fluorescentes pouvant être analysées simultanément. Ainsi en 4 à 5 ans, ce nombre est passé de 20 à 50. Les fluorochromes L’explosion chromatique a été possible grâce au développement de nombreuses molécules fluorescentes qui peuvent être couplées à des anticorps, notamment celles excitées par le laser violet (405 nm) et proches de l’ultraviolet (UV). L’une des particularités de la cytométrie en flux conventionnelle est la possibilité de travailler sur du matériel vivant en utilisant de nombreuses sondes qui permettent d’explorer les fonctions de l’échantillon analysé. À titre d’exemple, citons l’étude simultanée du cycle cellulaire et de l’apoptose (Figure 2C). Le cycle et la viabilité des cellules peuvent être déterminés grâce à un intercalant de l’ADN et par une sonde spécifique de l’activité mitochondriale, excités respectivement par les lasers violet et bleu. Le tri cellulaire La cytométrie en flux conventionnelle permet le tri simultané d’une ou plusieurs populations (jusqu’à 6 aujourd’hui) de cellules monodispersées au cours d’une seule et même analyse. Elle a néanmoins évolué. Elle propose désormais la possibilité d’analyser et de trier de petits organismes (Caenorhabditis elegans, embryons de drosophile ou de poisson zèbre), voire d’amas cellulaires, comme les îlots de Langerhans par exemple. Les inconvénients de la cytométrie conventionnelle Les fluorochromes utilisés en cytométrie conventionnelle ont des spectres d’émission souvent larges avec des recouvrements qui peuvent être importants. Le choix des fluorochromes pour effectuer un phénotypage multiple sur une même cellule est donc crucial et détermine la stratégie d’analyse. Le spectre d’émission de fluorescence étant segmenté, avec des miroirs dichroïques et des filtres passe-bande, la lumière recueillie par le détecteur ne représente en fait qu’une fraction de la lumière émise. |
La cytométrie spectrale : pouvoir analyser tout le spectre lumineux Recueillir l’ensemble du spectre émis par un fluorochrome lors de son passage devant le faisceau laser a été une problématique complexe et longue à résoudre. Elle a débouché sur la cytométrie spectrale, qui permet un échantillonnage du spectre à haute résolution. En 2012, Grégori et al. ont proposé un prototype de cytomètre spectral dans lequel la fluorescence émise était divisée en deux afin d’être soit analysée classiquement, soit dispersée par différents systèmes optiques avant d’être dirigée vers un tube photomultiplicateur multi-anode mesurant l’ensemble du spectre de fluorescence [
7]. Principe de la cytométrie spectrale Le premier cytomètre en flux utilisant la technologie d’analyse spectrale a été commercialisé en 2014 (sous le nom de SP6800 par SONY Biotechnologies). Un schéma descriptif de ce cytomètre est présenté dans la Figure 3A. Dans la chambre d’analyse (Figure 3C), les cellules sont soumises séquentiellement à un laser 488 nm puis à la combinaison de deux lasers 405 et 638 nm. L’optique de séparation spectrale est composée de dix prismes. Ils étalent la fluorescence émise entre 500 et 800 nm et la dirige vers une série de lentilles qui concentrent la lumière sur un photomultiplicateur. Une meilleure résolution des émissions de nombreuses sondes et protéines fluorescentes, qui émettent dans le bleu et le vert, peut être obtenue en augmentant le nombre de canaux dans ces longueurs d’ondes (Figure 3B). Deux photomultiplicateurs détectent les fluorescences émises entre 420-440 nm (FL1) et 450-469 nm (FL2) pour les sondes excitables à 405 nm. Les propriétés optiques de diffusion (taille et structure) sont collectées sur des photodiodes (Figure 3A). Des graphiques qui représentent l’intensité du signal en fonction de la longueur d’onde d’émission pour chaque série de laser permettent de visualiser les spectres de fluorescences. Un filtre bloque la lumière du laser rouge (Figure 3D, flèches rouges) et crée un « trou » dans le spectre autour de 638 nm.
 | Figure 3.
Cytométrie spectrale. Les spectres présentés sont obtenus pour une excitation à 488 nm, excepté lorsque cela est précisé. A. Schéma optique d’un cytomètre spectral ( SONY SP6800). B. Longueurs d’ondes détectées par chacun des canaux du photomultiplicateur (PMT) 32 canaux. C. Chambre de détection. D. Spectres de billes fluorescentes excitées par le laser 488 nm (gauche) et 405/ 638 nm (droite). L’axe des abscisses correspond aux longueurs d’ondes, l’ordonnée à l’intensité de fluorescence. La couleur indique la quantité de fluorescence dans chaque canal (rouge, forte ; vert, moyenne ; bleue, faible). Les flèches rouges indiquent le filtre qui masque la lumière du laser 638 nm. E. Filtre virtuel phycoérythrine (PE) appliqué aux billes. F. Empreinte spectrale de l’échantillon (S[5λ]) et spectres individuels mesurés (fluorescéine [FITC] en vert, PE en orange et bruit de fond des cellules en violet). Le rectangle gris représente le masque obstruant la lumière du laser 638 nm. G. Graphiques de gauche : spectres des cellules marquées avec le mélange des anticorps couplés au FITC et au PE. Spectres de références individuels, du FITC et PE, qui seront utilisés par l’algorithme pour la décomposition spectrale. Graphiques de droite : Visualisation des cellules en nuages de points de densité avant et après application de l’algorithme de décomposition spectrale. H. Identification des cellules auto-fluorescentes à partir de l’échantillon non marqué. Spectres des cellules non auto-fluorescentes (NON AF) et auto-fluorescentes (AF). Utilisation de l’auto-fluorescence comme un paramètre après décomposition spectrale (d’après [
11], avec l’autorisation de SONY Biotechnologies Inc). |
Si un échantillon cellulaire est marqué par deux anticorps, l’un étant couplé au FITC (vert) et l’autre à la PE (phycoérythrine, rouge), pour identifier deux populations distinctes, le signal mesuré (Figure 3F, courbe S(l) en pointillés bleus) se résumera en la somme de la fluorescence émise par les anticorps couplés au FITC (Figure 3F, courbe verte), au PE (Figure 3F, courbe orange), et au bruit de fond, provenant des cellules elles-mêmes (Figure 3F, courbe violette). Un algorithme mathématique de décomposition linéaire permet de déduire l’abondance de chacune des sondes à partir de l’empreinte spectrale de l’échantillon multi-marqué (Figure 3F, graphique de gauche) et des spectres de référence de chacune des molécules fluorescentes utilisées (FITC et PE dans notre exemple, Figure 3G, graphiques au centre). Une fois appliqué aux données brutes, une intensité de fluorescence est attribuée à chaque marqueur pour chaque cellule (Figure 3G, les deux nuages de points à droite) [
8]. Ainsi, après l’acquisition des échantillons, puis application de la décomposition spectrale, les données obtenues peuvent être analysées. Les avantages de la cytométrie spectrale Une meilleure gestion de l’autofluorescence De nombreux constituants de la cellule émettent une fluorescence (comme le NADH [nicotinamide adénine dinucléotide réduit], les riboflavines, les pigments photo-synthétiques, etc.) et engendrent un signal basal élevé : l’autofluorescence (AF). L’intensité de cette AF émise sur tout le spectre dépend de la cellule et de la nature de l’échantillon. Dans un cytomètre conventionnel, elle est détectée par tous les photomultiplicateurs (PMT) et est à l’origine d’une diminution du rapport entre le signal et le bruit, ce qui peut rendre difficile l’interprétation de certaines données. En cytométrie spectrale, l’AF peut être traitée comme une donnée de fluorescence propre, avec un spectre d’émission spécifique aux cellules de l’échantillon non marquées (Figure 3G). Un (ou plusieurs) paramètre(s) supplémentaire(s) d’identification et de caractérisation des populations cellulaires seront ainsi générés lors de la décomposition spectrale. Ce type d’analyse trouve son avantage dans l’étude de certains types cellulaires, comme les macrophages alvéolaires du poumon [
9], les lymphocytes infiltrant le tissu épithélial de l’intestin, ou encore les cardiomyocytes [
10], ou pour les études pharmacologiques de prodrogues et de composés de synthèse. Des combinaisons de sondes inédites Le développement de nouvelles sondes fluorescentes, en permettant de multiplier les marqueurs biologiques, étend les possibilités d’exploration fonctionnelle. Cependant, l’augmentation des recouvrements spectraux et la difficulté d’appliquer des compensations correctes qui en résultent, rendent leur utilisation difficile. En effet, certaines de ces nouvelles sondes, plus brillantes (comme le BB515™ ou le BV421™), émettent dans le même canal que le FITC ou le Pacific Blue™ ; elles ne peuvent donc être combinées dans un même échantillon en cytométrie conventionnelle. L’approche spectrale permet de différencier les émissions de sondes dont le maximum du pic n’est décalé que de 10 nm, ou dont la forme globale varie [ 11]. Des combinaisons de sondes innovantes inédites sont donc désormais possibles [ 10]. Une détection des événements rares optimisée La détection des événements rares correspond à la révélation de populations cellulaires dont la proportion est inférieure à 0,01 %. Grâce au nombre important d’événements qu’il est possible d’analyser pour un même échantillon, la cytométrie en flux représente une technique de choix. Une limitation de la cytométrie conventionnelle dans cette application est l’impossibilité de différencier ces événements rares d’un artéfact dû à la combinaison de sondes utilisée et/ou à l’autofluorescence de l’échantillon. Par la gestion de l’AF qu’elle permet et les graphiques de visualisation des spectres, la cytométrie spectrale est donc devenue un outil pertinent pour la validation de la détection des événements rares. Les inconvénients de la cytométrie spectrale La constitution de l’ensemble des fluorochromes utilisés lors d’une expérience ( panel) reste un point critique de la cytométrie, qu’elle soit spectrale ou conventionnelle. Affranchie du problème de recouvrement de spectres, la décomposition spectrale tient compte de l’abondance de chaque fluorescence émise. L’intensité des marquages doit donc être minutieusement évaluée afin « qu’un spectre ne cache pas l’autre ». Les optiques de collection des signaux de diffusion de la lumière du laser d’un cytomètre spectral sont différentes de celles d’un cytomètre conventionnel. Les profils obtenus sont donc également différents, ce qui peut être limitant pour l’identification de populations cellulaires selon ces critères. Comme dans toute expérience de cytométrie, il est indispensable de s’assurer de la qualité des réactifs et des échantillons contrôles afin de garantir une bonne matrice de décomposition spectrale et/ou l’utilisation d’une matrice calculée lors d’une expérience précédente (un tandem de fluorochromes mal conservé peut en effet se découpler dans le temps, la forme de son spectre sera alors modifiée). Enfin, l’indisponibilité d’un trieur de cellules utilisant la technologie spectrale reste un frein à son implantation dans les laboratoires de recherche. |
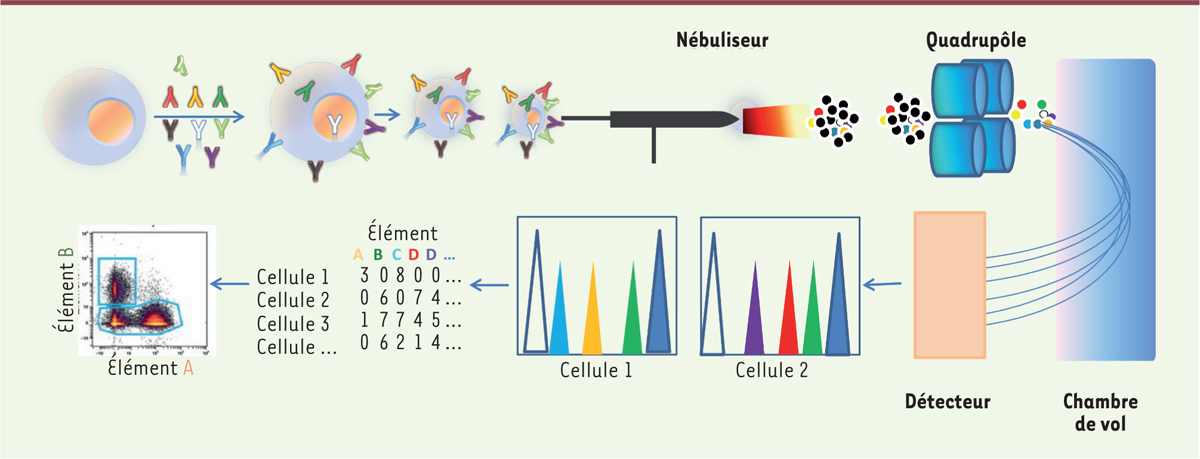
Oublier la lumière : la cytométrie de masse À la différence de la cytométrie en flux conventionnelle ou spectrale, qui reposent sur la fluorescence, la cytométrie de masse (CMM), qui a émergé dans les années 2010 [
12,
13], repose sur une analyse de la masse atomique des molécules [
14] (→).
(→) Voir la Nouvelle de A. Cosma et R. Le Grand, m/s n° 12, décembre 2011, page 1072
Les sondes utilisées sont des anticorps, non plus couplés à des fluorochromes, mais à des isotopes de métaux non radioactifs de la famille des lanthanides1. Ces isotopes étant absents des systèmes biologiques, leur détection révèle la fixation de l’anticorps à l’antigène recherché. Principe de la cytométrie de masse Cent trente-cinq canaux de détection de masse atomique allant de 75 à 209 daltons peuvent être attribués. Il est donc possible d’engendrer des profils phénotypiques et fonctionnels complexes. Seuls 47 isotopes ont été purifiés à l’heure actuelle. Cette gamme devrait s’étendre dans l’avenir, permettant d’accroître les performances de cette technologie. Lors de la conception d’un panel de cytométrie de masse, plusieurs facteurs sont à considérer : l’abondance de l’antigène, la sensibilité du système aux isotopes, les sources de bruit de fond et l’oxydation possible des ions. Le choix des isotopes est également fonction de la sensibilité du cytomètre de masse sur lequel les échantillons seront acquis [
15]. Les sources principales de bruit de fond proviennent de l’environnement. En effet, certains métaux lourds peuvent être présents dans des produits utilisés lors de la préparation des échantillons, par exemple le baryum (130-138 Da) et ses oxydes. Le baryum est l’un des éléments les plus abondants de la croûte terrestre. Il peut contaminer les échantillons exposés dans l’environnement d’un laboratoire (retombées de poussières) et les savons, le verre de laboratoire, les flacons de réactifs peuvent également présenter des niveaux élevés de baryum. Méthode Les étapes de préparation cellulaire et de marquage sont identiques à celles de la cytométrie en flux conventionnelle avec quelques nuances. Du cisplatine (ou du rhodium) est utilisé pour évaluer la viabilité des cellules 2,. Un intercalant d’acide nucléique conjugué à l’iridium permet d’analyser la teneur en ADN 3. L’échantillon, fixé en suspension dans l’eau, est introduit dans une chambre remplie d’argon qui fournit la pression nécessaire pour le transférer au nébuliseur. L’eau sera ainsi éliminée par aérosolisation afin que l’échantillon soit ionisé dans le plasma. L’évaporation partielle des gouttelettes d’aérosols monocellulaires sera ensuite réalisée à travers une chambre de pulvérisation chauffée à 200 degrés. Les gouttelettes sortant de la chambre sont vaporisées, atomisées et ionisées pour une analyse de masse. Chaque cellule forme un nuage d’ions contenant les marqueurs métalliques ionisés. Les nuages sont envoyés dans l’analyseur de masse/temps de vol (TOF), qui sépare les ions sur la base du rapport masse-charge. Le faisceau sortant pénètre dans une chambre d’accélérateur d’analyseur TOF. L’analyse des données nécessite des logiciels qui ont initialement été adaptés à partir de la cytométrie classique, mais aussi des applications qui ont été développées pour de l’analyse en clustering [
16] en raison du nombre croissant de données acquises (Figure 4).
 | Figure 4.
Principe de la cytométrie de masse. Les cellules monodispersées sont marquées avec les anticorps ainsi qu’un intercalant de l’ADN conjugué à l’iridium. L’échantillon est introduit dans le nébuliseur, puis la chambre à plasma où il est vaporisé, atomisé et ionisé. Chaque nuage d’ions, correspondant à une cellule, est envoyé dans la chambre de vol pour la séparation des marqueurs métalliques en fonction de leur masse. Les ions sont détectés, puis analysés. |
Les avantages de la cytométrie de masse Les principaux avantages de la cytométrie de masse sont la disponibilité d’un grand nombre d’éléments qui peuvent être utilisés pour marquer les anticorps, une diversité qui permet de créer de larges panels de marqueurs ; l’absence de recouvrement de masse entre les isotopes élémentaires utilisés, permettant de mesurer plus de 50 paramètres simultanément, sans besoin de compensation ; l’absence d’autofluorescence ; la sensibilité moindre des métaux lourds à une dégradation liée aux tampons de perméabilisation, ce qui rend possible une exploration approfondie d’antigènes cellulaires de la membrane au cytoplasme et au noyau. Il est ainsi possible d’analyser simultanément la co-expression d’antigènes membranaires, intra-cytoplasmiques et nucléaires ainsi que le cycle cellulaire. Ce fort potentiel analytique permet l’analyse des événements rares (< 0,01 %). L’introduction dans chaque échantillon de standards internes contenant des billes couplées à des isotopes avec une abondance précise et connue permet de normaliser les acquisitions entre elles. Les inconvénients de la cytométrie de masse Les principaux inconvénients de la cytométrie de masse sont (1) sa lenteur d’acquisition : entre 250 et 500 événements par seconde contre près de 50 000 en cytométrie en flux, soit 100 fois moins ; (2) la taille et la granularité des échantillons ne peuvent être évaluées ; (3) certains rapporteurs fluorescents qui permettent de mettre en évidence le flux calcique, la perméabilisation mitochondriale et la division cellulaire n’ont pas d’équivalent métallique ; (4) enfin, le tri cellulaire est, et restera, impossible puisque les cellules sont désintégrées. |
Le « big bang » représenté par le développement de la masse en cytométrie a forcé les fabricants de lumières à se remettre sur la table à dessin et à revoir leurs palettes de couleurs. On ne peut que se réjouir de ces avancées en cytométrie conventionnelle, notamment en ce qui concerne la miniaturisation des appareils, grâce à l’utilisation de lasers solides, de fibres optiques, et de nouveaux détecteurs, et la synthèse de nouveaux fluorochromes. Cette technologie permet d’explorer le monde du vivant, des anomalies génétiques aux petits organismes, des microparticules aux organelles, en passant par la transduction du signal et l’activité enzymatique. Ces différentes approches que permet la cytométrie sont déjà et continueront d’être complémentaires (Tableau I).
Tableau I.
|
Cytomètre |
| Conventionnel |
Spectral |
Masse |
|
Analyse
|
Oui |
Oui |
Oui |
|
|
Tri cellulaire
|
Oui |
Non |
Non |
|
|
Rapidité
|
Oui |
Oui |
Non |
|
|
Taille/structure
|
Oui |
Oui |
En développement |
|
|
Sondes fonctionnelles
|
Oui |
Oui |
Non, mais contenu ADN |
|
|
Multiphénotypage (paramètres)
|
Oui (50) |
Oui (> 24) |
Oui (135) |
|
|
Autofluorescence(cellules, composés chimiques)
|
Oui, partiellement |
Oui |
Non |
|
|
Traitement du signal brut
|
Oui |
Oui |
Oui |
Possibilités techniques des appareils de cytométrie.
|
La cytométrie spectrale permet, quant à elle, la discrimination de sondes présentant un important recouvrement spectral, et la gestion de l’autofluorescence des particules analysées, augmentant ainsi la sensibilité de détection. L’empreinte spectrale de chaque cellule devient une donnée indispensable à la compréhension de l’échantillon, voire à l’interprétation des résultats, en particulier dans le cas de la détection d’événements rares. Le champ d’application de cette technologie est vaste : immunologie, cancérologie, océanographie. Le tri cellulaire sur la base de l’analyse spectrale est la prochaine évolution de cette approche. La cytométrie de masse a révolutionné la cytométrie en permettant d’analyser tous les compartiments cellulaires, de la membrane au contenu en ADN. Elle permet, par sa capacité analytique, de produire des données inégalables à toute autre technologie. Son absence d’autofluorescence est un immense avantage, permettant ainsi de mettre en évidence des événements rares. En revanche, la CMM ne peut, actuellement, utiliser des sondes fonctionnelles ou des substrats enzymatiques, et n’offre aucune possibilité de tri cellulaire. La CMM a permis le développement de logiciels de traitements de données qui peuvent désormais être utilisés par tous les cytométristes. L’évolution de la cytométrie de masse en analyse d’images va révolutionner la pertinence analytique des coupes tissulaires ; cette avancée technologique est très attendue dans le monde de la cancérologie [
17]. Les années à venir devraient voir l’apparition de nouvelles technologies comme la microfluidique, qui permettraient d’explorer d’autres univers, comme les propriétés physiques des cellules. Il faut juste attendre qu’elles sortent de l’ombre [17]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Kamentsky
LA
,
Melamed
MR
,
Derman
H
. Spectrophotometer: new instrument for ultrarapid cell analysis . Science.
1965; ; 150 : :630.–631. 2.
Kamentsky
LA
,
Melamed
MR
. Spectrophotometric cell sorter . Science.
1967; ; 156 : :1364.–1365. 3.
Bonner
WA
,
Hulett
HR
,
Sweet
RG
,
Herzenberg
LA
. Fluorescence activated cell sorting . Rev Sci Instrum.
1972; ; 43 : :404.–409. 4.
Köhler
G
,
Milstein
C
. Continuous cultures of fused cells secreting antibody of predefined specificity . Nature.
1975; ; 256 : :495.–497. 5.
Coons
AH
,
Kaplan
MH
. Localization of antigen in tissue cells; improvements in a method for the detection of antigen by means of fluorescent antibody . J Exp Med.
1950; ; 91 : :1.–13. 6.
The molecular probes handbook. A guide to fluorescent probes and labeling technologies. , 11th ed . Life Technologies Corporation; , 2010. 7.
Grégori
G
,
Patsekin
V
,
Rajwa
B
, et al.
Hyperspectral cytometry at the single-cell level using a 32-channel photodetector . Cytometry.
2012;; 81A : :35.–44. 8.
Novo
D
,
Grégori
G
,
Rajwa
B
. Generalized unmixing model for multispectral flow cytometry utilizing nonsquare compensation matrices . Cytometry.
2013;; 83A : :508.–20. 9.
Pauly
JL
,
Allison
EM
,
Hurley
EL
, et al.
(2005) Fluorescent human lung macrophages analyzed by spectral confocal laser scanning microscopy and multispectral cytometry . Microsc Res Tech.
2005; ; 67 : :79.–89. 10.
Schmutz
S
,
Valente
M
,
Cumano
A
,
Novault
S
. Spectral cytometry has unique properties allowing multicolor analysis of cell suspensions isolated from solid tissue . PLoS One.
2016; ; 8 : :11.. 11.
Futamura
K
,
Sekino
M
,
Hata
A
, et al.
Novel full-spectral flow cytometry with multiple spectrally-adjacent fluorescent proteins and fluorochromes and visualization of in vivo cellular movement . Cytometry.
2015; ; 87 : :830.–842. 12.
Bendall
SC
,
Simonds
EF
,
Qiu
P
, et al.
Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum . Science.
2011; ; 332 : :687.–696. 13.
Bendall
SC
,
Nolan
GP
. From single cells to deep phenotypes in cancer . Nat Biotechnol.
2012; ; 30 : :639.–647. 14.
Cosma
A
,
Le Grand
R
. La couleur du métal, brève introduction à la cytométrie de masse . Med Sci (Paris).
2011; ; 27 : :1072.–1074. 15.
Tricot
S
,
Meyrand
M
,
Sammicheli
C
, et al.
Evaluating the efficiency of isotope transmission for improved panel design and a comparison of the detection sensitivities of mass cytometer instruments . Cytometry A.
2015; ; 87 : :357.–368. 16.
Anchang
B
,
Hart
TD
,
Bendall
SC
, et al.
Visualization and cellular hierarchy inference of single-cell data using SPADE . Nat Protoc.
2016; ; 11 : :1264.–1279. 17.
Masaeli
M
,
Gupta
D
,
O’Byrne
S
, et al.
Multiparameter mechanical and morphometric screening of cells . Sci Rep.
2016; ; 6 : :37863.. |