Vignettes (Photos : © Brian Summers [Jeffrey C. Hall] - © Scott Eisen, [Michael Rosbash] - © Mario Morgado [Michael W. Young]).
« The Darwinian Demon has certainly had plenty of physiologic oscillations to work with, because his commonest device in installing regulators – from the control of heartbeat to that of protein synthesis – is negative feedback. And one of the innate tendencies of such feedback systems is to oscillate » 1 [ 1]
Ne boudons pas notre plaisir, et soulignons aussi que ce prix Nobel, après plusieurs autres (dont celui partagé par Jules Hoffmann en 2011 pour ses recherches sur l’immunité innée, [ 2]) (→) récompense à nouveau la drosophile comme organisme modèle.
(→) Voir l’article Nobel de E. Jouvin Marche, m/s n° 11, novembre 2011, page 1025
L’un d’entre nous, François Rouyer, ayant publié récemment une revue précise et complète sur les horloges circadiennes [ 3], nous allons simplement décrire ici quelques étapes emblématiques du parcours de ces chercheurs qui justifie le choix du comité Nobel.
La première observation d’un rythme circadien avant l’heure2 a été publiée en 1729 par Jean-Jacques d’Ortous de Mairan, astronome et « géomètre » de l’Académie royale des sciences [ 4]. Elle portait sur une plante, identifiée comme « la sensitive », dont les feuilles se repliaient à la nuit tombante pour se déplier le matin venu, même quand elle était placée à l’abri complet de la lumière du jour… Ces mouvements foliaires possédaient donc une propriété fondamentale de tout rythme circadien : persister en obscurité constante avec une période proche de 24 h (d’où « circadien » : d’environ un jour).
Toutefois, de Mairan n’a pas interprété ce résultat en termes d’horloge interne à la plante, mais comme la démonstration d’une influence subtile du soleil, que sa « Sensitive » sentirait « sans le voir en aucune manière »3. Des thèses semblables étaient encore largement défendues au milieu du XXe siècle, malgré des expériences (notamment sur des drosophiles… déjà !) et des réflexions, comme celles de Colin Pittendrigh [ 5], qui suggéraient l’existence d’un mécanisme biologique interne, donnant l’heure de manière autonome et de façon indépendante des comportements qu’il contrôle.
Le point de non-retour a été atteint lors de la publication, en 1971, par Ronald Konopka et Seymour Benzer, dans le laboratoire de ce dernier au California institute of technology, des premiers mutants de rythme obtenus chez la mouche [ 6]. Par mutagenèse chimique, ils ont en effet isolé des lignées mutantes de drosophiles dans lesquelles deux rythmes circadiens très étudiés, celui de l’activité locomotrice des mouches adultes et celui de leur émergence (ou éclosion) à la fin de la métamorphose, étaient affectés de la même façon. Dans deux de ces lignées, la période, normalement proche de 24 h, était altérée, raccourcie à 20 h pour l’une, allongée à 30 h pour l’autre. Une troisième lignée était devenue arythmique : les rythmes étaient en effet abolis. Chacune de ces lignées s’était avérée porteuse d’une mutation différente, touchant pourtant un même gène, qui fut baptisé period.
Ces résultats allaient bien au-delà de la première mise en évidence d’un gène d’horloge. Il s’agissait, en effet, du premier gène identifié dont des mutations avaient des effets hautement spécifiques sur le comportement animal. Les mutations period ne semblaient pas affecter d’autres fonctions que la rythmicité4. Une génétique fine du comportement devenait ainsi concevable. Pourtant, la génétique de l’horloge ne progressa quasiment pas pendant la décennie suivante, faute d’outils appropriés pour remonter à la séquence moléculaire du gène et donc, de la protéine qui en est le produit de traduction. C’est l’émergence rapide de la génétique moléculaire, vers la fin des années 1970, qui va débloquer la situation. Pour des raisons différentes (et somme toute assez contingentes [ 7- 9]), Michael Rosbash, à l’université Brandeis, près de Boston, et Michael Young, à l’université Rockefeller, à New York, vont tenter d’appliquer ces nouveaux outils, qu’ils sont parmi les premiers à maîtriser, au clonage du gène period. Young était déjà un généticien de la drosophile, pas Rosbash, qui associe son expertise en acides nucléiques à celle du drosophiliste Jeff Hall, ancien post-doc dans le laboratoire de Benzer (où il s’était lié d’amitié avec Konopka). Amis depuis leur recrutement quasi simultané à Brandeis, au milieu des années 1970, Hall et Rosbash deviennent opportunément, mais bien involontairement, voisins d’étage en 1982, ce qui va beaucoup favoriser leur collaboration [7] …
Les deux groupes de chercheurs, près de Boston pour l’un, à New York pour l’autre, se retrouvent alors dans une compétition acharnée pour le clonage du gène. Il s’agit d’un véritable tour de force technologique, utilisant une méthode alors toute récente (et aujourd’hui obsolète !), au nom évocateur, la « marche sur le chromosome »5. Leurs publications se suivent à quelques mois d’écart seulement, fin 1984 [ 10- 12]. Avec les techniques alors disponibles, il faudra près de 2 ans pour obtenir la séquence du gène period, et donc de la protéine correspondante [ 13, 14]. Cette séquence est décevante : elle ne ressemble pas à grand-chose de connu et ne fournit aucune indication sérieuse quant à la fonction de la protéine. Pire encore, elle lance les laboratoires concurrents, trop préoccupés par leur rivalité, comme ils le reconnaîtront ensuite, sur de fausses pistes (suggérant, par exemple, que la protéine Period interviendrait dans les interactions entre cellules).
Le brouillard ne commencera à se dissiper qu’en 1988, lorsque d’autres drosophilistes, travaillant sur le développement du système nerveux, identifient une similarité, réelle cette fois-ci, entre la séquence de la protéine Period et celle d’un facteur de transcription, Single-minded [ 15]. Puis, Paul Hardin, un post-doc du laboratoire de Rosbash (toujours en collaboration avec Jeff Hall), montre que la transcription du gène period suit elle-même un cycle circadien [ 16, 17]. Pourquoi cela n’avait-il pas été découvert plus tôt ? En grande partie parce que jusque-là, les ARN messagers étaient extraits de mouches entières, mâles et femelles confondues. Or les ovaires expriment fortement Period, de jour comme de nuit (on ignore encore la fonction de cette expression ovarienne), masquant ainsi le rythme circadien de la protéine dans d’autres tissus, en particulier dans le cerveau et les yeux. La découverte de Hardin tenait à ce qu’il avait préparé les ARN à partir des têtes des insectes, uniquement…
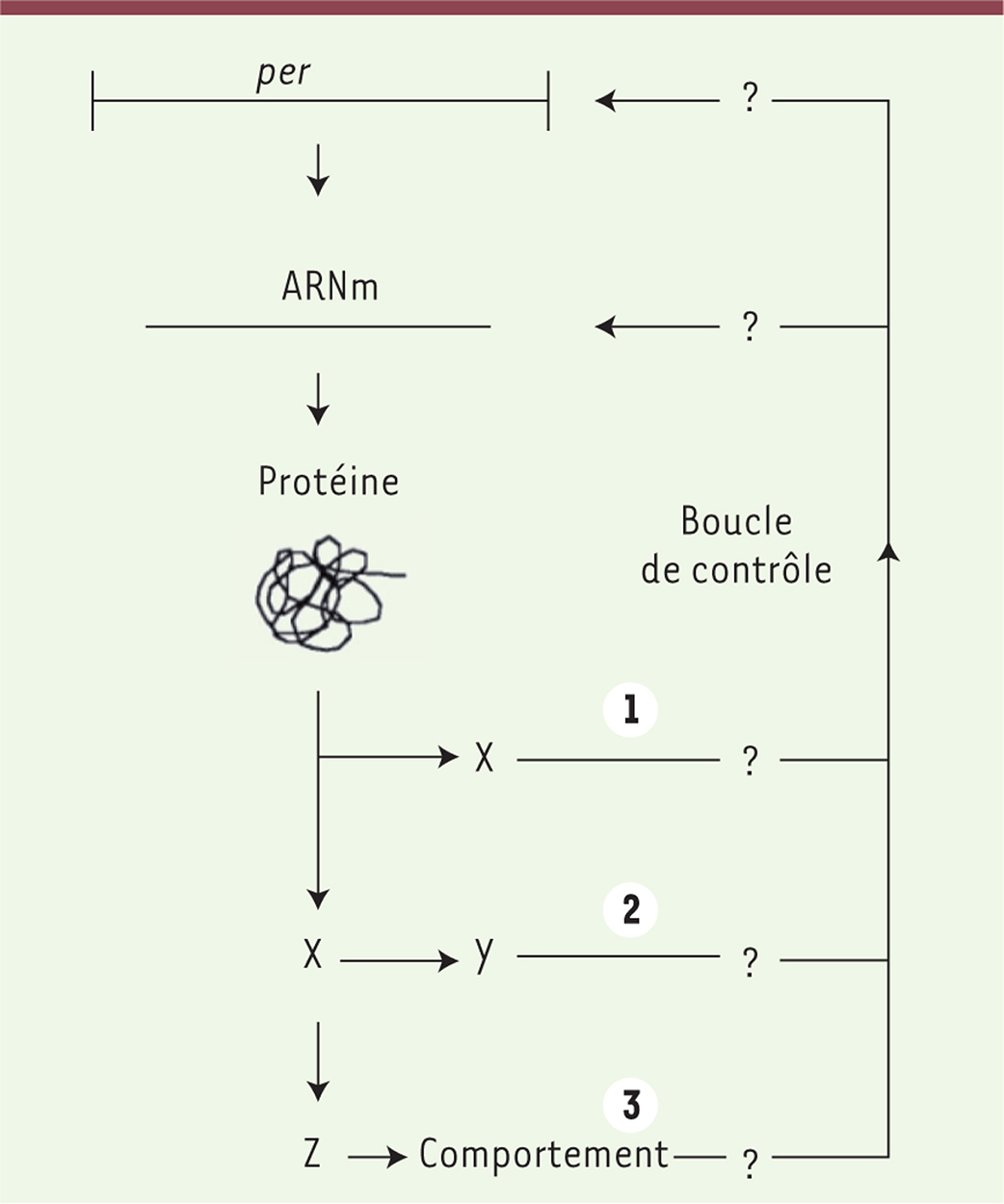
Mais ce n’était pas tout : le rythme de l’ARNm de Period était affecté par les mutations dans le gène period lui-même, et de la même manière que les rythmes comportementaux [16]. Cela suggérait que le rythme d’expression de period était responsable des autres rythmes, et que la protéine (dont la quantité suit, elle aussi, un cycle circadien) contrôlait l’expression de son propre gène. On avait donc affaire à un phénomène de rétroaction. Qui plus est, la quantité d’ARNm period baisse quand la quantité de protéine Period augmente : autrement dit, la protéine Period inhibe l’expression du gène dont elle est le produit de traduction [ 18]. Ces données, et d’autres, qu’il est impossible de présenter toutes ici, ont conduit Hall et Rosbash à proposer un modèle de boucle de rétroaction transcriptionnelle négative qui est encore largement accepté aujourd’hui (Figure 1) et dont le principe, au moins, est valable chez tous les organismes eucaryotes, humains compris.
| Figure 1.
Modèle proposé par Hardin et al. en 1990 [16] pour expliquer les effets des mutants du gène per sur l’ARN messager. Les auteurs proposaient l’existence d’une boucle de contrôle retour agissant de façon transcriptionnelle ou post-transcriptionnelle. Par ailleurs, ils envisageaient des effets directs ou indirects de la protéine Period (codée par le gène per) dont la fonction biochimique était inconnue. La suite montrera que Per joue un rôle direct de répresseur transcriptionnel. Dans la figure originale, X représente le résultat de l’activité de per. Per était supposée agir directement (1) ou indirectement par l’intermédiaire d’un composant Y (2), ou au travers du comportement de l’animal (3). Z représente un intermédiaire intervenant entre l’activité de per et le comportement de l’animal. |
De son côté, le laboratoire de Michael Young identifie un second gène d’horloge, timeless, dans un crible génétique beaucoup plus large que celui de Konopka et Benzer6 [ 19]. Le gène timeless code un partenaire de la protéine Period (partenaire appelé Timeless), dont elle contrôle l’entrée dans le noyau [ 20, 21]. Entre-temps, les relations tendues entre les « frères ennemis » se sont muées en collaboration, qui débouche sur une première publication commune chargée de symbole : elle montre que la protéine Timeless est indispensable à l’accumulation de son partenaire Period, tout en jouant un rôle spécifique dans la réponse de l’horloge à la lumière [ 22]. L’effet de la lumière met en exergue la régulation post-transcriptionnelle, découverte dans le laboratoire de Rosbash [18, 23], et acteur majeur du fonctionnement de l’horloge [ 24, 25].
1997-1998 sont des années charnières pour la génétique moléculaire des horloges circadiennes : d’abord avec la démonstration que leurs rouages étaient bien conservés dans le règne animal - identification de gènes period chez les mammifères (il y en a même trois, suite à des duplications réitérées du génome au cours de l’évolution), par homologie avec le gène de drosophile [ 26- 28] ; puis identification des gènes Clock et cycle. L’isolement du premier mutant du gène Clock chez la souris, par l’équipe de Joseph Takahashi [ 29], constitue un tour de force peut-être plus impressionnant encore que la découverte initiale de period. Rosbash et Hall identifient ensuite l’homologue de Clock chez la drosophile [ 30], ainsi que son partenaire cycle [ 31], qui avait été identifié précédemment chez la souris sous le nom de Bmal1, sans connaître sa fonction. Les protéines Clock et Cycle, traduites à partir de ces gènes, sont des activateurs transcriptionnels « classiques », dits à domaine bHLH (basic helix-loop-helix). Elles s’associent en dimères qui activent la transcription de nombreux gènes, parmi lesquels period et timeless [31, 32]. Les protéines Period et Timeless s’associent à leur tour avec le dimère Clock/Cycle pour en inhiber l’activité, et donc réduire leur propre expression. Le modèle de boucle de rétroaction transcriptionnelle négative était ainsi… bouclé. Comme le rappelle Jeff Hall dans une récente interview [ 33], l’identification des gènes homologues de period chez les mammifères, suivie de ceux de Clock et cycle, a fortement relancé l’intérêt pour la chronobiologie moléculaire, mais a aussi mis un terme à la quasi-absence de compétition extérieure pour Hall, Rosbash et Young !
Cette même année 1998 marque aussi l’apparition dans la littérature scientifique d’un tout nouvel et surprenant acteur moléculaire de la saga circadienne, le cryptochrome. Les laboratoires de Brandeis montrent en effet qu’un homologue de cette protéine photoréceptrice, découverte au début des années 1990 chez les plantes (après des décennies de recherches infructueuses, qui expliquent ce nom fleurant le mystère…), existe chez la drosophile [ 34]. Elle y contribue à la mise à l’heure des horloges circadiennes par l’alternance jour-nuit. Des cryptochromes se révéleront d’ailleurs présents chez tous les animaux, où ces « photorécepteurs » peuvent aussi servir de rouages à l’horloge7. Il est maintenant bien établi qu’ils interviennent dans la boucle de rétroaction négative, indépendamment de la lumière, en remplaçant Timeless chez les mammifères, comme partenaire des protéines Period.
Jusqu’ici nous n’avons considéré que la dimension moléculaire des horloges circadiennes. Tous les mécanismes évoqués sont cellules-autonomes : ils pourraient être à l’œuvre à l’intérieur de n’importe quelle cellule, prise isolément. Mais dans lesquelles sont-ils effectivement présents ? Et les interactions entre cellules jouent-elles un rôle dans le fonctionnement des horloges ? Même si le comité Nobel ne l’a pas mentionné pour l’attribution du prix, Hall, Rosbash, Young et leurs équipes ont aussi beaucoup contribué à répondre à ces questions. Ils ont, par exemple, dans un premier temps, identifié les neurones dans le cerveau et la rétine des drosophiles où le gène period est exprimé [ 35, 36], et ils ont commencé à déchiffrer les interactions entre ces neurones qui déterminent précisément le comportement [ 37].
Toutefois, un des plus grands apports de la chronobiologie moléculaire a sans doute été la découverte de la multiplicité des horloges, au sein de chaque organisme. Bien loin d’être spécifiques à quelques cellules nerveuses, les gènes d’horloge (period, Clock, cycle, etc.) sont en effet exprimés dans pratiquement tous les organes et tissus étudiés. Chez les mammifères, on peut même parler d’orchestre circadien, avec une horloge « centrale » (les noyaux suprachiasmatiques de l’hypothalamus) qui dirige des horloges « périphériques », en leur relayant le signal de mise à l’heure solaire transmis par la rétine. Toute cacophonie entre ces horloges peut avoir des effets néfastes. À court terme, ce sont les désagréments du décalage horaire. Si la cacophonie se prolonge, ou se répète souvent sur plusieurs années, elle peut induire ou contribuer à des pathologies, comme le diabète, l’obésité, des syndromes neurodégénératifs, et probablement certains cancers [ 38- 40]. En plus, nombreux sont les travaux montrant l’impact des horloges circadiennes sur la santé. Pour n’en citer qu’un récent : chez la souris, la cicatrisation des blessures cutanées est plus rapide pendant la nuit (période active de cet animal nocturne) que pendant le jour, probablement à cause du contrôle circadien de la dynamique du cytosquelette d’actine [ 41], ce qui évoque fortement l’observation d’une guérison plus rapide de brûlures subies pendant le jour que pendant la nuit chez les humains (organismes diurnes).
Peut-être que le déchiffrage de la partition circadienne chez les mammifères – comment les horloges communiquent entre elles, comment elles contrôlent l’ensemble de la physiologie, quelles sont les conséquences de leur perturbation sur la santé – pourrait faire l’objet d’un nouveau prix Nobel, dans quelques décennies… ou quelques années !