| |
| Med Sci (Paris). 34(8-9): 693–700. doi: 10.1051/medsci/20183408016.Les multiples rôles de la protéine Core du virus de l’hépatite B Nouvelles pistes de recherche et enjeux thérapeutiques Hélène Chabrolles,1 Thomas Lahlali,1 Héloïse Auclair,1 and Anna Salvetti1* 1Centre de recherche en cancérologie de Lyon (CRCL), Inserm U1052, 151, cours Albert Thomas, 69003Lyon, France |
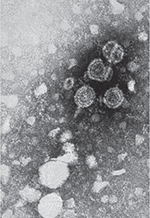
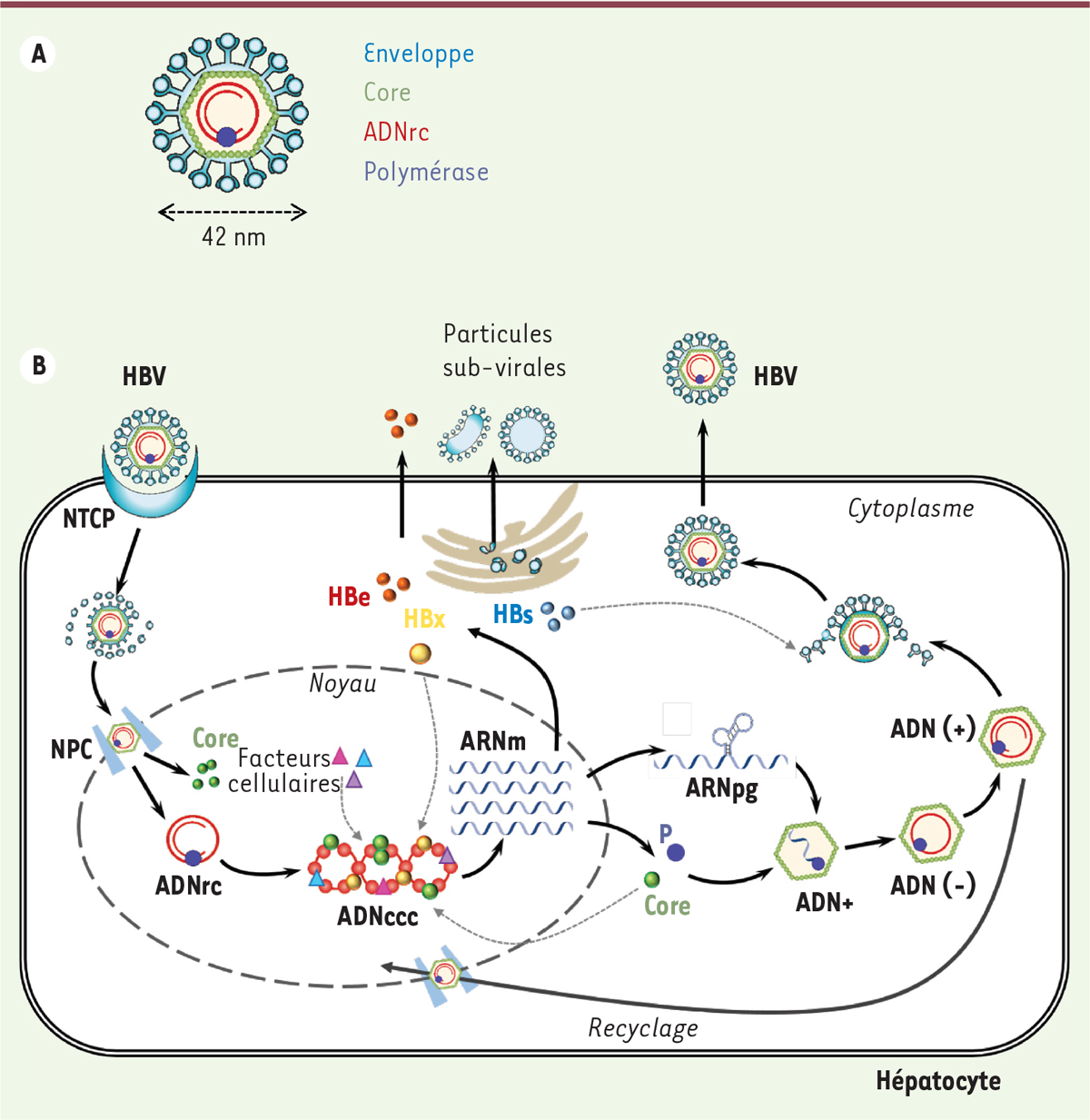
Vignette (Photo © Centers for Disease Control and Prevention). La transmission du virus de l’hépatite B (HBV) s’effectue par contact étroit (voie sanguine, sexuelle, périnatale et salivaire) et conduit à une infection chronique chez environ 90 % des enfants et 10 % des adultes ayant été en contact avec l’HBV, ce qui représente plus de 250 millions de porteurs chroniques dans le monde. Ces derniers présentent un risque très important de développer de graves complications hépatiques, telles qu’une cirrhose et le cancer du foie (carcinome hépatocellulaire ou HCC). La proportion de personnes infectées est particulièrement importante dans certaines régions, notamment d’Asie et d’Afrique subsaharienne [1]. La particule infectieuse d’HBV, ou particule de Dane, mesure environ 42 nm de diamètre (Figure 1A). Elle est composée d’une enveloppe, constituée d’une bicouche lipidique dans laquelle sont enchâssées 3 glycoprotéines virales, à l’intérieur de laquelle se trouve une capside icosahédrique qui contient le génome viral. Le génome viral est composé d’une molécule d’ADN relâchée circulaire partiellement double brin (ADNrc) de 3,2 Kb, liée de façon covalente à la polymérase virale (P). Elle comporte 4 cadres de lecture (ORF) chevauchants qui codent 7 protéines virales : les protéines d’enveloppe L, M et S (antigène HBs ou AgHBs), la protéine de capside Core (ou HBc), l’antigène HBe (AgHBe), la polymérase virale P, et la protéine HBx [2].
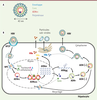 | Figure 1.
Structure de la particule infectieuse d’HBV et cycle viral. A. Structure de la particule infectieuse d’HBV, ou particule de Dane. B. Cycle réplicatif d’HBV. La réplication d’HBV débute avec l’entrée du virus dans l’hépatocyte par endocytose via le récepteur NTCP (sodium taurocholate cotransporting polypeptide). La nucléocapside est libérée dans le cytoplasme et transportée jusqu’aux pores nucléaires (NPC) où elle se désassemble pour libérer l’ADNrc ainsi que la protéine de capside dans le noyau. L’ADNrc est alors converti en ADNccc qui est chromatinisé par des facteurs cellulaires et viraux (HBx et Core). Ce minichromosome est le support de la transcription virale. Il permet la synthèse des ARNm viraux et de l’ARNpré-génomique (ARNpg) qui est encapsidé avec la polymérase virale (P) par les nouvelles protéines Core produites. La transcription inverse de l’ARNpg en ADNrc se réalise à l’intérieur de la capside, d’abord avec la formation du brin d’ADN négatif (ADN-), puis du brin complémentaire positif (ADN+). Les nucléocapsides néo-synthétisées sont soit recyclées vers le noyau, soit enveloppées et secrétées. Des particules vides et des antigènes HBs et HBe (particules subvirales) sont aussi secrétés en même temps que des particules infectieuses. |
La réplication du virus survient uniquement dans les hépatocytes dans lesquels il pénètre via le transporteur d’acides biliaires NTCP (sodium taurocholate cotransporting polypeptide) [3] (Figure 1B). Après son internalisation dans le cytoplasme, la nucléocapside est transportée vers le noyau où elle se désassemble pour libérer la protéine Core et l’ADNrc. Dans le noyau, l’ADNrc est « réparé » pour former un ADN double brin circulaire clos de façon covalente (l’ADNccc) qui s’associe à des histones et d’autres protéines régulatrices d’origine cellulaire et virale. Ce mini-chromosome viral est responsable de la persistance d’HBV dans les hépatocytes. Il est le support de la transcription virale et permet la synthèse des ARN messagers du virus et de l’ARN pré-génomique (ARNpg) qui est encapsidé avec la polymérase virale dans les capsides en cours d’assemblage dans le cytoplasme de l’hépatocyte. L’ARNpg est ensuite converti en ADNrc (par transcription inverse) par la polymérase virale au sein des capsides néoformées. Les nucléocapsides matures sont alors soit enveloppées et sécrétées afin de permettre la propagation du virus, soit dirigées vers le noyau, pour former de nouvelles molécules d’ADNccc, un phénomène appelé « recyclage » [2]. Chez la majorité des personnes, l’infection aiguë par HBV est asymptomatique et rapidement résolue, grâce à l’induction d’une réponse immunitaire efficace. Une proportion variable de sujets n’élimine cependant pas spontanément le virus. Ils entrent alors dans un stade d’infection chronique, qui progresse sur plusieurs décennies selon plusieurs phases, qui ne sont pas nécessairement successives, de durée variable selon le patient, et qui se distinguent par le niveau de réplication virale (évalué par les taux d’ADN viral et d’antigènes HBe et HBs sériques), l’apparition séquentielle d’anticorps anti-AgHBe puis anti-AgHBs (aussi appelée séroconversion HBe et HBs) et par l’état d’inflammation du foie (mesuré par les transaminases sériques). Succinctement (pour plus de détails, voir [4]), l’évolution des patients infectés de façon chronique par HBV comporte, généralement, une première phase caractérisée par une réplication virale forte et une réponse immunitaire adaptative faible ou indétectable (à l’exception éventuellement d’une réponse humorale anti-HBc). Suivent ensuite des phases au cours desquelles une compétition s’engage entre d’une part, le système immunitaire, avec la mise en place d’une réponse lymphocytaire de type T CD8 et l’apparition d’anticorps dirigés contre AgHBe, et d’autre part, le virus qui contourne cette réponse, notamment par l’émergence de mutants d’échappement dépourvus d’antigène HBe. Chez la très grande majorité des patients, la réponse immunitaire développée contre les cellules infectées permet de contrôler, au moins de façon transitoire, la réplication virale. Elle ne conduit que rarement à l’élimination complète du virus du foie des patients en raison de la persistance de l’ADNccc dans les cellules et de sa capacité à réactiver la réplication virale. L’émergence d’une réponse immunitaire se traduit également par l’augmentation des transaminases hépatiques, signe d’une nécro-inflammation hépatique, qui accroît le risque de progression vers la fibrose hépatique puis la cirrhose et l’HCC [2, 5]. Depuis le début des années 1980, un vaccin prophylactique efficace chez plus de 90 % des sujets vaccinés est disponible et a permis de réduire l’incidence des infections par HBV dans les pays développés [6]. Cependant, la couverture vaccinale insuffisante dans de nombreuses régions endémiques (en particulier celle des nourrissons nés de mères chroniquement infectées) et le grand nombre de porteurs chroniques, laissent au virus encore de nombreuses décennies de persistance et de propagation, en l’absence de nouvelles stratégies curatives. Les traitements disponibles, à base d’analogues de nucléosides (NUC) et d’interféron-α pégylé (PEG-IFN), permettent de contrôler la réplication virale mais pas d’éliminer l’ADNccc des cellules infectées. Les NUC inhibent la polymérase du virus et donc la synthèse de l’ADN viral au sein des nucléocapsides. Ils réduisent efficacement la charge virale et sont bien tolérés, mais ils doivent être administrés à vie. Le PEG-IFN stimule l’immunité anti-HBV. Il agit également sur d’autres étapes du cycle viral, notamment en diminuant l’activité transcriptionnelle du génome du virus. Il est administré pour une durée limitée, et peut parfois conduire à une séroconversion AgHBs. Le PEG-IFN n’est efficace que chez 25 % des patients éligibles à ce traitement (en fonction de la phase de la maladie, des génotypes viraux, etc.), et il est souvent mal toléré [7]. Le développement de nouvelles thérapies anti-HBV est donc primordial. De par son rôle structural majeur, la protéine Core représente une cible de choix pour le développement de nouvelles molécules à activité antivirale. Des données récentes indiquent qu’au-delà de son activité structurale, Core possèderait également des fonctions régulatrices importantes dans la réplication virale et le devenir de l’hépatocyte. L’étude de ces fonctions paraît donc déterminante, non seulement pour mieux comprendre le mode d’action des traitements existants, mais aussi pour développer de nouvelles molécules capables d’interférer spécifiquement avec les fonctions régulatrices de Core. |
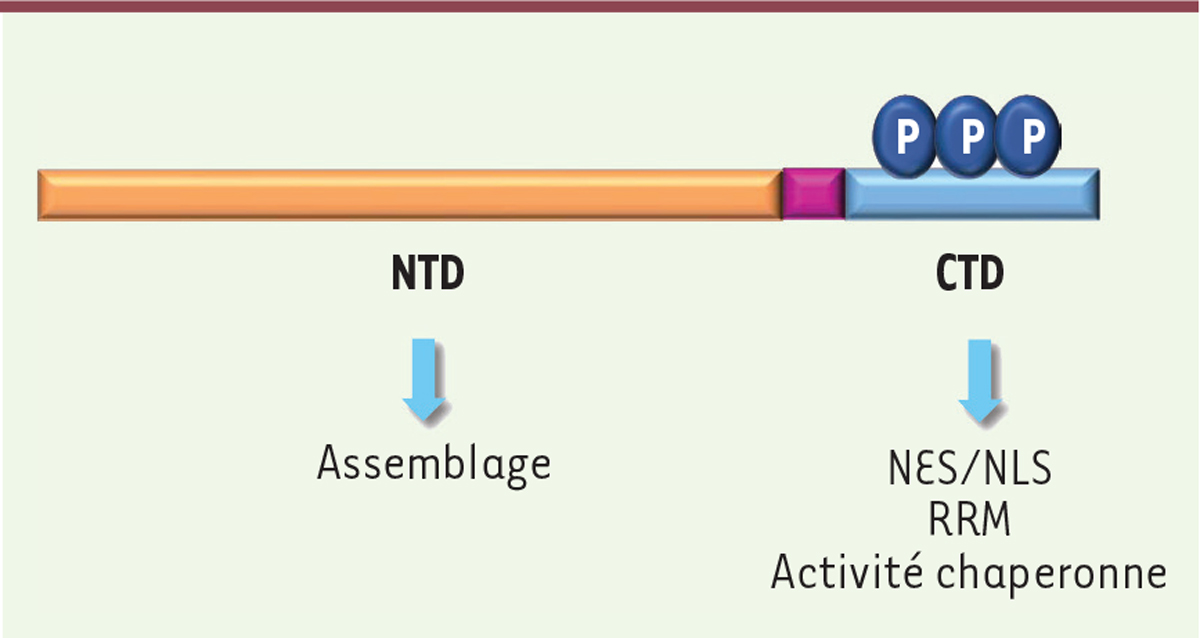
Rôle de Core dans la formation et le devenir des capsides virales La protéine Core qui correspond à l’unité structurale de la capside, est composée de 183 à 185 acides aminés (aa) selon le génotype d’HBV. Cette protéine est constituée de deux domaines fonctionnels distincts séparés par une courte région charnière (Figure 2). Le domaine N-terminal (NTD : aa 1 à 140) est essentiel pour l’assemblage des capsides et pour leur enveloppement [8]. Le domaine C-terminal (CTD : aa 151 à 183/185), riche en arginines et en sérines, n’est pas essentiel pour l’assemblage des capsides, mais présente différentes régions régulatrices [9]. La petite région charnière (ou linker : aa 141 à 150), qui sépare le NTD du CTD, pourrait aussi intervenir lors de l’étape d’encapsidation de l’ARNpg [10]. Les séquences de localisation (NLS [nuclear localization signal]) et d’export (NES [nuclear export signal]) nucléaires présentes dans le CTD de Core, permettent les transferts de la protéine entre le cytoplasme, lieu d’assemblage des capsides, et le noyau de la cellule. L’ensemble des fonctions de Core sont régulées par des modifications post-traductionnelles, en particulier des phosphorylations, au niveau des résidus sérine du CTD [11].
 | Figure 2.
Domaines fonctionnels de la protéine Core. La protéine Core est composée de trois domaines : le domaine N-terminal (NTD), qui intervient dans l’assemblage de Core en dimères et multimères ; le domaine charnière (en violet) fait le lien avec le domaine C-terminal (CTD) responsable des fonctions régulatrices de Core. Le CTD est riche en arginines et en sérines (pouvant être phosphorylées Ⓟ, notamment lors de l’assemblage de la capside) et présente un motif de reconnaissance des ARN (RRM). Il présente aussi des séquences de localisation - NLS (nuclear localization signal) - et d’export - NES (nuclear export signal) nucléaire qui lui permettent de faire la navette entre noyau et cytoplasme. Le CTD confère aussi à Core ses propriétés de chaperonne d’acides nucléiques. |
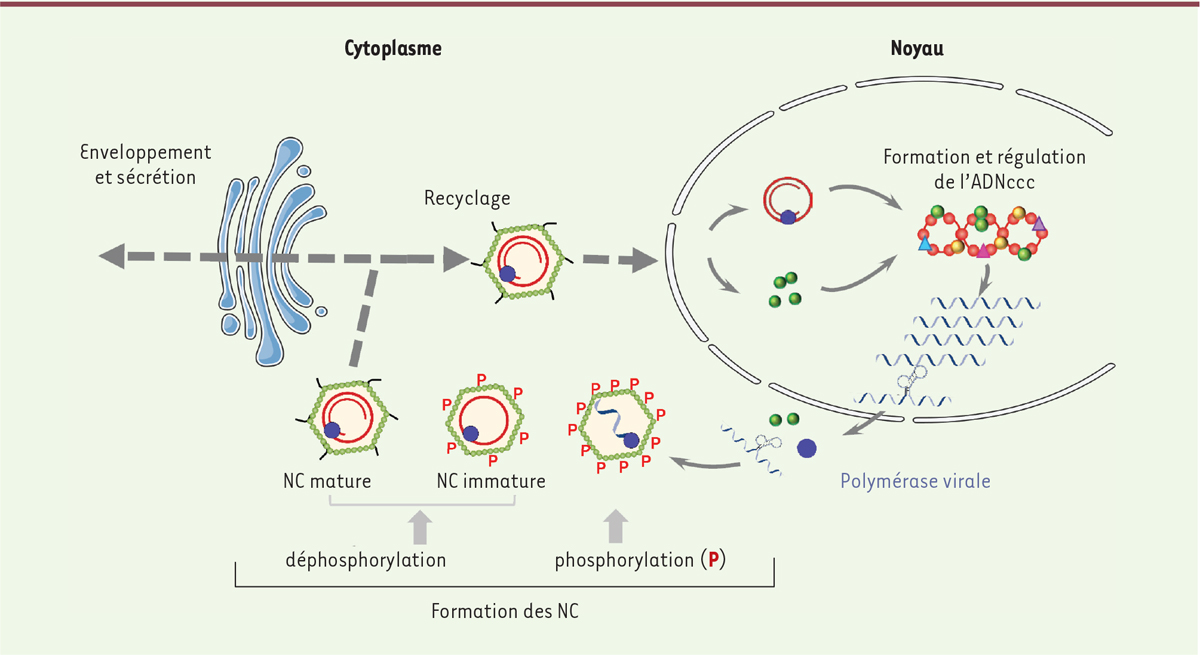
Lors de la formation de capsides, la protéine Core s’assemble spontanément en dimères, puis en multimères et, enfin, en capsides icosahédriques [8]. L’ARNpg, qui doit s’associer à la polymérase virale pour que l’encapsidation soit initiée, interagit avec le domaine CTD hyperphosphorylé de Core. L’activité chaperonne d’acides nucléiques de Core permet de maintenir un bon repliement de l’ARNpg et sa transcription inverse en ADNrc [11] (Figure 3).
 | Figure 3.
Formation et devenir des nucléocapsides d’HBV. Dans le noyau, la protéine Core et des facteurs de l’hôte se fixent sur l’ADNccc et régulent sa transcription. Parmi les 5 ARNm transcrits, seul l’ARNpg, associé à la polymérase virale, est encapsidé. Les nucléocaspides (NC) immatures ainsi formées sont hyperphosphorylées. Elles sont ensuite déphosphorylées, parallèlement à la transcription inverse de l’ARNpg en ADNrc, produisant les capsides matures. Celles-ci peuvent être enveloppées puis secrétées, ou recyclées vers le noyau et alimenter le « pool » d’ADNccc. |
|
Régulation des fonctions de Core par son degré de phosphorylation L’hyperphosphorylation de Core est donc associée à l’étape d’encapsidation de l’ARNpg à l’origine de la formation de nucléocapsides immatures. Par la suite, parallèlement à la transcription inverse de l’ARNpg en ADNrc, le CTD de Core est déphosphorylé et externalisé à la surface de la capside. Il devient alors accessible pour interagir avec des protéines cellulaires, dont celles impliquées dans le trafic intracellulaire. Ces nucléocapsides devenues matures interagissent avec les protéines d’enveloppe virale, pour être enveloppées et secrétées, ou avec les protéines des pores nucléaires (NPC), pour être recyclées vers le noyau de la cellule [11] (Figure 3). Les phosphatases qui déphosphorylent le CTD de Core lors de la maturation des capsides et de la transcription inverse n’ont pas encore été identifiées. Les kinases qui participent à sa phosphorylation restent également mal définies et font encore l’objet de controverses. Un rôle a été montré pour les protéines kinases A et C (PKA/Akt, PKC), ainsi que pour les kinases dépendant des cyclines 1 et 2 (cdk1,2). Des kinases de protéines SR (SRPK [SR protein-specific kinases]), qui contrôlent l’épissage des ARNm, ont été aussi impliquées dans la phosphorylation de Core [11]. Étant donné l’homologie qui existe entre le CTD de Core et le domaine riche en sérines et arginines des protéines SR [12], il n’est pas surprenant que Core puisse être phosphorylée par les kinases SRPK1 et 2. Récemment, notre équipe a montré que Core était également un substrat de la Polo kinase-1 (PLK1), qui intervient dans le contrôle du cycle cellulaire et est surexprimée dans certains cancers, notamment ceux induit par HBV [13]. |
Interaction de Core avec le noyau cellulaire La séquence de localisation nucléaire (NLS) du CTD de Core permet l’adressage des nucléocapsides d’HBV présentes dans le cytoplasme de la cellule après l’étape d’entrée ou après assemblage du virus vers la membrane nucléaire. Deux modèles décrivant la localisation exacte du désassemblage de la capside ont été proposés. Dans le premier modèle, la capside se désassemblerait dans le cytoplasme, à proximité du pore nucléaire, et libérerait l’ADNrc alors rapidement pris en charge par les importines pour traverser la membrane nucléaire. Le deuxième modèle prévoit qu’après liaison de la capside aux importines, en particulier l’importine β, le complexe se lierait à la nucléoporine Nup153, un des constituants du pore nucléaire. Le désassemblage surviendrait, dans ce cas, dans le panier nucléaire, qui se trouve sur la face interne de la membrane nucléaire, et conduirait à la libération, dans le nucléoplasme, de l’ADNrc lié à la polymérase et de dimères de Core [14]. Ce deuxième modèle pourrait expliquer la très faible réponse immunitaire innée provoquée par l’infection par HBV, du fait de l’absence d’exposition du génome viral aux récepteurs senseurs d’acides nucléiques présents dans le cytoplasme [15]. Dans des hépatocytes infectés en culture ou in vivo, la protéine Core présente fréquemment une localisation nucléaire. Ceci suggère qu’elle pourrait s’accumuler dans ce compartiment cellulaire, indépendamment de la formation de nucléocapsides, en particulier lorsque le virus se réplique activement [16]. La présence de Core est aussi observée dans le noyau d’hépatocytes qui expriment la protéine en l’absence des autres constituants viraux. Ces observations ont conduit plusieurs groupes à s’intéresser aux fonctions nucléaires de Core lors de l’établissement de l’infection par HBV. |
Fonctions nucléaires de Core Des études réalisées dans des hépatocytes in vitro ont montré que très rapidement après l’infection des cellules par HBV, la protéine Core, ainsi que des protéines cellulaires, se fixent à l’ADNccc nouvellement formé pour participer à la formation du minichromosome viral (Figure 3). En particulier, Core se lie aux îlots CpG de l’ADNccc et module l’espacement des nucléosomes [17]. Sa présence a également été corrélée à un état de transcription actif de l’ADNccc [18]. La réduction des formes monomériques et dimériques de Core induit une diminution de sa liaison à l’ADNccc et de la production des ARN et des protéines d’HBV [19]. Récemment, il a été montré que l’arginine méthyltransférase 5 (PRMT5) exerce un effet négatif sur la transcription virale, en induisant des modifications épigénétiques répressives et en inhibant l’encapsidation de l’ARNpg [20]. PRMT5 interagit avec Core : elle régulerait ses fonctions et sa localisation en provoquant des modifications post-traductionnelles [21]. L’ensemble de ces études indiquent que Core jouerait un rôle important dans la régulation de la transcription virale. La protéine Core a été aussi impliquée dans la régulation de certaines fonctions cellulaires, en agissant au niveau transcriptionnel ou post-transcriptionnel. Elle se lie en effet aux promoteurs de nombreux gènes cellulaires (par exemple ceux activés en réponse à l’interféron) et pourrait inhiber leur expression [22]. Core interagit aussi avec les facteurs cellulaires E2F1 (facteur de transcription) et DR5 (ou TRAIL[TNF-related apoptosis-inducing ligand]-R2, un « récepteur de mort » impliqué dans l’apoptose) et inhibe leur fonction [23, 24]. Core perturbe également le métabolisme des ARNm en mobilisant le complexe de transcription et d’export des ARNm TREX (transcription ARNm export complexe). En particulier, Core interagit avec les facteurs d’export des ARN, NXF1-p15 (nuclear RNA export factor 1) et TREX, via sa région NES (nuclear export signal), présents dans son CTD, qui se fixe également aux ARNm viraux et à l’ARNpg [25]. Cette interaction permettrait l’export de Core, peut-être sous la forme d’un complexe ribonucléoprotéique vers le cytoplasme. Il est donc possible que, par son domaine CTD qui présente des homologies avec un domaine présent dans les protéines SR, la protéine Core joue un rôle dans le devenir des ARN viraux et/ou cellulaires. L’ensemble de ces fonctions régulatrices expliqueraient la présence de Core dans le noyau des hépatocytes infectés par HBV. Plusieurs questions restent sans réponse, notamment celle concernant la forme active de Core dans le noyau. Après le désassemblage de la capside, Core pénètrerait dans le noyau sous la forme de dimères, qui pourraient se réassembler en capsides dépourvues de génome, lorsque leur quantité atteindrait un certain seuil [26]. Des intermédiaires, constitués de trimères de dimères, pourraient aussi être retrouvés [8]. Cependant, l’important encombrement stérique des capsides, et/ou des trimères de dimères, pourrait être défavorable à de telles interactions. Le mécanisme de liaison de Core aux acides nucléiques reste également à comprendre. La protéine Core possède une activité chaperonne d’acides nucléiques : elle est capable de catalyser des modifications conformationnelles et structurales des acides nucléiques in vitro [9]. Cette propriété est conférée par la région riche en arginines de son CTD [27]. Il est donc probable que ce soit également ce domaine qui confère à Core la capacité de se lier au minichromosome viral, mais aussi à quelques 3 100 promoteurs de gènes humains dans des hépatocytes infectés par HBV [22]. |
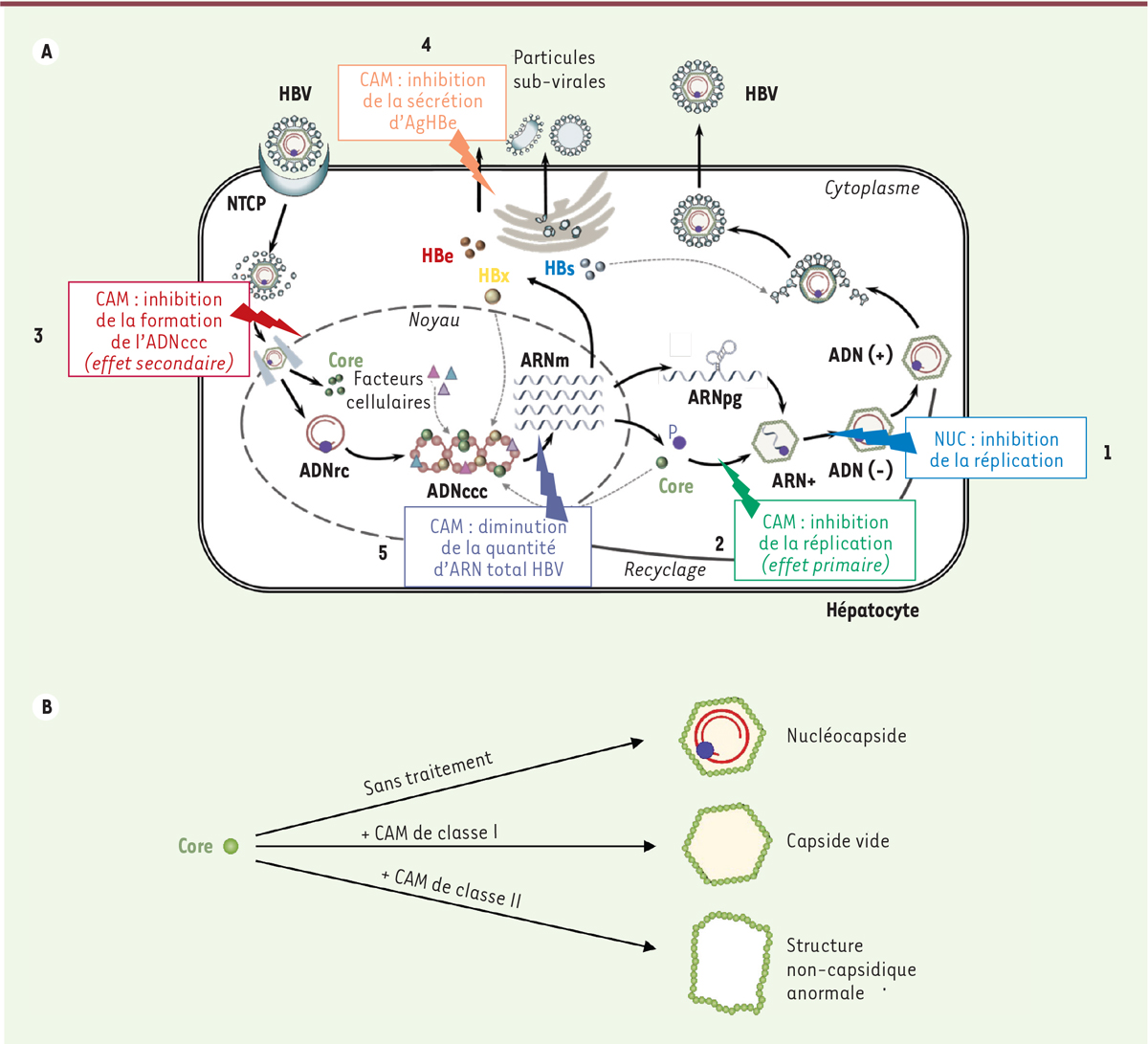
Par son rôle essentiel dans la formation des capsides du virus, Core a rapidement été considérée comme une cible prometteuse pour le développement de nouvelles molécules antivirales. Les études de sa structure ont permis l’émergence d’une nouvelle génération d’antiviraux ciblant cette protéine, désignés Core protein allosteric modulators (ou CAM), qui sont actuellement en phase d’évaluation préclinique et clinique. Ces molécules perturbent la formation de la capside virale, empêchant l’encapsidation de l’ARNpg, ce qui conduit à une inhibition de la réplication virale (effet primaire des CAM, Figure 4A) [28, 29]. On distingue deux classes de CAM : les CAM de classe I (phénylpropénamide ou PPA, et sulfamoylbenzamide) qui accélèrent fortement le processus d’assemblage produisant la formation de capsides de structure normale mais vides, dépourvues d’ARNpg ; les CAM de classe II (hétéroarylpyrimidine, ou HAP) qui conduisent à la formation de structures anormales (Figure 4B) [8]. Lorsque présents au moment de l’infection, les CAM pourraient également inhiber la formation de l’ADNccc (effet secondaire des CAM, Figure 4A). La fixation des CAM sur la capside virale serait à l’origine de sa déformation, ce qui conduirait à la libération de l’ADNrc dans le cytoplasme et à sa dégradation [30]. Elle pourrait aussi induire le blocage du désassemblage des capsides, empêchant la libération de l’ADNrc dans le noyau.
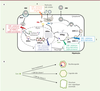 | Figure 4.
Effet des analogues de nucléosides (NUC) et des core protein allosteric modulators (CAM) sur le cycle réplicatif d’HBV. A. Effet des NUC et des CAM sur le cycle viral d’HBV. Contrairement aux NUC (Tenofovir, par exemple) qui inhibent uniquement la réplication virale en empêchant la transcription inverse de l’ARNpg en ADNrc (1), les CAM peuvent interférer avec plusieurs étapes du cycle viral. En effet, ils inhibent la réplication virale en accélérant la cinétique de formation de la capside virale, ce qui conduit à la génération de capsides vides (2) (effet primaire) et peuvent aussi inhiber la formation de novo de l’ADNccc en agissant à une étape post-entrée (3) (effet secondaire). Plus récemment, il a été montré que les CAM peuvent inhiber la sécrétion d’AgHBe (4) et diminuer la quantité d’ARN viral intracellulaire (5). B. Effet des CAM sur l’assemblage des capsides d’HBV. Les CAM de classe-I (Phénylpropénamides, PPA, ou sulfamoylbenzamide) induisent la formation de capsides de structure normale mais dépourvues du génome viral tandis que les CAM de classe-II (hétéroarylpyrimidine, HAP) induisent la formation de structures anormales également dépourvues du génome viral. |
Des essais cliniques de phase I à III sont en cours actuellement, impliquant de nombreux CAM comme NVR 3-778 (NCT02112799 ; Novira Therapeutics), ABI-H0731 (NCT02908191 ; Assembly Biosciences), JNJ-56136379 (NCT02662712 ; Janssen), GLS-4 (Morphothiadine Mésylate, HEC Pharm
1), et RO7049389 (NCT02952924 ; Roche) (Tableau I). De nombreux autres CAM sont en phase d’évaluation préclinique, comme AB506 (Arbutus).
Tableau I.
| Molécule |
Développeur |
Étape de développement |
Patients |
Identifiant sur ClinicalTrials.gov |
| NVR3-778 |
Novira TherapeuticsJanssen |
Phase 1 terminée |
Sains et porteurs chroniques d’HBV |
NCT02112799 NCT02401737 NCT03032536 |
|
| JNJ-56136379 |
Janssen |
Phase 2a |
Sains et porteurs chroniques d’HBV |
NCT03361956 NCT03111511 NCT02662712 NCT02933580 |
|
| ABI-H0731 |
Assembly Biosciences |
Phase 2a |
Porteurs chroniques d’HBV |
NCT02908191 NCT03109730 NCT03576066 NCT03577171 |
|
| GLS-4 |
HEC Pharma/Sunshine |
Phase 2/3 |
Sains et porteurs chroniques d’HBV |
CFDA (pharmacodia.com) |
|
| RO7049389 |
Roche |
Phase 1 |
Sains et porteurs chroniques d’HBV |
NCT02972255 NCT02952924 NCT03570658 |
Les core protein allosteric modulators (CAM) en essai clinique. CFDA : China food and drug administration. |
Les CAM pourraient, en plus de leurs effets sur l’assemblage et/ou le désassemblage de la capside, interférer avec les fonctions régulatrices nucléaires de Core, comme la régulation de la transcription de l’ADNccc et l’expression de gènes cellulaires (Figure 4A). Comme cela a été décrit récemment pour l’hétéroaryldihydropyrimidine (Bay 38-7690) [31], nous avons observé qu’un traitement par les CAM entraîne une relocalisation rapide de Core dans des focus nucléaires situés à proximité des corps PML (promyelocytic leukemia body), des structures subnucléaires associées aux réponses intrinsèques antivirales2. Ces focus de Core sont également localisés à proximité des composants du protéasome nucléaire, suggérant que Core pourrait subir des modifications post-traductionnelles (comme une ubiquitination) qui conduiraient à sa dégradation. Cette relocalisation de Core en réponse au traitement par les CAM, pourrait expliquer la réduction du niveau d’ARN viraux qui est observée dans ces conditions [32]. Les CAM pourraient également inhiber la sécrétion d’AgHBe3
(Figure 4A). Le mécanisme moléculaire mis en jeu reste cependant à élucider. Néanmoins, le précurseur d’AgHBe possède la même séquence primaire que la protéine Core, avec 21 aa supplémentaires en position N-terminale. Les CAM pourraient donc, comme Core, induire l’agrégation du précurseur d’AgHBe dans le cytoplasme de la cellule et inhiber sa sécrétion. Bien qu’initialement développés pour contrer la formation des nucléocapsides virales, les CAM s’avèrent donc, en inhibant les fonctions régulatrices nucléaires de Core, capables d’interférer avec de nombreuses autres étapes du cycle du virus. L’étude des fonctions de Core devrait permettre d’approfondir les connaissances sur les mécanismes d’action des CAM et ainsi de mieux discriminer les molécules selon leur(s) activité(s). Les essais cliniques qui sont en cours devraient, eux, conduire à la détermination de la durée de traitement nécessaire à la suppression de la réplication virale, de savoir si l’arrêt du traitement s’accompagne de phénomènes de rebond, et de mettre en évidence de possibles effets indésirables à long terme. L’objectif idéal des recherches actuelles sur des nouvelles molécules antivirales telles que les CAM serait de concevoir des traitements permettant une cure complète de l’infection chronique par HBV, c’est-à-dire l’élimination du virus (en particulier de son ADNccc) de la totalité des cellules hépatiques infectées. La capacité de l’ADNccc à persister dans les hépatocytes infectés, même en l’absence de réplication détectable, et ce pendant de longues périodes de temps, rend cet objectif difficilement atteignable. C’est pourquoi, scientifiques et médecins s’accordent pour qu’un premier objectif, plus réaliste, consiste en l’obtention d’une cure fonctionnelle, c’est-à-dire une absence durable de détection d’AgHBs dans le sérum des patients, et donc de réplication virale dans les cellules, avec ou sans séroconversion anti-HBs, et cela malgré la persistance d’ADNccc. Combiner les CAM aux NUC (le Tenofovir, par exemple) et/ou à des molécules immunomodulatrices capables d’induire une réponse immunitaire efficace pourrait être une option thérapeutique prometteuse pour conduire à une cure fonctionnelle. Des traitements pourraient également être des combinaisons de thérapies avec de nouvelles molécules ciblant des partenaires cellulaires de Core, appelés agents ciblant l’hôte (ou HTA pour host targeting agents). Ainsi, l’infection par HBV est associée à une augmentation de l’expression et de l’activation de la kinase cellulaire PLK1, et le BI-2536, un inhibiteur spécifique de l’activité de PLK1, inhibe la réplication virale [13]. L’identification des partenaires nucléaires de Core, actuellement en cours dans notre laboratoire, devrait donc permettre d’identifier de nouveaux HTA et de les cibler, ce qui représente une option thérapeutique prometteuse pour développer des thérapies combinées pouvant améliorer le contrôle de la réplication virale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1. Petruzziello A. Epidemiology of hepatitis B virus (HBV) and hepatitis C virus (HCV) related hepatocellular carcinoma . Open Virol J. 2018; ;12 : :26.–32. 2. Seeger C, Mason WS. Molecular biology of hepatitis B virus infection . Virology. 2015; ; 479-480 : :672.–686. 3. Yan H, Zhong G, Xu G, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus . Elife. 2012 ; :3.. 4. European Association for the Study of the Liver . Electronic address eee, European association for the study of the L. EASL 2017 Clinical practice guidelines on the management of hepatitis B virus infection . J Hepatol. 2017; ; 67 : :370.–398. 5. Chisari FV, Isogawa M, Wieland SF. Pathogenesis of hepatitis B virus infection . Pathol Biol (Paris). 2010; ; 58 : :258.–266. 6. Chang MH, Chen DS. Prevention of hepatitis. B. Cold Spring Harb Perspect Med. 2015; ; 5 : :a021493.. 7. Rijckborst V, Janssen HL. The role of interferon in hepatitis B therapy . Curr Hepat Rep. 2010; ; 9 : :231.–238. 8. Zlotnick A, Venkatakrishnan B, Tan Z, et al. Core protein : a pleiotropic keystone in the HBV lifecycle . Antiviral Res. 2015; ; 121 : :82.–93. 9. Chu TH, Liou AT, Su PY, et al. Nucleic acid chaperone activity associated with the arginine-rich domain of human hepatitis B virus core protein . J Virol. 2014; ; 88 : :2530.–2543. 10. Watts NR, Conway JF, Cheng N, et al. The morphogenic linker peptide of HBV capsid protein forms a mobile array on the interior surface . EMBO J. 2002; ; 21 : :876.–884. 11. Diab A, Foca A, Zoulim F, et al. The diverse functions of the hepatitis B core/capsid protein (HBc) in the viral life cycle : Implications for the development of HBc-targeting antivirals . Antiviral Res. 2018; ; 149 : :211.–220. 12. Ricco R, Kanduc D. Hepatitis B virus and Homo sapiens proteome-wide analysis : a profusion of viral peptide overlaps in neuron-specific human proteins . Biologics. 2010; ; 4 : :75.–81. 13. Diab A, Foca A, Fusil F, et al. Polo-like-kinase 1 is a proviral host factor for hepatitis B virus replication . Hepatology. 2017; ; 66 : :1750.–1765. 14. Gallucci L, Kann M. Nuclear Import of hepatitis B virus capsids and genome . Viruses. 2017 ; :9.. 15. Faure-Dupuy S, Lucifora J, Durantel D. Interplay between the hepatitis B virus and innate immunity : from an understanding to the development of therapeutic concepts . Viruses. 2017 ; :9.. 16. Zhang X, Lu W, Zheng Y, et al. In situ analysis of intrahepatic virological events in chronic hepatitis B virus infection . J Clin Invest. 2016; ; 126 : :1079.–1092. 17. Bock CT, Schwinn S, Locarnini S, et al. Structural organization of the hepatitis B virus minichromosome . J Mol Biol. 2001; ; 307 : :183.–196. 18. Guo YH, Li YN, Zhao JR, et al. HBc binds to the CpG islands of HBV cccDNA and promotes an epigenetic permissive state . Epigenetics. 2011; ; 6 : :720.–726. 19. Belloni L, Li L, Palumbo GA, et al. HAPs hepatitis B virus (HBV) capsid inhibitors block core protein interaction with the viral minichromosome and host cell genes and affect cccDNA transcription and stability . Hepatol. 2013; ; 58 : :277A.. 20. Zhang W, Chen J, Wu M, et al. PRMT5 restricts hepatitis B virus replication through epigenetic repression of covalently closed circular DNA transcription and interference with pregenomic RNA encapsidation . Hepatology. 2017; ; 66 : :398.–415. 21. Lubyova B, Hodek J, Zabransky A, et al. PRMT5 : a novel regulator of Hepatitis B virus replication and an arginine methylase of HBV core . PLoS One. 2017; ; 12 : :e0186982.. 22. Guo Y, Kang W, Lei X, et al. Hepatitis B viral core protein disrupts human host gene expression by binding to promoter regions . BMC Genomics. 2012; ; 13 : :563.. 23. Kwon JA, Rho HM. Transcriptional repression of the human p53 gene by hepatitis B viral core protein (HBc) in human liver cells . Biol Chem. 2003; ; 384 : :203.–212. 24. Du J, Liang X, Liu Y, et al. Hepatitis B virus core protein inhibits TRAIL-induced apoptosis of hepatocytes by blocking DR5 expression . Cell Death Differ. 2009; ; 16 : :219.–229. 25. Yang CC, Huang EY, Li HC, et al. Nuclear export of human hepatitis B virus core protein and pregenomic RNA depends on the cellular NXF1-p15 machinery . PLoS One. 2014; ; 9 : :e106683.. 26. Rabe B, Delaleau M, Bischof A, et al. Nuclear entry of hepatitis B virus capsids involves disintegration to protein dimers followed by nuclear reassociation to capsids . PLoS Pathog 2009. ; 5 : :e1000563.. 27. Nassal M. The arginine-rich domain of the hepatitis B virus core protein is required for pregenome encapsidation and productive viral positive-strand DNA synthesis but not for virus assembly . J Virol. 1992; ; 66 : :4107.–4116. 28. Wang XY, Wei ZM, Wu GY, et al. In vitro inhibition of HBV replication by a novel compound, GLS4, and its efficacy against adefovir-dipivoxil-resistant HBV mutations . Antivir Ther. 2012; ; 17 : :793.–803. 29. Bourne C, Lee S, Venkataiah B, et al. Small-molecule effectors of hepatitis B virus capsid assembly give insight into virus life cycle . J Virol. 2008; ; 82 : :10262.–10270. 30. Guo F, Zhao Q, Sheraz M, et al. HBV core protein allosteric modulators differentially alter cccDNA biosynthesis from de novo infection and intracellular amplification pathways . PLoS Pathog. 2017; ; 13 : :e1006658.. 31. Huber AD, Wolf JJ, Liu D, et al. The heteroaryldihydropyrimidine bay 38-7690 induces hepatitis B virus core protein aggregates associated with promyelocytic leukemia nuclear bodies in infected cells . mSphere. 2018 ; :3.. 32. Lahlali T, Berke JM, Vergauwen K, et al. Novel potent capsid assembly modulators regulate multiple steps of the hepatitis B virus life-cycle . Antimicrob Agents Chemother. 2018 Jul 16; . pii: AAC.00835-18.. doi: doi: 10.1128/AAC.00835-18.. |