| |
| Med Sci (Paris). 34(10): 774–777. doi: 10.1051/medsci/2018199.L’infection par un herpèsvirus gamma protège l’hôte du développement de l’asthme allergique Bénédicte Machiels1 and Laurent Gillet1* 1Université de Liège, Faculté de médecine vétérinaire, FARAH, Avenue de Cureghem 10, Quartier vallée 2, 4000LiègeBelgique MeSH keywords: Animaux, Asthme, Cytoprotection, Désensibilisation immunologique, Gammaherpesvirinae, Infections à Herpesviridae, Humains, Souris, immunologie, prévention et contrôle, virologie, physiologie, physiopathologie |
De « vieux amis » qui nous protègent de l’asthme allergique Le système immunitaire est historiquement divisé en une composante innée non spécifique et une composante adaptative spécifique qui présente une mémoire. Plusieurs études récentes ont revisité ce paradigme et ont montré l’influence à long terme de l’environnement sur le comportement des cellules appartenant à l’immunité innée [1]. Il est ainsi apparu que la majorité des variations entre les réponses immunes d’individus différents est définie, non pas uniquement par le patrimoine génétique, mais également par l’exposition à certaines conditions environnementales [2]. Celles-ci peuvent en effet affecter de manière durable, via des modifications épigénétiques, les cellules immunitaires innées, parmi lesquelles les cellules NK (natural killers) et les monocytes (MO). Ces modifications épigénétiques sont induites lors d’une exposition à certains stimulus et définissent la mise en place d’une réponse lors d’une exposition ultérieure soit plus intense, soit atténuée [1]. Parmi les très nombreux déterminants environnementaux qui façonnent notre système immunitaire (Figure 1), les microorganismes occupent une place centrale et laissent une empreinte d’autant plus décisive que la rencontre avec ces microorganismes se produit dans la petite enfance [3] (→). (→) Voir la Synthèse de C. Torre et al., m/s n° 11, novembre 2017, page 979
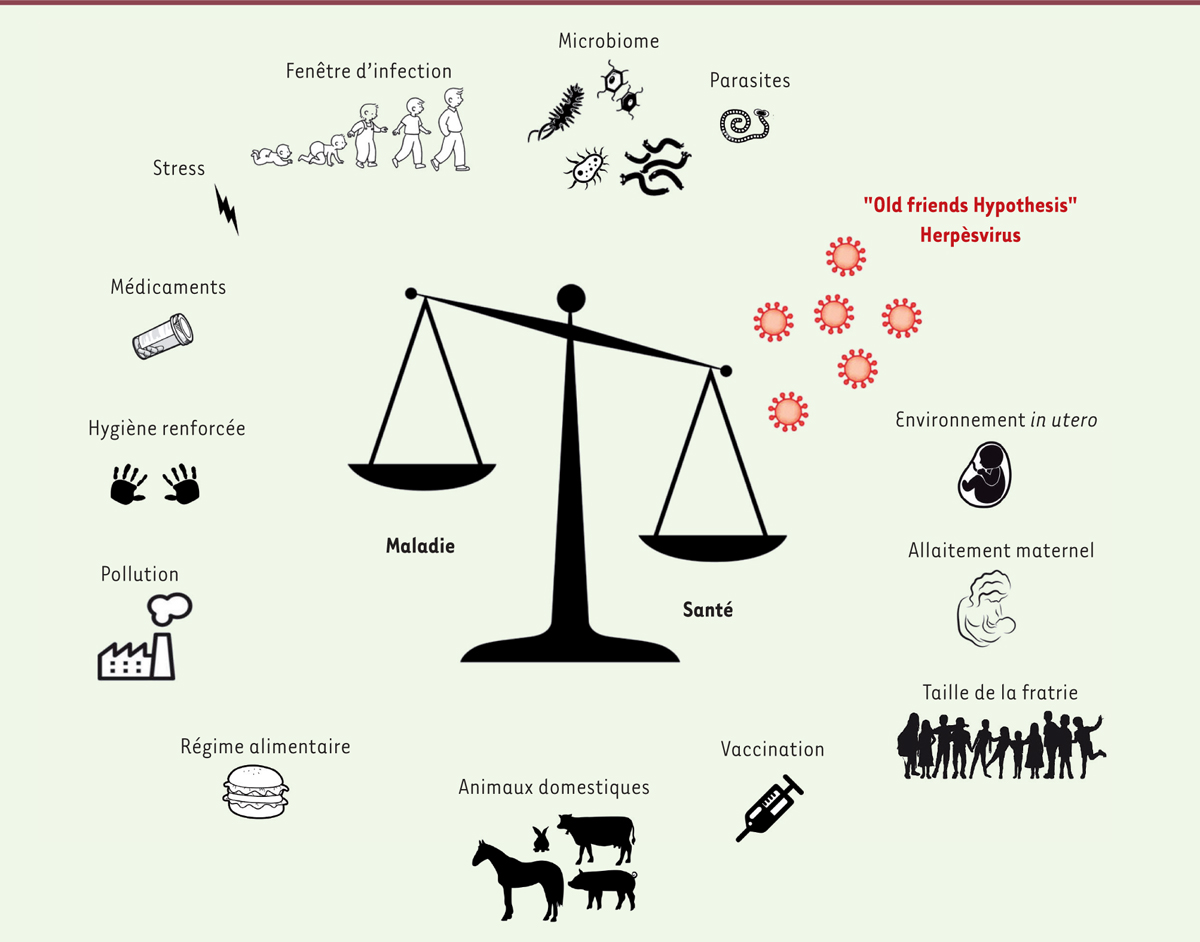
 | Figure 1.Facteurs environnementaux influençant positivement ou négativement l’équilibre entre santé et maladie. Le système immunitaire est constamment confronté à l’environnement et les conséquences de ces influences environnementales sont d’autant plus importantes qu’elles surviennent lors de la fenêtre critique de la période postnatale, lorsque le système immunitaire est encore en développement. Ceci est particulièrement vrai pour les réponses allergiques. Les microorganismes jouent un rôle majeur dans cette balance. En complément de la théorie hygiéniste, l’hypothèse des vieux amis, « old friends hypothesis », postule qu’au cours de l’évolution, notre système immunitaire a été façonné par différents microorganismes non pathogènes qui pourraient être qualifiés de vieux amis. Ces vieux amis incluent des espèces environnementales, mais aussi des espèces commensales présentes à différents endroits de nos tissus et organes comme la peau, l’intestin, les voies respiratoires. Afin de pouvoir persister, ces vieux amis ont développé des mécanismes immunorégulateurs qui in fine affectent des réponses à l’encontre d’antigènes du non-soi. Les herpèsvirus sont des virus extrêmement prévalents qui ont co-évolué avec leur hôte pour établir des infections latentes et développer une relation quasi symbiotique avec celui-ci (Figure adpatée et traduite avec la permission de Nature/Springer/Palgrave, de De Laval B et Sieweke MH [ 16]). |
Les réponses immunitaires de type 2, telles que les allergies respiratoires, sont particulièrement conditionnées par l’environnement [4]. Plus spécifiquement, l’asthme allergique, qui affecte plus de 300 millions de personnes dans le monde, présente une prévalence croissante, principalement dans les pays industrialisés. Cette augmentation est corrélée à une hygiène de vie renforcée et une moindre exposition aux infections durant le jeune âge qui représente une fenêtre critique pour la sensibilisation aux allergènes [4]. Parmi les microorganismes qui nous entourent, les herpèsvirus, et particulièrement les gammaherpèsvirus, ont co-évolué avec leur hôte pour s’adapter au système immunitaire et établir une infection persistante (Figure 1). Alors que ces gammaherpèsvirus favorisent les réponses immunes régulatrices des leucocytes pour se maintenir à l’état latent, leur grande prévalence suggère l’existence d’une relation quasi symbiotique avec leur hôte [5]. À ce titre, ces virus pourraient être qualifiés de « vieux amis » selon la théorie proposée par Graham A. Rook [6]. L’infection précoce par le virus d’Epstein-Barr (EBV) chez les enfants semble être un facteur de protection vis-à-vis de la sensibilisation aux immunoglobulines E (IgE) [7]. Afin de rechercher si l’infection par un gammaherpèsvirus peut protéger l’hôte du développement subséquent d’asthme allergique, nous avons utilisé l’herpèsvirus murin 4 (MuHV-4) comme modèle murin d’infection par un gammaherpèsvirus. Des administrations intranasales répétées d’extraits d’acariens ont été réalisées pour induire une allergie respiratoire chez ces souris infectées. Ces expériences ont révélé que l’infection respiratoire par le MuHV-4 inhibait à long terme le développement de l’asthme allergique [8]. En effet, alors que les souris non infectées et soumises aux extraits d’acariens ont toutes développé les caractéristiques d’une allergie respiratoire, les souris préalablement infectées par le MuHV-4 ont présenté une diminution de l’inflammation, une quasi-absence d’éosinophilie pulmonaire, une diminution de la production de cytokines de type 2 dans les voies aériennes et dans le ganglion drainant, ainsi qu’une réduction des taux sériques d’IgE circulantes. Les souris de laboratoire sont élevées dans un environnement strictement contrôlé. Elles présentent donc un système immunitaire vierge de toute influence par des pathogènes. Les expériences menées avec le MuHV-4 ont donc mis en évidence l’importance de l’exposition d’un système immunitaire naïf, comme celui des nouveau-nés ou des jeunes enfants, aux microorganismes pour l’équilibre subséquent des réactions immunitaire à l’encontre des allergènes. |
À l’origine de cette protection : des monocytes régulateurs qui repeuplent la niche alvéolaire Différent types cellulaires contribuent à la pathologie de l’asthme. Parmi ceux-ci, les macrophages alvéolaires (MA), qui ont une demi-vie très longue, représentent les leucocytes résidents les plus abondants du poumon [9]. De manière générale, les macrophages peuvent avoir une origine embryonnaire ou provenir du recrutement de monocytes circulants. Les MA colonisent les alvéoles pulmonaires au cours de la période périnatale et se maintiennent dans un contexte d’homéostasie par prolifération locale [10]. Nous avons pu montrer que lors d’une infection expérimentale, le MuHV-4 se réplique au niveau du poumon et induit la mort des MA. Cette déplétion de la niche alvéolaire est corrélée à une infiltration massive de monocytes au niveau des voies respiratoires et à une augmentation de leur nombre dans la moelle osseuse et le sang [8]. Ces monocytes recrutés à la suite de l’infection présentent une signature phénotypique particulière (une surexpression du complexe majeur d’histocompatibilité de classe II [CMHII] et de Sca-1 [stem cell antigen-1]), associée à l’acquisition de propriétés régulatrices [11] telles que la production d’interleukine-10. De nombreux modèles proposent un rôle déterminant de l’environnement tissulaire sur le comportement et le devenir des monocytes [12], mais l’empreinte phénotypique induite par l’infection par le MuVHV-4 sur les monocytes de la moelle et du sang suggère l’existence d’une « pré-éducation » antérieure aux influences du microenvironnement pulmonaire. Afin de déterminer si ces monocytes régulateurs reconstituent la niche alvéolaire et s’y maintiennent à long terme, différentes stratégies ont été élaborées chez des souris chimères. Ces modèles ont permis de discriminer sans ambiguïté les cellules immunitaires résidentes des cellules recrutées à partir de la moelle osseuse en réponse à l’infection. Les résultats ont montré une contribution mineure (< 2 %) des monocytes dérivés de la moelle au renouvellement des MA en conditions d’homéostasie. Au contraire, suite à l’infection par le MuHV-4, les MA résidents sont entièrement reconstitués à long terme par des monocytes issus de la moelle osseuse [8]. Dans des conditions non-inflammatoires, le remplacement expérimental des MA par des monocytes donne naissance à des MA dont le profil d’expression des gènes est quasiment similaire à celui des cellules dérivées des précurseurs embryonnaires [13]. En revanche, l’identité phénotypique des MA dérivant des monocytes lors de l’infection respiratoire par le MuHV-4 est significativement modifiée durant plusieurs mois suivant l’infection [8], suggérant l’existence d’altérations épigénétiques persistantes dans ces cellules. |
Cette protection est liée à l’interaction des MA dérivés des monocytes régulateurs avec les cellules dendritiques responsables de la sensibilisation allergique Les cellules dendritiques (CD) sont des acteurs indispensables au développement des réactions allergiques [14]. À la suite d’une primo-exposition aux extraits d’acariens, ces cellules internalisent l’allergène, maturent et migrent vers le ganglion lymphatique drainant pour initier puis amplifier la réponse des lymphocytes de type 2 (Th2). Alors que les CD de souris infectées par le MuHV-4 conservent leur capacité à migrer jusqu’au ganglion pour y présenter l’antigène, une diminution de l’expression de marqueurs de co-stimulation (CD86, CD80) nécessaires à l’activation efficace des lymphocytes T est observée. Afin de déterminer si les MA dérivés des monocytes sont à l’origine de ce défaut de maturation, des CD ont été co-cultivées avec des MA isolés de souris infectées ou non-infectées, puis transférées à des souris receveuses. La mise en présence des CD avec des MA isolés de souris infectées a altéré la capacité de ces CD à initier une réponse des lymphocytes Th2 (Figure 2). Cette expérience a donc permis d’établir le lien entre les monocytes régulateurs s’établissant à long terme dans la niche alvéolaire et l’incapacité des CD à initier une réponse allergique efficace [8].
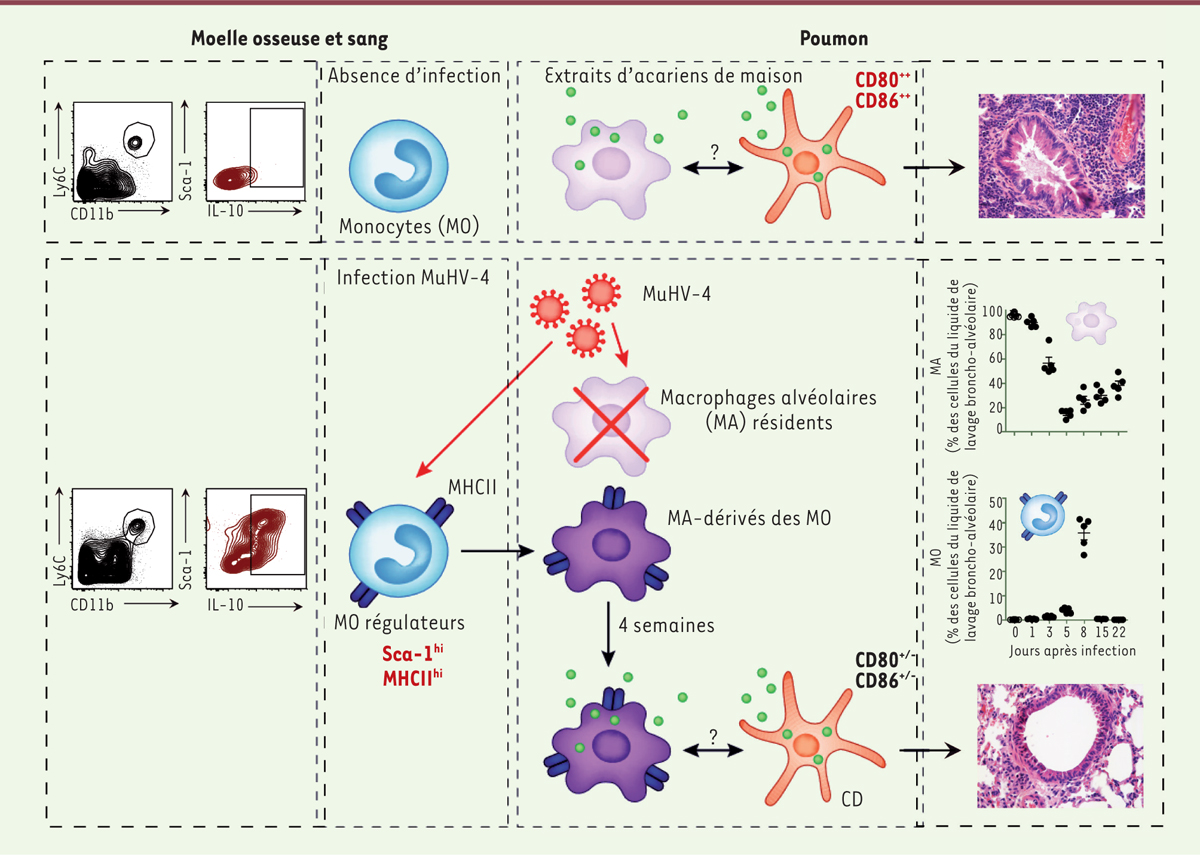
 | Figure 2. L’infection par un gammaherpèsvirus protège du développement de l’asthme allergique en remplaçant les macrophages alvéolaires résidents par des monocytes régulateurs. Chez des souris non infectées, les monocytes circulants (MO) ne sécrètent pas ou peu d’interleukine 10 (IL-10) connue pour ses propriétés régulatrices et ne colonisent pas la niche alvéolaire. Les macrophages alvéolaires (MA) résidents ne bloquent pas la capacité des cellules dendritiques (CD) matures à induire des réactions allergiques respiratoires à l’encontre d’extraits d’acariens de maison. Une infection pulmonaire primaire par l’herpèsvirus MuHV-4 induit la mort des MA résidents ainsi que le recrutement massif depuis la moelle osseuse de MO présentant un phénotype régulateur (défini par la surexpression des marqueurs Sca-1 [stem cell antigen-1] et MCH-II [complexe majeur d’histocompatibilité de classe 2] et par la sécrétion importante d’IL-10). Ces MO régulateurs infiltrent l’alvéole et s’y différencient en MA à longue durée de vie. Les MA dérivés des MO inhibent le développement de l’asthme allergique en interférant avec la capacité des cellules dendritiques à initier une réponse allergique, sans pour autant affecter les autres fonctions de la réponse immune. CMHII : complexe majeur d’histocompatibilité de classe II. |
Les résultats obtenus ont donné un éclairage nouveau sur l’origine des populations de macrophages dans un contexte infectieux et ont mis en évidence, pour la première fois, le fait qu’une infection virale induisait le remplacement d’une population de macrophages embryonnaires résidents par des monocytes régulateurs. Cette étude a également révélé, en accord avec l’hypothèse hygiéniste, l’influence cruciale des infections ou des stimulations antigéniques dans le jeune âge sur l’orientation subséquente des réponses immunitaires. L’hypothèse hygiéniste impliquait jusqu’à présent principalement des composés bactériens [15]. Cette étude est la première à mettre en évidence le rôle décisif que peuvent également jouer certaines infections virales pour contrebalancer à long terme le développement de réponses allergiques. Actuellement, l’incidence des immunopathologies allergiques ne cesse d’augmenter. La compréhension des mécanismes moléculaires à l’origine de propriétés régulatrices induites par les gammaherpèsvirus pourrait donc dégager de nouvelles perspectives thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Netea MG, Joosten LA, Latz E et al. Trained immunity: a program of innate immune memory in health and disease . Science. 2016;; 352 : :aaf1098.. 2. Brodin P, Jojic V, Gao T, et al. Variation in the human immune system is largely driven by nonheritable influences . Cell. 2015; ; 160 : :37.–47. 3. Torre C, Tsoumtsa LL, Ghigo E. La mémoire immunitaire entraînée chez les invertébrés : que sait-on ? . Med Sci (Paris). 2018; ; 34 : :979.–983. 4. Lambrecht BN, Hammad H. The immunology of the allergy epidemic and the hygiene hypothesis . Nat Immunol. 2018; ; 18 : :1076.–1083. 5. Barton ES, White DW, Cathelin JS, et al. Herpesvirus latency confers symbiotic protection from bacterial infection . Nature. 2007; ; 447 : :326.–329. 6. Bloomfield SF, Rook GA, Scott EA, et al. Time to abandon the hygiene hypothesis: new perspectives on allergic disease, the human microbiome, infectious disease prevention and the role of targeted hygiene . Perspect Public Health. 2016; ; 136 : :213.–224. 7. Saghafian-Hedengren S, Sverremark-Ekström E, Linde A, et al. Early-life EBV infection protects against persistent IgE sensitization . J Allergy Clin Immunol. 2010; ; 125 : :433.–438. 8. Machiels B, Dourcy M, Xiao X, et al. A gammaherpesvirus provides protection against allergic asthma by inducing the replacement of resident alveolar macrophages with regulatory monocytes . Nat Immunol. 2018; ; 18 : :1310.–1320. 9. Hussell T, Bell TJ. Alveolar macrophages: plasticity in a tissue-specific context . Nat Rev Immunol. 2014; ; 14 : :81.–93. 10. Guilliams M, Scott CL. Does niche competition determine the origin of tissue resident macrophages? . Nat Rev Immunol. 2018; ; 17 : :451.–460. 11. Askenase MH, Han SJ, Byrd AL, et al. Bone-marrow-resident NK cells prime monocytes for regulatory function during infection . Immunity. 2015; ; 42 : :1130.–1142. 12. Guilliams M, Scott CL. Does niche competition determine the origin of tissue resident macrophages? . Nat Rev Immunol. 2018; ; 17 : :451.–460. 13. van de Laar L, Saelens W, , de Prijck S, et al. Yolk sac macrophages, fetal liver, and adult monocytes can colonize an empty niche and develop into functional tissue-resident macrophages . Immunity. 2016; ; 44 : :755.–768. 14. Plantinga M, Guillams M, Vanheerswynghels M, et al. Conventional and monocyte-derived CD11b+ dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen . Immunity. 2013; ; 38 : :322.–335. 15. Sabatel C, Radermecker C, Fievez L, et al. Exposure to bacterial CpG DNA protects from airway allergic inflammation by expanding regulatory lung interstitial macrophages . Immunity. 2018; ; 46 : :457.–473. 16. De Laval B, , Sieweke MH. Trained macrophages support hygiene hypothesis . Nat Immunol. 2018; ; 18 : :1279.–1280. |