| |
| Med Sci (Paris). 34(10): 872–875. doi: 10.1051/medsci/2018217.Immunothérapie et thérapies ciblées, une combinaison d’avenir dans la lutte contre le cancer Module d’immunologie virologie et cancer du Master de cancérologie de Lyon Nathan Andrieu1* and Nathalie Bendriss-Vermare2** 1Master Cancer ISPB, Université de Lyon, Université Claude Bernard Lyon 1, Lyon, France 2Université de Lyon, Université Claude Bernard Lyon 1, Inserm U1052, CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon, Lyon, 69008, France |

Les cancers sont la deuxième cause de décès dans le monde, responsables de 8,8 millions de morts en 2015. L’innovation médicale est une priorité en oncologie. L’immunothérapie est récemment devenue incontournable dans le traitement des cancers. Elle consiste à mobiliser ou stimuler le système immunitaire du patient pour éliminer les cellules tumorales, à l’instar des thérapies ciblées dirigées directement contre ces dernières. Une des caractéristiques des cancers est d’éteindre, voire de détourner, les défenses immunitaires du patient à leur profit, permettant à la cellule tumorale d’échapper à la surveillance immunitaire. L’immunothérapie vise donc à rétablir le bon fonctionnement de l’immunité anti-tumorale, afin de mieux lutter contre la tumeur. Les immunothérapies anticancéreuses ciblant les points de contrôle immunitaire des lymphocytes T (LT) (PD1, PD-L1 [programmed cell death (ligand 1)], CTLA4 [cytotoxic T-lymphocyte-associated protein 4]) sont aujourd’hui autorisées en France pour le traitement du mélanome, de certains cancers du poumon, des cancers du rein, de la vessie, et du lymphome de Hodgkin. Elles offrent des gains de survie majeurs et prolongés pour les patients, mais seulement chez un faible pourcentage d’entre eux et dans un nombre limité de cancers. De plus, des phénomènes de résistance acquise au cours du traitement apparaissent (→). (→) Voir la Nouvelle de C. Fourneaux et B. Dubois, page 875 de ce numéro Les thérapies ciblées consistent à viser des anomalies moléculaires dans les cellules tumorales ou leur microenvironnement qui sont impliquées dans le développement et la propagation de la tumeur. Elles agissent sur des anomalies oncogéniques responsables à elles seules de la survie anormale d’une cellule. Les complexes cyclines-kinases dépendantes des cyclines (CDK), impliqués dans la régulation du cycle cellulaire, sont considérés comme de puissants oncogènes. Il existe des thérapies ciblant le couple cycline D-CDK4/6, comme l’abemaciclib ou le palbociclib. D’une manière générale, les thérapies ciblées sont associées à des taux de réponse élevés en clinique [1], mais elles cessent généralement de fonctionner rapidement à cause de l’émergence de mécanismes de résistance [2]. Il est nécessaire, au vu de ces éléments, de développer de nouvelles stratégies thérapeutiques pour augmenter l’efficacité des approches existantes, élargir les types de tumeurs pouvant bénéficier de l’immunothérapie, et limiter les phénomènes de résistance et de rechute. Une option intéressante serait de combiner immunothérapie et thérapies ciblées. En effet, outre leurs actions sur la cellule tumorale, les thérapies ciblées auraient également la capacité de moduler positivement la réponse immunitaire. Trois articles récents [3-5] apportent un rationnel fort à cette démarche d’utilisation combinée d’immunothérapie ciblant PD(L)1 et de thérapies ciblées contre CDK4/6. |
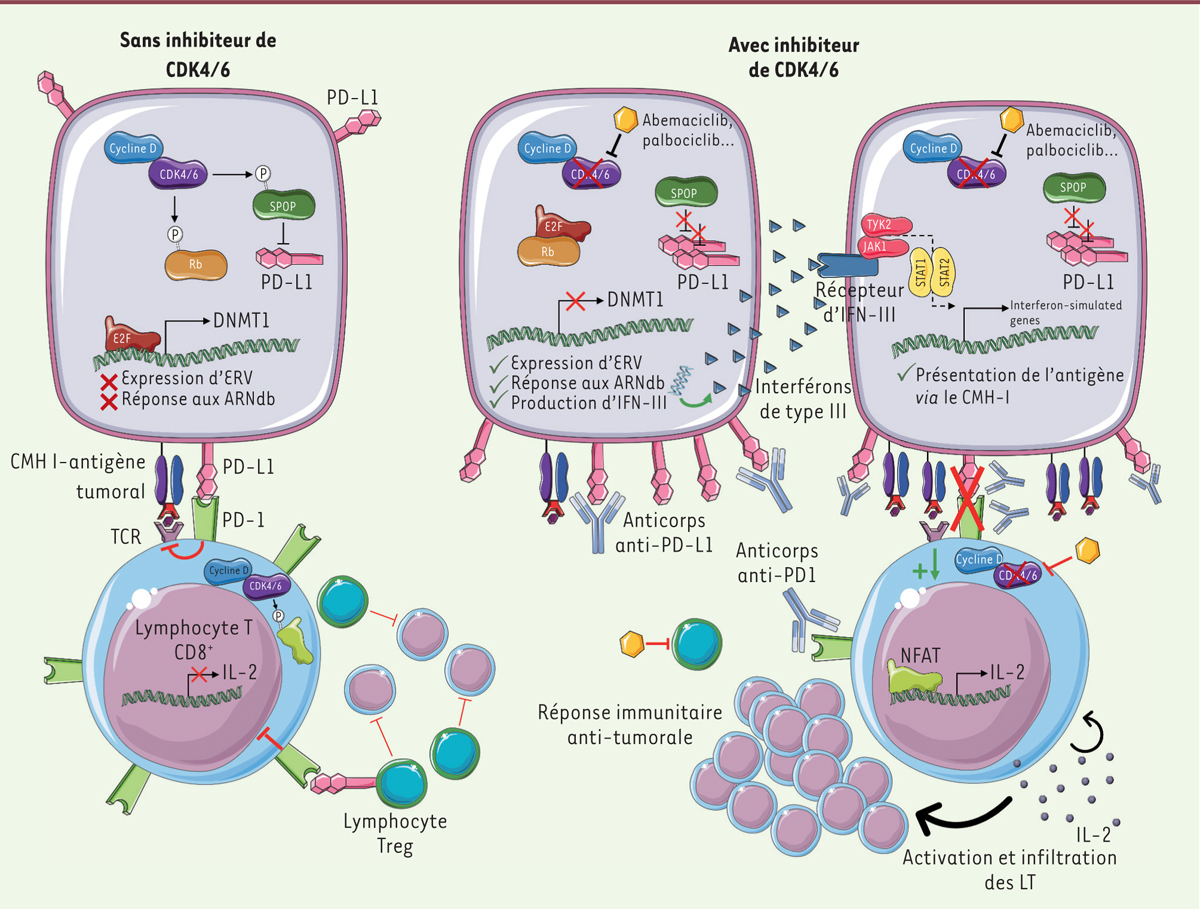
La croissance des cellules tumorales est diminuée par les inhibiteurs de CDK4/6 L’expression des complexes cycline-CDK est augmentée dans les cellules tumorales, stimulant ainsi leur prolifération (Figure 1). Les inhibiteurs de CDK4/6 ont pour but de contrer ce phénomène. Ils permettent ainsi de réduire la prolifération cellulaire, entraînant une diminution du volume tumoral. En effet, les cellules tumorales rentrent dans un état de sénescence qui se traduit par un arrêt stable de leur prolifération, sans mort cellulaire par apoptose ni phénotype sécrétoire associé à la sénescence (appelé SASP, senescence-associated secretory phenotype).  | Figure 1. Mécanismes d’action des inhibiteurs de CDK4/6 en lien avec la réponse immunitaire. En l’absence d’inhibiteur de CDK4/6, les cellules tumorales acquierent l’expression de PD–L1 a leur surface. La liaison de PD–L1 a son recepteur PD–1 conduit au blocage des LT CD8+ effecteurs (LTeff). De plus, les LT regulateurs (LTreg) inhibent directement l’effet des LTeff. En resulte une perte d’efficacite de la reponse immunitaire. En reponse a un inhibiteur de CDK4/6, les LTreg sont directement bloques et l’expression nucleaire du facteur NFAT est retablie dans les LTeff, menant a la production d’IL–2 qui active les LTeff et amplifie leur infiltration tumorale. En parallele, l’expression de PD–L1 est augmentee a la surface des cellules tumorales traitees, les sensibilisant ainsi aux anticorps therapeutiques anti–PD–L1. Enfin, l’expression de retrovirus endogenes (ERV) est retablie dans les cellules tumorales traitees ; la detection de leurs ARNdb endogenes conduit a la production d’IFN–III et a l’induction des ISG (interferon–stimulated genes). Ces eve nements aboutissent a une presentation accrue de l’antigene a la surface des cellules tumorales, induisant une meilleure reconnaissance et une elimination plus efficace de ces cellules par le systeme immunitaire. |
|
Les inhibiteurs de CDK4/6 augmentent l’immunogénicité des cellules tumorales L’immunité antitumorale repose sur la capacité du système immunitaire à reconnaître et éliminer les cellules tumorales. Les lymphocytes T LT cytotoxiques CD8+ reconnaissent des complexes associant les molécules CMH (complexe majeur d’histocompatibilité) de type I avec l’antigène présent à la surface des cellules tumorales, entraînant l’élimination de ces dernières par lyse. Pour pouvoir se développer, les cancers adoptent des mécanismes de résistance à la lyse, tels que la diminution de l’expression des molécules du CMH de type I ou d’autres molécules impliquées dans la présentation de l’antigène. Goel et al. [3] ont montré que les inhibiteurs de CDK4/6 augmentaient la présentation de l’antigène, à l’origine d’une prolifération accrue des LT. Par ailleurs, l’expression des gènes de réponse aux interférons (IFN) - ou ISG (interferon-stimulated genes) - et ceux des IFN de type III est fortement stimulée dans les cellules tumorales, augmentant leur capacité à présenter les antigènes et reflétant une réponse inflammatoire. Enfin, l’expression et l’activité de la DNMT1 (DNA methyltransferase) sont diminuées, réduisant la méthylation de certains éléments de l’ADN. Les méthylations de l’ADN inhibant généralement la transcription des gènes, cette baisse de méthylation rétablit l’expression de ces éléments, en particulier des rétrovirus endogènes ou ERV (endogenous retrovirus), simulant alors une infection virale et conduisant à l’expression des ISG en réponse aux ARN viraux double-brins. |
Les inhibiteurs de CDK4/6 augmentent l’infiltration tumorale par des lymphocytes T effecteurs activés et diminuent la prolifération des Treg Afin d’être efficaces contre la tumeur, les LT doivent être activés et localisés au contact des cellules tumorales. Une forte infiltration tumorale par les LT effecteurs est un facteur de bon pronostic dans la majorité des cancers. Deng et al. [4] ont montré que l’inhibition de CDK4/6 augmente l’infiltration tumorale en LT effecteurs activés dans des modèles murins expérimentaux de cancers. En effet, les kinases CDK4/6 sont capables d’inactiver des voies de régulation positive des fonctions des LT impliquant les facteurs de transcription de la famille NFAT (nuclear factor of activated T cells). Ainsi, l’inhibition de CDK4/6 permet la réactivation des molécules NFAT et de leurs gènes cibles, dont fait partie le gène codant l’IL-2 (interleukine 2), une cytokine activatrice majeure des LT effecteurs. S’ensuit une activation accrue des LT, associée à une plus forte infiltration tumorale par les LT effecteurs in vivo. Une autre voie d’échappement immunitaire implique les cellules immunosuppressives, telles que les LT régulateurs (Treg). Ces cellules ont pour rôle de diminuer la prolifération des cellules effectrices telles que les LT CD8+ ou les cellules natural killer (NK). Les travaux de Goel et al. [3] et Deng et al. [4] ont mis en évidence le fait que l’inhibition de CDK4/6 permettait de diminuer directement la prolifération des Treg, et ce de manière spécifique, non observable dans les autres types de lymphocytes. En résulte une diminution du nombre de Treg intratumoraux et circulant dans le sang, avec un rapport Treg/TCD8 diminué traduisant une inversion de la balance en faveur de l’immunité anti-tumorale. |
Les inhibiteurs de CDK4/6 agissent sur l’axe PD1/PDL1 Un dernier type d’échappement se joue au niveau des points de contrôle immunitaires inhibiteurs des LT. Il s’agit de récepteurs de surface impliqués dans la régulation négative des fonctions effectrices des LT. Le couple PD-1/PD-L1 est aujourd’hui une cible majeure de l’immunothérapie. PD-1 est exprimé à la surface des LT activés et son engagement par son ligand PD-L1, exprimé notamment par les cellules tumorales et les macrophages immunosuppresseurs, conduit à l’inhibition des fonctions du LT et à son épuisement. Goel et al. ont montré que les inhibiteurs de CDK4/6 diminuaient l’expression de PD-1 ainsi que d’autres récepteurs inhibiteurs sur les LT, les rendant moins sensibles à cette inhibition et plus aptes à lutter contre la tumeur. Par ailleurs, l’équipe de Zhang et al. [5] a récemment mis en évidence que les inhibiteurs de CDK4/6 augmentaient l’expression de PD-L1, via la stabilisation du complexe culline3–SPOP (speckle-type POZ protein), qui, normalement, dégrade PD-L1. Cette augmentation est corrélée à un meilleur taux de réponse au traitement anti-PD-1 dans des modèles tumoraux chez la souris, en accord avec des études cliniques rapportant que la réponse aux anti-PD-1–PD-L1 dépend de l’expression de PD-L1 par les cellules tumorales [6]. |
Les inhibiteurs de CDK4/6 sensibilisent les tumeurs à une immunothérapie ciblant l’axe PD1/PD-L1 Outre un effet direct sur la cellule tumorale, les différentes propriétés immuno-stimulatrices des inhibiteurs de CDK4/6 apportent un rationnel fort quant au bénéfice clinique de leur combinaison avec un traitement anti-PD(L)-1. En effet, les études réalisées dans différents modèles tumoraux murins démontrent une meilleure efficacité de la combinaison sur la réduction de la croissance tumorale et une meilleure survie des animaux soumis à une combinaison thérapeutique que celle des animaux soumis aux traitements non combinés. L’inhibition de CDK4/6 permet donc de potentialiser la réponse au traitement anti-PD(L)-1 via de nombreux effets positifs sur le système immunitaire, tels que l’augmentation de la présentation antigénique et de l’infiltration par les LT effecteurs, l’augmentation de l’expression de PD-L1 et la diminution de la prolifération des Treg. Ces résultats novateurs illustrent de nouveaux modes d’action des thérapies ciblées et permettent de mieux comprendre comment elles fonctionnent et d’envisager de nouvelles approches thérapeutiques, consistant en leur combinaison avec des immunothérapies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Turner NC, Huang Bartlett C, Cristofanilli M. Palbociclib in hormone-receptor-positive advanced breast cancer . N Engl J Med. 2015; ; 373 : :209.–219. 2. Ledford H. Cocktails for cancer with a measure of immunotherapy . Nature. 2016; ; 532 : :162.–164. 3. Goel S, DeCristo MJ, Watt AC, et al. CDK4/6 inhibition triggers anti-tumour immunity . Nature. 2018; ; 548 : :471.–475. 4. Deng J, , Jenkins Wang ES, et al. CDK4/6 inhibition augments anti-tumor immunity by enhancing T cell activation . Cancer Discovery. 2018; ; 8 : :216.–233. 5. Zhang J, Bu X, Wang H, et al. Cyclin D-CDK4 kinase destabilizes PD-L1 via cullin 3-SPOP to control cancer immune surveillance . Nature. 2018; ; 553 : :91.–95. 6. Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients . Nature. 2014; ; 515 : :563.–567. |