Le mélanome uvéal (MU) est une forme rare de mélanome d’origine oculaire, représentant environ 5 % de l’ensemble des mélanomes [1] (→). Contrairement aux mélanomes cutanés, les MU sont caractérisés par l’une des plus faibles charges mutationnelles parmi toutes les tumeurs solides de l’adulte et par l’absence de signature mutationnelle liée aux rayonnements ultra-violets. Cependant, certains MU ne suivent pas ces règles générales et, quoiqu’exceptionnels, ces cas sont souvent informatifs.
(→) Voir la Synthèse de S. Alsafadi et al., m/s n° 2, février 2018, page 155
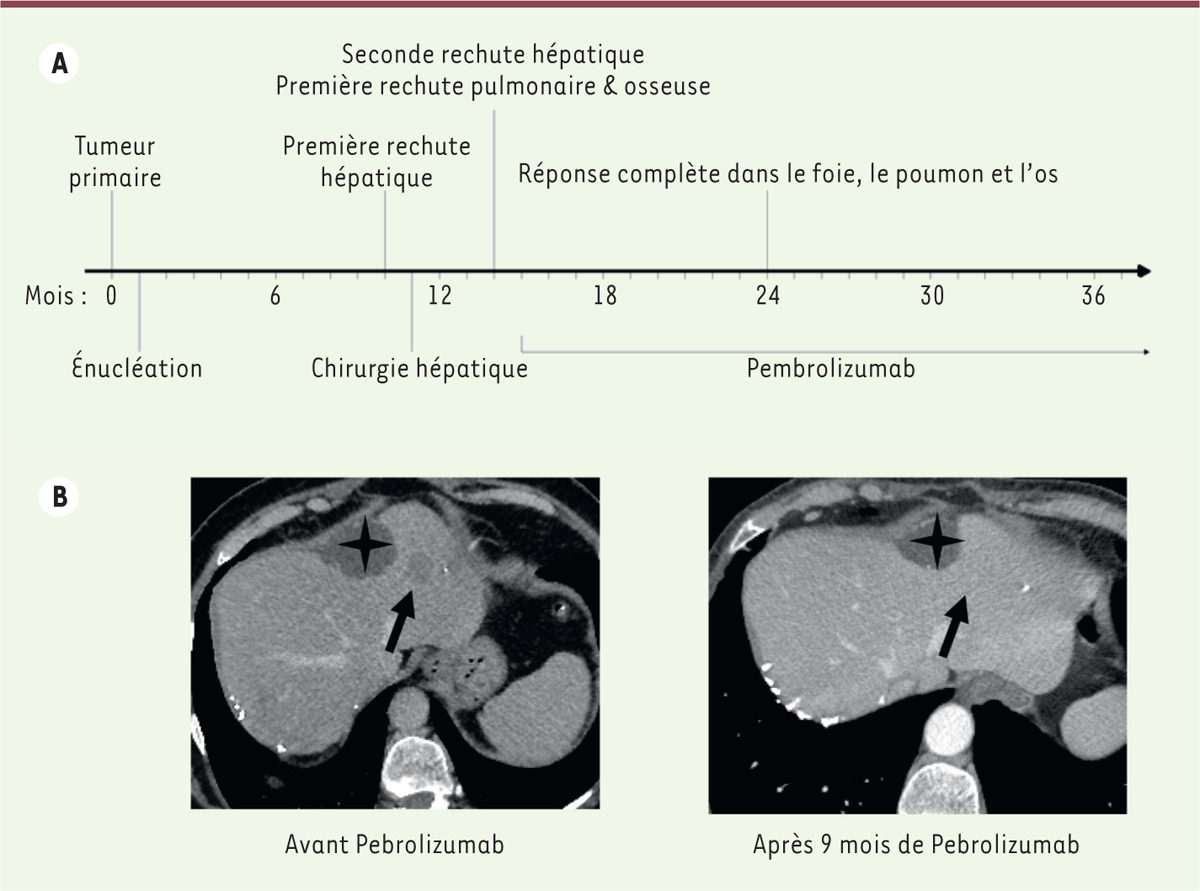
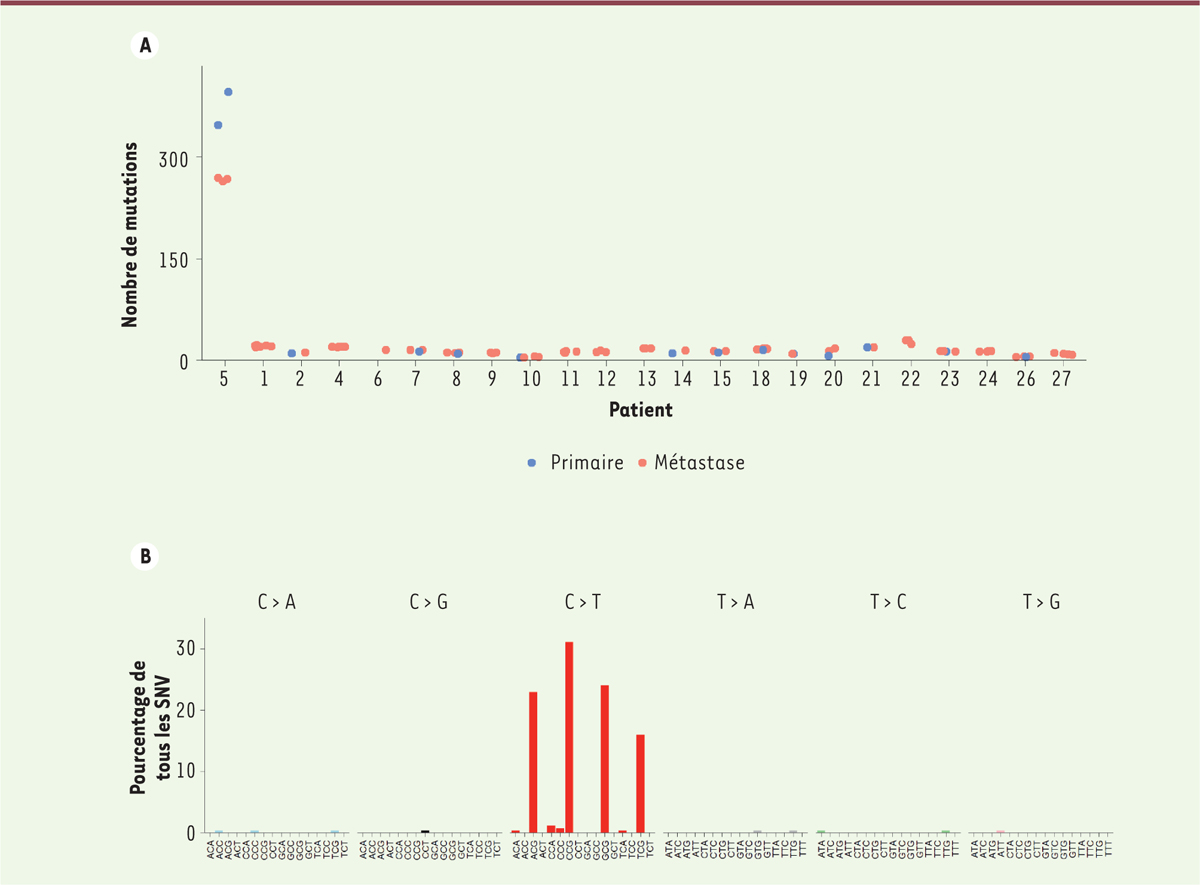
Nous avons récemment rapporté le cas d’un patient traité par un anticorps dirigé contre un point de contrôle immunitaire (PD1 [programmed cell death 1]) pour un MU métastatique qui a présenté une réponse tumorale exceptionnelle à cette drogue (Figure 1) [2]. Le taux de réponse à ces thérapies anti-points de contrôle immunitaire est de l’ordre de 5 % dans cette maladie [3], probablement limité par la très faible charge mutationnelle et, en conséquence, le faible nombre de néo-épitopes. Les échantillons de la tumeur primaire comme des métastases de ce patient répondeur présentaient une très importante charge mutationnelle de près de 300 mutations somatiques par exome, soit environ 20 fois plus importante que celle habituellement observée dans les MU (Figure 2A). Le répertoire des mutations dans une tumeur reflète les processus mutationnels endogènes et exogènes auxquels les cellules progénitrices ont été exposées de la vie embryonnaire jusqu’à la formation de la tumeur. Plus de 90 % des mutations ponctuelles observées dans cette tumeur répondant à l’immunothérapie étaient des transitions cytosine en thymine dans un contexte de cytosine suivie d’une guanine (CpG > TpG) (Figure 2B). Ce phénotype était très évocateur d’un processus de désamination des cytosines méthylées. La désamination des 5-méthylcytosines est un événement mutationnel spontané générant des mutations somatiques CpG > TpG à un taux constant. Par conséquent, le niveau de ces mutations dans une tumeur est dans la plupart des cancers corrélé à l’âge de l’individu au moment du diagnostic [4]. Les désaminations des cytosines sont habituellement efficacement prises en charge par un mécanisme de réparation par excision de bases, dont la première étape est le clivage de la base altérée par une glycosylase : TDG (thymine DNA glycosylase) ou MBD4 (methyl-binding domain 4) [5]. MBD4 serait spécifique des lésions induites par la désamination des méthyl-CpG, alors que TDG est une enzyme plus polyvalente capable de traiter l’ensemble des lésions de désamination. Nous avons identifié chez ce patient une délétion constitutionnelle délétère d’une base de la séquence codante de MBD4 ([c.1441del], p.[Leu482Trpfs*9] : délétion de la base 1441 et mutation de la leucine 482 en tryptophane, suivie d’un changement de cadre de lecture et d’un codon stop après 9 bases [fs : frameshift]), associée à une perte de l’allèle sauvage dans la tumeur résultant en une inactivation complète de ce gène. Il s’agissait de la seule mutation de MBD4 retrouvée dans une série de MU dont les autres tumeurs n’étaient pas hypermutées. L’exploration systématique des données publiques disponibles pour les ~10 000 tumeurs du programme « the cancer genome atlas (TCGA) » a permis d’identifier deux autres tumeurs - un autre MU et un glioblastome - avec le même phénotype hypermutateur CpG > TpG, toutes deux porteuses de mutations constitutionnelles délétères de MBD4 avec perte de l’allèle sauvage dans la tumeur.
| Figure 1. Un patient avec un mélanome uvéal métastatique présentant une réponse majeure à l’immunothérapie. A. Histoire clinique du patient. B..Réponse complète sur la métastase hépatique (indiquée par une flèche). L’étoile indique un kyste hépatique sans rapport avec la tumeur. Le Pembrolizumab est un anticorps dirigé contre un point de contrôle immunitaire (anti-PD1 [programmed cell death 1]). |
| Figure 2. Phénotype mutateur du patient répondeur. A. Charge mutationnelle (nombre de mutations par exome et par échantillon tumoral) du patient répondeur (n° 5) par rapport aux autres patients présentant un mélanome uvéal métastatique (plusieurs échantillons par patient peuvent être analysés). B..Profil mutationnel de la tumeur répondeuse. Le pourcentage des différentes mutations possibles est indiqué selon le contexte nucléotidique (nucléotide avant et après la mutation). SNV : single nucleotide variant. |
Le rôle de MBD4 dans la réparation de l’ADN est connu depuis une vingtaine d’années [6, 7]. Dans les modèles murins, l’inactivation de Mbd4 induit une multiplication par 3 du nombre de transitions somatiques CpG > TpG [8, 9]. Chez l’homme, des mutations tumorales délétères de MBD4 ont été observées dans des séries limitées de cancers colorectaux et gastriques présentant un déficit de réparation des mésappariements (mismatch repair ; MMR). Cependant, l’inactivation constitutionnelle de Mbd4 chez les souris déficientes pour MMR ne modifiait pas significativement le délai d’apparition des tumeurs ni le spectre tumoral [10]. Ces données suggèrent que des mutations de MBD4 sont susceptibles d’être induites par un déficit du MMR, mais les conséquences d’une telle inactivation, dans un contexte d’hypermutations, ne sont pas évidentes. Notre observation est la première identification d’un phénomène hypermutateur CpG > TpG induit par la mutation constitutionnelle de MBD4 chez l’homme. Les trois mutations constitutionnelles identifiées sont retrouvées dans la population générale à de très faibles fréquences (< 10-4 dans la base ExAC1). Ceci suggère que ces mutations sont un facteur de prédisposition aux MU et aux glioblastomes, les trois patients identifiés n’avaient toutefois ni un âge au diagnostic remarquablement jeune, ni d’autres tumeurs associées. De plus, aucune augmentation de l’incidence de tumeurs n’a été observée dans les modèles murins qui présentent une inactivation de Mbd4. Cependant, des modèles doublement inactivés pour Mbd4 et pour le gène Apc (adenomatous polyposis coli) présentaient une survie réduite, un doublement de la masse tumorale et un taux de mutations supérieur aux souris seulement déficientes en Apc. L’inactivation de MBD4 dans la lignée germinale pourrait être insuffisante pour initier la tumorigenèse, mais augmenterait la charge mutationnelle dans les tumeurs. Sa contribution à la progression tumorale dans les tumeurs humaines reste encore mal comprise.
La découverte d’un nouveau processus mutagène dans l’une des tumeurs solides de l’adulte avec la plus faible charge mutationnelle peut sembler contre-intuitive. Une des raisons envisageables serait que la perte récurrente du chromosome 3, sur lequel se trouve MBD4, favoriserait l’inactivation complète de ce gène dans les MU. La monosomie 3 dans les MU est systématiquement associée à une inactivation de BAP1 (BRCA1 [breast cancer type 1] associated protein 1), gène majeur du remodelage de l’épigénome qui code une ubiquitine carboxyl-terminal hydrolase. Cependant, la perte partielle ou complète du chromosome 3 est un évènement récurrent dans un grand nombre de tumeurs solides de l’adulte et ne peut donc à elle seule expliquer l’inactivation de MBD4 dans les MU. Le cas du glioblastome exprimant MBD4 muté que nous rapportons présentait une inactivation d’ATRX (X-linked helicase II). Une publication récente décrit également trois cas de leucémies aiguës myéloblastiques mutées pour MBD4 qui présentent des mutations de gènes remodeleurs de l’épigénome tels que IDH1/2 [isocitrate déshydroxygénase 1 ou 2] et DNMT3A [DNA methyltransferase 3A]) [11]. Les conséquences de l’inactivation de MBD4 sur le remaniement de l’épigénome et sur la tumorigenèse représentent ainsi des pistes majeures à explorer dans les thérapies anti-cancéreuses.