| |
| Med Sci (Paris). 34(11): 1003–1005. doi: 10.1051/medsci/2018244.Des piquets transmembranaires régulent la phagocytose en contrôlant la dynamique des récepteurs Arthur Radoux,1* Yaël Wilkie,1* and Oliver Nüsse2* 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Laboratoire de chimie physique, UMR8000, Université Paris-Sud, CNRS, Université Paris-Saclay, 91405Orsay, France MeSH keywords: Animaux, Structures de la membrane cellulaire, Polarité de la cellule, Antigènes CD44, Immunité innée, Fluidité membranaire, Protéines membranaires, Phagocytose, physiologie, métabolisme |
L’actualité scientifique
vue par les étudiants
du Master Biologie Santé,
module physiopathologie
de la signalisation,
Université Paris-Saclay Pour la troisième année, dans le cadre du module d’enseignement « Physiopathologie de la signalisation » proposé par l’université Paris-sud, les étudiants du Master « Biologie Santé » de l’université Paris-Saclay se sont confrontés à l’écriture scientifique. Ils ont sélectionné 8 articles scientifiques récents dans le domaine de la signalisation cellulaire présentant des résultats originaux, via des approches expérimentales variées, sur des thèmes allant des relations hôte-pathogène aux innovations thérapeutiques, en passant par la signalisation hépatique et le métabolisme. Après un travail préparatoire réalisé avec l’équipe pédagogique, les étudiants, organisés en binômes, ont ensuite rédigé, guidés par des chercheurs, une Nouvelle soulignant les résultats majeurs et l’originalité de l’article étudié. Ils ont beaucoup apprécié cette initiation à l’écriture d’articles scientifiques et, comme vous pourrez le lire, se sont investis dans ce travail avec enthousiasme ! Deux de ces Nouvelles sont publiées dans ce numéro, les autres le seront dans les prochains numéros de m/s. 
Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Olivier Guittet (maître de conférences, université Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Laure Coulombel. |
Phagocytose et mobilité des récepteurs La phagocytose est un des mécanismes majeurs du système immunitaire inné dont les principales cellules, nommées phagocytes, sont les macrophages, les polynucléaires neutrophiles et les cellules dendritiques. Ce mécanisme consiste en l’internalisation, via l’action de récepteurs, de particules solides (> 0,5 µm) telles que les micro-organismes, permettant ainsi leur destruction et la mise en place d’une réponse immune adaptée. Quand les micro-organismes sont couverts (opsonisés) d’immunoglobulines, ils sont reconnus par les récepteurs du fragment Fc (FcγR)1 des immunoglobulines exprimés par les phagocytes. L’homo-oligomérisation des FcγR, et donc leur mobilité sur la membrane plasmique, sont nécessaires au déclenchement de la phagocytose. Ainsi, la modification de la dynamique de diffusion latérale dans la membrane pourrait constituer un mécanisme possible de régulation de ce processus. |
Le modèle de la mosaïque fluide explique la diffusion latérale des éléments ancrés dans les membranes en définissant la membrane comme une bicouche lipidique dont la fluidité des éléments dépend de sa composition en lipides et protéines [1]. Cependant, diverses preuves empiriques indiquent que ce modèle n’est pas suffisant pour expliquer la mobilité des protéines membranaires. Une hypothèse est avancée, celle de « piquets » et de « clôtures », afin de mieux comprendre la dynamique des membranes [1]. Dans ce modèle, des protéines transmembranaires appelées piquets pourraient être immobilisées par la liaison de leur domaine cytoplasmique à l’actine, celle-ci formant une clôture. Cet ensemble protéique, représenté par des piquets et des clôtures, limiterait le déplacement des autres molécules de la membrane. |
CD44, un piquet potentiel L’équipe de Freeman et al. [2] a exploré la possibilité que la protéine CD44 se comporte comme un potentiel piquet transmembranaire. Son domaine intracellulaire permet sa liaison au cytosquelette d’actine via l’ezrine, une protéine de la famille des ERM (ezrine/radixine/moesine) [3], ce qui entraine son immobilisation dans la membrane. Les résultats de cette étude montrent que l’abondance de CD44 et son immobilité jouent un rôle important dans la mobilité des autres molécules membranaires dont, notamment, celle des récepteurs FcγR. La mobilité de ces récepteurs est réduite, empêchant leur homo-oligodimérisation et donc l’activation de la phagocytose. |
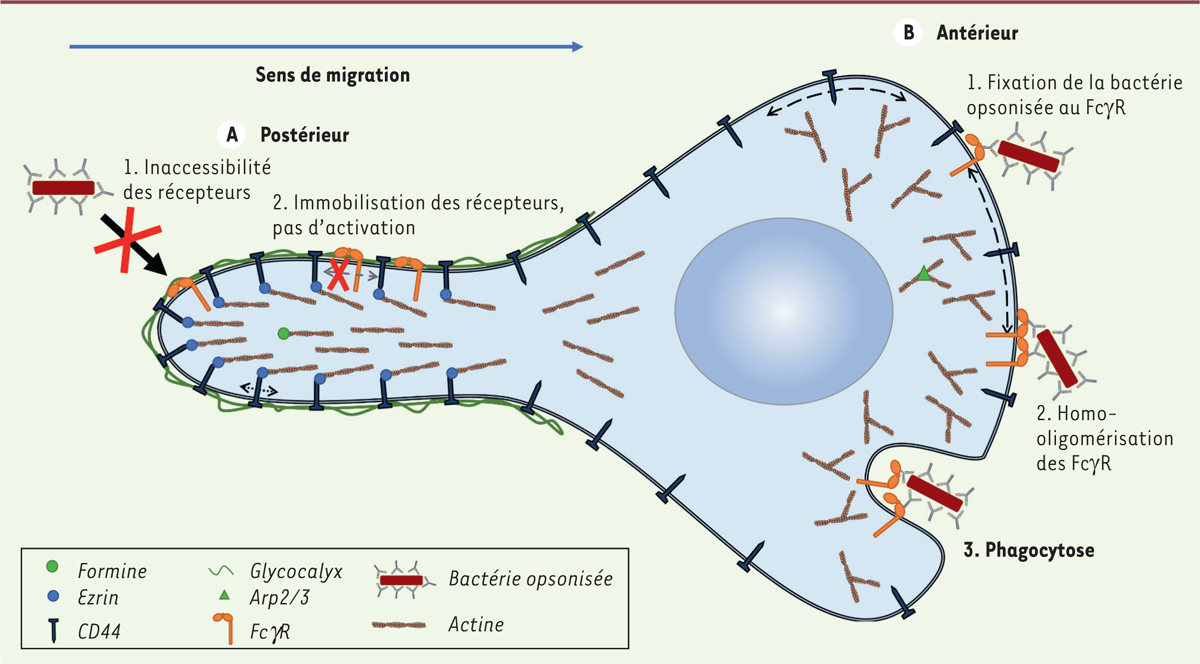
Polarisation dynamique de la phagocytose Par l’intermédiaire d’un arsenal de techniques sophistiquées d’imagerie photonique, comme le traçage de particules uniques et la quantification de leur mouvement, les auteurs ont pu démontrer que l’attachement de CD44 au cytosquelette via les protéines ERM n’est pas irréversible. Ainsi, CD44 peut présenter trois types de mouvement différents : libre, confiné-mobile et immobile. La transition entre ces trois états de mobilité peut s’expliquer par le fait que le cytosquelette est très dynamique et se remodèle constamment afin de permettre aux cellules d’interagir avec leur environnement, notamment dans le modèle des phagocytes qui ont été étudiés ici. Dans les phagocytes comme dans d’autres cellules, on distingue un réseau d’actine branché formé en réponse à Arp2/32,, et un réseau d’actine linéaire polymérisé en réponse aux Rho-GTPases et induit par la formine3. Or, comme le montre cet article, CD44 se fixe préférentiellement au réseau d’actine linéaire dont les filaments sont parallèles à la membrane et pourraient verrouiller les liaisons des protéines ERM auxquelles CD44 est attaché. Une complexité supplémentaire vient du fait que dans les cellules, les réseaux d’actine linéaires et branchés coexistent mais sont présents dans des régions subcellulaires distinctes. Dans une cellule en migration, le réseau branché est abondant dans la partie antérieure, vers le front de migration, alors que le réseau linéaire prédomine dans la partie postérieure. Freeman et al. ont également observé une polarisation des protéines ERM, présentes en majorité sur la face postérieure. La présence de ces protéines et de l’actine linéaire dans la partie postérieure de la cellule induit alors une immobilisation de CD44 et, par conséquent, l’augmentation du confinement des récepteurs FcγR. Au front de migration, le réseau branché ne permet pas de freiner la mobilité des récepteurs FcγR par CD44, ce qui faciliterait ainsi la phagocytose. Des études fonctionnelles sur la distribution des réseaux d’actine ont permis de corroborer ces résultats. Ainsi, l’observation que des bactéries Salmonella opsonisées par des immunoglobulines sont internalisées essentiellement dans la partie antérieure de la cellule, confirme la polarité fonctionnelle du macrophage dans la phagocytose, que ce soit ou non via le confinement des récepteurs FcgR par CD44. |
Le glycocalyx, nouvel acteur dans la régulation de la phagocytose La protéine CD44 se lie par son domaine extracellulaire à l’acide hyaluronique, un des principaux composants du glycocalyx (enveloppe péricellulaire). Le rôle de cette liaison restait jusqu’à présent peu étudié. Par des mécanismes de surexpression/suppression de cette enveloppe, les chercheurs ont montré son influence sur la diffusion latérale des protéines membranaires du macrophage, et donc sur celle des FcγR. L’augmentation de la concentration du glycocalyx corrèle avec une diffusion ralentie des molécules membranaires et l’absence de glycocalyx avec une plus grande mobilité. L’utilisation de cellules déficientes en CD44 annihile les effets du glycocalyx, prouvant l’importance de la liaison CD44-acide hyaluronique dans la mobilité membranaire et ajoutant ainsi une nouvelle dimension au modèle des piquets. Freeman et al. montrent aussi l’importance du glycocalyx dans l’accessibilité des particules aux FcγR. La phagocytose ne peut avoir lieu qu’après liaison entre la bactérie et les récepteurs du phagocyte. La diminution de la phagocytose et du nombre de particules liées au FcγR provoquée par une surexpression d’acide hyaluronique démontre que le glycocalyx peut également s’apparenter à une barrière d’accès entre les éléments à phagocyter et le macrophage. L’ensemble des résultats permettent de construire un modèle dans lequel CD44 agit comme un piquet membranaire composant de clôtures intracellulaires (actine) et extracellulaires (glycocalyx), limitant ainsi fortement la diffusion latérale des récepteurs FcγR membranaires (Figure 1). L’avenir nous dira si ce principe s’applique aussi à d’autres familles de récepteurs.
 | Figure 1. Régulation de la phagocytose dans la partie postérieure (A) et antérieure (B) de la cellule. La régulation de la phagocytose fait intervenir différents facteurs. A.. Le glycocalyx lié par le domaine extracellulaire de CD44 empêche l’accès des bactéries opsonisées aux récepteurs de phagocytose, FcγR. De plus, l’immobilisation importante des protéines CD44 empêche la mobilité et donc l’homo-dimérisation des FcγR, les rendant ainsi inactifs. B. Au contraire, les protéines CD44 mobiles permettent le dynamisme et donc la dimérisation des récepteurs FcγR, rendant ainsi possible le processus de la phagocytose. |
|
Footnotes |
1.
Kusumi
A
Fujiwara
TK
Chadda
R
et al. Dynamic organizing principles of the plasma membrane that regulate signal transduction: commemorating the fortieth anniversary of Singer and Nicolson’s fluid-mosaic model . Annu Rev Cell Dev Biol. 2012; ; 28 : :215.–250. 2.
Freeman
A
Vega
A
Riedl
M
et al. Transmembrane pickets connect cyto-and pericellular skeletons forming barriers to receptor engagement . Cell. 2018; ; 172 : :305.–317. 3.
Mori
T
Kitano
K
Terawaki
S
et al. Structural basis for CD44 recognition by ERM proteins . J Biol Chem. 2008; ; 283 : :29602.–29612. |