| |
| Med Sci (Paris). 34(12): 1107–1109. doi: 10.1051/medsci/2018303.Hépatocarcinome Pourquoi fermenter quand on peut respirer ? Blandine Roux,1* Laura Noyau,1** and Boris Julien2*** 1M1 Biologie-Santé, Université Paris-Saclay, 91405Orsay, France 2Institut Curie, U1021/UMR3347, Université Paris-Saclay, 91405Orsay, France |

Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Olivier Guittet (maître de conférences, université Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Laure Coulombel. |
Changements métaboliques dans les cellules tumorales, l’effet Warburg L’hépatocarcinome ou carcinome hépatocellulaire (CHC) est un cancer primitif du foie issu de la prolifération néoplasique des hépatocytes, principal type cellulaire hépatique. Il survient presque toujours dans le contexte d’une maladie hépatique préexistante (par exemple hépatite virale C ou B) au terme d’une évolution sur deux à trois décennies. L’absence de traitements efficaces des CHC est la conséquence de notre méconnaissance des mécanismes cellulaires de leur développement. Il est maintenant largement admis que les transformations néoplasiques trouvent leur origine dans des altérations génétiques, environnementales, mais également métaboliques. Par exemple, dans une cellule normale, les oses sont principalement oxydés en présence d’oxygène après la glycolyse, lors de la respiration mitochondriale, permettant ainsi la production d’énergie. En revanche, dans de nombreuses tumeurs, la production d’énergie à partir des oses s’effectue essentiellement au sein de la glycolyse indépendamment de la disponibilité en oxygène. Cette voie métabolique est alors activée de manière excessive et ses produits sont convertis en lactate lors de la fermentation. Cette « reprogrammation » métabolique est nommée glycolyse aérobie ou effet Warburg, du nom du chercheur qui l’a mise en évidence en 1924 [1]. Ce processus procure aux cellules tumorales un avantage compétitif sur les cellules environnantes. Cela leur permet notamment de capter une plus grande quantité de glucose et de synthétiser l’ATP plus rapidement que par les processus de respiration mitochondriale, et, en même temps, de produire en grande quantité les substrats (pyruvate et lactate) nécessaires à leur anabolisme et à leur croissance. La glycolyse aérobie jouant un rôle déterminant dans le développement tumoral, l’identification des voies de signalisation régulant sa mise en place lors des HCC pourrait permettre le développement de nouvelles stratégies thérapeutiques. Dans une étude récente publiée dans Hepatology [2], Chen et al. montrent l’importance de la protéine nucléaire high mobility group box 1 (HMGB1) dans le déclenchement du processus tumoral des HCC et l’effet Warburg qui lui est associé. Cette étude met en évidence pour la première fois un lien entre HMGB1 et la cascade de signalisation YAP (yes-associated protein)/HIF1α (hypoxia-inducible factor 1α), et la reprogrammation métabolique dans un contexte tumoral. |
HMGB1, une protéine chaperonne de l’ADN, intervient dans l’émergence des CHC et l’effet Warburg En conditions physiologiques, la protéine HMGB1 est exprimée dans le noyau et joue un rôle de cofacteur de la transcription en se liant à l’ADN et en modifiant son accessibilité [3]. Elle interagit avec et module l’activité de nombreux facteurs de transcription, dont certains jouent un rôle majeur dans le développement tumoral, comme la protéine p53 [4]. Cette protéine nucléaire a été également décrite comme un signal de danger : elle peut être libérée dans certaines conditions pathologiques - telles que les CHC - et elle serait impliquée dans la migration et la croissance des cellules tumorales ainsi que dans la formation de métastases [5]. Cependant, aucune étude n’avait jusqu’à maintenant étudié l’implication de l’activité nucléaire de HMGB1 dans la reprogrammation métabolique associée à la tumorigenèse. Afin d’explorer cette question, Chen et al. ont utilisé des souris invalidées génétiquement pour HMGB1 (hmgb1-/-) spécifiquement dans les hépatocytes. Un carcinogène hépatique (diéthylnitrosamine, DEN) a été injecté par voie intrapéritonéale à des souris hmgb1-/- nouveau-nés, qui développeront un CHC à l’âge adulte. Dans ce modèle hmgb1-/-, Chen et al. [2] ont montré que l’absence de la protéine HMGB1 dans les hépatocytes les protégeait du développement d’un hépatocarcinome (la mesure était faite trois et cinq mois après l’injection de DEN), par comparaison à ce qui était observé chez les souris sauvages. Néanmoins, cette protection n’opérait plus 10 mois après l’injection de DEN, suggérant que HMGB1 n’intervient que lors de la mise en place du processus tumoral. Les auteurs ont observé une diminution sélective de la sécrétion de lactate mesurée dans le sérum des souris hmgb1-/- traitées par le DEN, ainsi que dans les cultures d’hépatocytes dérivés de ces animaux ou de lignées tumorales hépatiques après invalidation génétique de hmgb1. Dans les deux modèles, l’expression des gènes codant pour des protéines associées à la glycolyse aérobie (transporteur du glucose, enzymes de la glycolyse et de la fermentation lactique) est également diminuée. Les auteurs ont conclu de ces observations que HMGB1 régulait la reprogrammation métabolique, aboutissant à une glycolyse anaérobie très précocement lors du développement des CHC. |
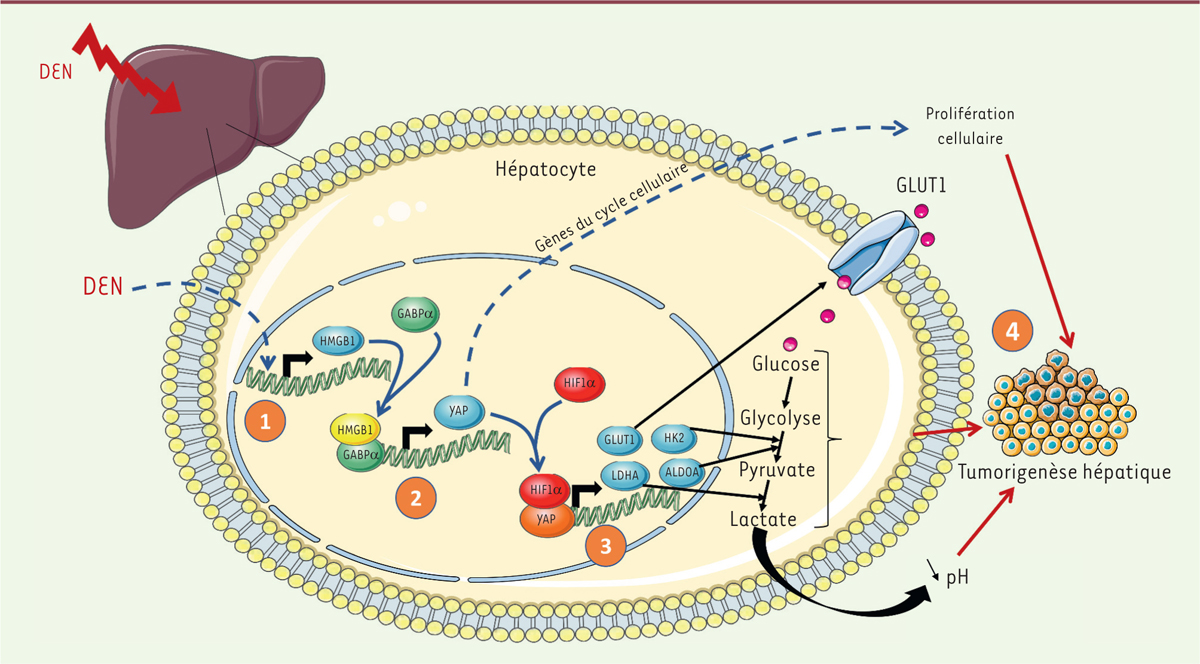
HMGB1, nouveau régulateur des voies YAP et d’HIF1a Les auteurs ont par la suite recherché les partenaires de HMGB1 lui permettant de participer au développement tumoral. Une première observation était la diminution de l’index mitotique précocement après l’injection de DEN aux souris hmgb1-/-. L’étude des différentes voies de signalisation impliquées dans la régulation de la prolifération des cellules tumorales a montré que seule la voie Hippo - promouvant la prolifération et la survie [6] - semblait altérée par l’absence d’expression d’HMGB1, mais uniquement aux temps précoces après traitement par le DEN. Même si plusieurs acteurs de cette voie étaient affectés, cette altération concernait plus particulièrement le facteur de transcription YAP, effecteur principal de la voie Hippo. Chen et al. ont montré qu’après traitement par le DEN, l’expression de la protéine YAP et de ses gènes cibles - tels que ccnd1 ou myc - chez les souris hmgb1-/- était moindre que celle qui était observée chez les souris de phénotype sauvage. Des expériences ex vivo sur des lignées de CHC humains et des hépatocytes issus de souris hmgb1-/- ont également mis en évidence l’implication de YAP dans les effets protumoraux de HMGB1. En effet, le phénotype antiprolifératif et métabolique qui est observé après l’invalidation de HMGB1 est reproduit par l’invalidation de YAP dans des cellules hmgb1+/+ ; a contrario, un phénotype sauvage est restauré par la surexpression de YAP dans des cellules hmgb1-/-. La régulation de l’effet Warburg par HMGB1 via YAP nécessite néanmoins l’intervention d’HIF1α, un acteur clé de la régulation métabolique en réponse à l’hypoxie [7]. En effet, en présence d’un taux élevé de YAP, HMGB1 permet la formation d’un complexe entre YAP et HIF1α, complexe qui régule l’expression des gènes associés à la mise en place de la glycolyse anaérobie (Figure 1).  | Figure 1. Mécanisme de facilitation de la tumorigenèse hépatique par HMGB1 et YAP. Un traitement par le DEN induit l’expression précoce d’HMGB1 dans les hépatocytes (1). La formation d’un complexe entre HMGB1 et le facteur GABPα favorise l’expression de YAP (2). Ce facteur de transcription s’associe à HIF1α pour stimuler l’expression des protéines des différentes étapes de la glycolyse (GLUT1, HK2, LDHA, ALDOA) (3). La régulation des gènes du cycle cellulaire par YAP associée à l’effet Warburg et à la diminution du pH environnemental qui en découle favorisent le déclenchement de la tumorigenèse HCC (4). HK2 : hexokinase 2 ; LDHA : lactate déshydrogénase A ; ALDOA : aldolase, fructose-bisphosphate A) ; GLUT1 : transporteur de glucose de type 1 ; YAP : yes-associated protein ; HMGB1 : high mobility group box 1 ; GABPα : GA-binding protein α chain. |
|
Rôle intra ou extracellulaire d’HMGB1 ? Si physiologiquement HMGB1 est une protéine nucléaire impliquée dans la régulation de la transcription, elle est essentiellement connue comme un signal de danger pro-inflammatoire, libéré dans le milieu extracellulaire dans des conditions pathologiques et capable de se fixer sur les récepteurs de la famille des TLR (toll-like receptor) [8]. Or, dans cet article, les auteurs avancent des arguments en faveur d’un rôle intracellulaire d’HMGB1. Le principal d’entre eux est la mise en évidence de la formation d’un complexe entre HMGB1 et GAPBα (GA-binding protein α), un des principaux régulateurs de la transcription de YAP dans le foie après un traitement par le DEN. Ce complexe est identifié dans les expériences de co-immunoprécipitation de chromatine (CHIP) : il y a co-immunoprécipitation du promoteur de YAP avec HMGB1 et GAPBα dans les noyaux d’hépatocytes en culture. Toutefois, si cette interaction entre HMGB1 et le promoteur de YAP est indéniable, elle n’exclut pas une action extracellulaire de HMGB1 dans les effets biologiques observés. En effet, plusieurs travaux avaient déjà mis en évidence un lien entre la présence d’HMGB1 extracellulaire, le développement des CHC [5] et les perturbations métaboliques [9]. De plus, l’inhibiteur utilisé pour bloquer les effets de HMGB1 in vivo et ex vivo a été essentiellement décrit comme inhibant l’action pro-inflammatoire extracellulaire de HMGB1, même si son action sur la capacité de fixation de HMGB1 à l’ADN est décrite comme limitée [10]. Cette étude montre donc que la voie de signalisation HMGB1-YAP-HIF1α joue un rôle déterminant dans la reprogrammation métabolique qui intervient dans les phases précoces de développement d’un CHC. La portée de cette étude dépasse cependant le simple décryptage des évènements moléculaires, car les conséquences sur la tumorigenèse et l’effet Warburg d’une invalidation génétique (souris KO et/ou shARN) de HMGB1 et YAP ont été reproduites par l’utilisation d’inhibiteurs pharmacologiques spécifiques de chacune de ces deux protéines. Le ciblage des différents acteurs de cette voie pourrait donc constituer une nouvelle stratégie thérapeutique aux stades précoces d’un CHC. |
1.
Liberti MV, Locasale JW. The Warburg effect: how does it benefit cancer cells? . Trends Biochem Sci. 2016; ; 41 : :211.–218. 2.
Chen R, Zhu S, Fan XG, et al. High mobility group protein B1 controls liver cancer initiation through yes-associated protein-dependent aerobic glycolysis . Hepatology. 2018; ; 67 : :1823.–1841. 3.
Kang R, Zhang Q, Zeh HJ, et al. HMGB1 in cancer: good, bad, or both? . Clin Cancer Res. 2013; ; 19 : :4046.–4057. 4.
Livesey KM, Kang R, Vernon P, et al. p53/HMGB1 complexes regulate autophagy and apoptosis . Cancer Res. 2012; ; 72 : :1996.–2005. 5.
Yan HX, Wu HP, Zhang HL, et al. p53 promotes inflammation-associated hepatocarcinogenesis by inducing HMGB1 release . J Hepatol. 2013; ; 59 : :762.–768. 6.
Yu FX, Zhao B, Guan KL. Hippo pathway in organ size control, tissue homeostasis, and cancer . Cell. 2015; ; 163 : :811.–828. 7.
Courtnay R, Ngo DC, Malik N, et al. Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K . Mol Biol Rep. 2015; ; 42 : :841.–851. 8.
Yang H, Antoine DJ, Andersson U, Tracey KJ. The many faces of HMGB1: molecular structure-functional activity in inflammation, apoptosis, and chemotaxis . J Leukoc Biol. 2013; ; 93 : :865.–873. 9.
Tohme S, Ho Y, Liu Y, et al. Hypoxia mediates mitochondrial biogenesis in hepatocellular carcinoma to promote tumor growth through HMGB1 and TLR9 interaction . Hepatology. 2017; ; 66 : :182.–197. 10.
Mollica L, De Marchis F, Spitaleri A, et al. Glycyrrhizin binds to high-mobility group box 1 protein and inhibits its cytokine activities . Chem Biol. 2007; ; 14 : :431.–441. |