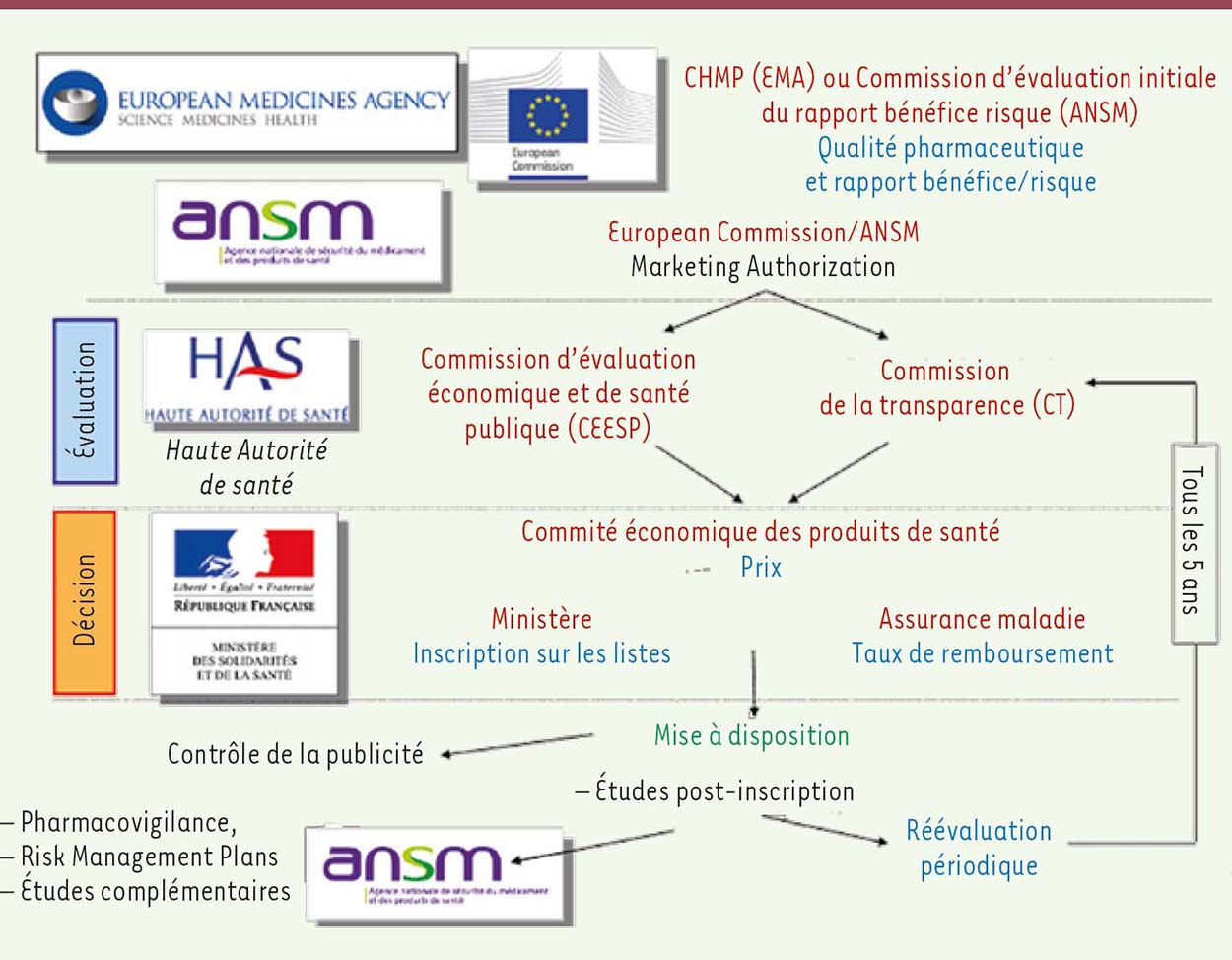
Un nouveau médicament doit effectuer tout un parcours avant d’atteindre le patient, avec le statut de médicament remboursé et disponible. Il s’agit de l’autorisation de mise sur le marché par l’agence européenne de médicament. Le contexte est en l’occurrence pleinement européen et les règles sont communes depuis 1965.
La HAS rend des avis pour éclairer la décision prise par le comité économique des produits de santé, qui est en l’occurrence nationale. Il revient en effet à chaque état membre d’organiser son service de santé et de décider de son financement.
La HAS dispose de commissions d’évaluation qui se basent sur des données scientifiques touchant le domaine clinique et les sciences économiques. Elle doit renseigner la décision et constitue donc une sorte d’interface entre la science et la décision qui a des particularités nationales.
Les commissions d’évaluation des produits évaluent ces derniers en fonction de critères qu’elles ne décident pas elles-mêmes. Ceux-ci sont fixés par les textes réglementaires et législatifs. Les critères ne sont donc pas tout à fait superposables d’un pays à un autre et diffèrent parfois grandement.
Je souhaiterais rappeler qu’on ne fait pas qu’évaluer au moment de l’AMM. Des actions sont développées en amont. Des rencontres précoces peuvent être organisées avec les firmes, qui présentent alors leur plan de développement et peuvent poser des questions aux instances afin d’éviter qu’elles arrivent au moment de l’AMM avec des données cliniques jugées non pertinentes pour répondre aux questions de SMR. On discute alors du choix des comparateurs et des points de jugement, ainsi que de la définition de la population à l’étude. Après l’AMM, une activité s’est beaucoup développée, qui porte sur les données en vie réelle et les réévaluations.
Par ailleurs, lorsqu’une firme dépose un dossier, celui-ci est pris en compte par les évaluateurs internes de la HAS, qui effectuent une évaluation- analyse, sans tirer de conclusions. Un document préparatoire est remis au comité auquel la loi française a donné la responsabilité de fournir la deuxième partie de l’évaluation, qui est l’évaluationappréciation. La commission transparence pour l’évaluation clinique fait alors collaborer des experts externes. Les patients sont aussi impliqués. L’avis est ensuite transmis au décideur.
L’avis européen se trouve exclu du champ de la coopération européenne, mais les rencontres précoces organisées pour discuter des plans de développement doivent être envisagées au niveau européen.
Les études observationnelles constituent un domaine de coopération actuellement en cours de développement. Les données ne sont intéressantes que si l’on travaille avec différents pays.
Il est également possible d’effectuer des analyses conjointes et des guides méthodologiques visant à assurer le respect des mêmes règles d’évaluation.