| dc.contributor.author | Cadet, E | fr_FR |
| dc.contributor.author | Warin, R | fr_FR |
| dc.contributor.author | Perez, AS | fr_FR |
| dc.contributor.author | Capron, D | fr_FR |
| dc.contributor.author | Rochette, J | fr_FR |
| dc.date.accessioned | 2012-08-30T12:35:23Z | |
| dc.date.available | 2012-08-30T12:35:23Z | |
| dc.date.issued | 2001 | fr_FR |
| dc.identifier.citation | Cadet, E ; Warin, R ; Perez, AS ; Capron, D ; Rochette, J, Des génotypes rouillés..., Med Sci (Paris), 2001, Vol. 17, N° 6-7; p.753-9 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/2000 | |
| dc.description.abstract | Il existe deux grands groupes de maladies génétiques
responsables d’une surcharge en fer – les thalassémies et
les hémochromatoses – qui détiennent des records de
prévalence mais n’affectent pas les mêmes populations. Si
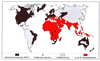
l’on porte sur un planisphère les zones de leur
distribution respective, on constate que, là où les
thalassémies sont absentes, l’hémochromatose est présente.
De nombreuses enquêtes permettent désormais d’établir les
fréquences de ces différents allèles morbides en fonction
des origines géographiques voire ethniques des sujets
testés. Ainsi, en ce qui concerne la mutation C282Y du
gène HFE-I (hémochromatose génétique), sa fréquence
moyenne en Europe est de 6,6 % et décroît selon un
gradient nord-ouest/sud-est. Une pression de sélection
pour les mutations thalassémiques par l’agent du
paludisme a été proposée. Pour l’hémochromatose, il est
peu probable que l’ampleur de la mutation causale soit la
conséquence d’un phénomène de dérive génétique. L’âge
récent de la mutation et sa fréquence élevée sont en
défaveur d’une telle hypothèse. Nos résultats et ceux
d’autres équipes suggèrent, comme pour les thalassémies,
une forte pression de sélection des allèles mutés. Parmi les
hypothèses envisagées, celle d’une résistance à un agent
infectieux utilisant la protéine HFE comme récepteur
paraît plausible, sans que l’on puisse éliminer toutefois
un mode de sélection directe sur le métabolisme du fer. | fr |
| dc.description.abstract | Two main genetic entities lead to iron overload: hemochromatosis and thalassemia. Genetic hemochromatosis HFE-1 type is a common autosomal recessive disease affecting about 1/300 individuals of european descent. HFE-1 type hemochromatosis is associated with the C282Y mutation of the HFE gene, and the H63D mutation to a much lesser degree. Allele frequency of the C282Y type is about 6,6% in Europe and the average of the H63D allele frequency is about 13,4%. Thalassemia is prevalent in a wide belt of countries extending from the mediterranean basin down to Africa and through the Middle East, the indian subcontinent and into south east Asia and China. Population genetic studies show that thalassemias are common where primary hemochromatosis is not. There is little reproductive disavantage to C282Y homozygotes and even less to heterozygotes. No major disvantage appears for the H63D mutation. Our results suggest that there is or has been selection pressure favoring these mutations making genetic drift an unlikely explanation. Until now it has been assumed that the selective advantage conferred by HFE mutations was the prevention of iron deficiency; this would include protection against anemia due to hookworm infestation, multiples pregnancies, a diet lacking in iron or any combination of these factors. However if this were solely the case, then one might expect that one more of the HFE mutations would have reached fixation in countries where there are high-levels of anemia; this has not been observed yet. Because of wild-type HFE protein is expressed at the cell surface, one could speculate that this protein is the receptor for some infectious agents. The region of the protein that might be involved could be the exon 3 which encodes the < alpha > 1 domain where the H63D mutation is found. The C282Y mutation does not allow the HFE-1 protein to reach the cell surface. Like thalassemia, hemochromatosis could be the result of a selection pressure involving resistance to infectious agent. By now, the entire world population carries an unfortunate genetic burden leading to iron overload. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | Masson Périodiques, Paris | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [revue papier, ISSN : 0767-0974], 2001, Vol. 17, N° 6-7; p.753-9 | fr_FR |
| dc.title | Des génotypes rouillés... | fr |
| dc.title.alternative | The rusty genotypes. | fr_FR |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | UPRES-EA 26 29 et Service de Génétique Moléculaire Médicale UPJV &CHU Faculté de Médecine 3, Rue des Louvels 80036 Amiens | - |
| dc.identifier.doi | 10.4267/10608/2000 | |