| dc.contributor.author | Garlatti, Michèle | - |
| dc.contributor.author | Barouki, Robert | - |
| dc.date.accessioned | 2014-02-14T13:04:25Z | |
| dc.date.available | 2014-02-14T13:04:25Z | |
| dc.date.issued | 2002 | fr_FR |
| dc.identifier.citation | Garlatti, Michèle ; Barouki, Robert ; Le stress du réticulum endoplasmique : adaptation et toxicité, Med Sci (Paris), 2002, Vol. 18, N° 5; p. 585-594 ; DOI : 10.1051/medsci/2002185585 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/4971 | |
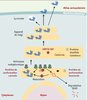
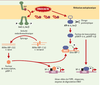
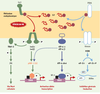
| dc.description.abstract | La majorité des protéines sécrétées et membranaires sont synthétisées dans le réticulum endoplasmique où elles sont repliées et assemblées avant d’être transportées. Dans certaines conditions cellulaires, des protéines de conformation anormale s’accumulent dans le réticulum endoplasmique et induisent la réponse UPR (unfolded protein response). Chez les mammifères, la réponse UPR inclut une activation de la transcription de gènes cibles et une profonde inhibition de la traduction, ce qui augmente les capacités de repliement et de dégradation et limite l’arrivée de nouvelles protéines dans le réticulum endoplasmique. Les voies de signalisation intracellulaire déclenchées par ce stress sont très originales : elles activent des protéines transmembranaires du réticulum endoplasmique et mettent en jeu un épissage non conventionnel d’un ARN messager. Lorsque cette réponse adaptative est insuffisante, une réponse apoptotique est déclenchée. Le stress du réticulum endoplasmique et/ou la mort cellulaire parfois induite lors de la réponse UPR semblent intervenir dans la physiopathologie de certaines maladies comme le déficit en α1-antitrypsine et la maladie de Parkinson juvénile à transmission autosomique récessive. | fr |
| dc.description.abstract | The majority of surface and secreted proteins are synthesized in the endoplasmic reticulum where they must acquire the right conformation and assemble before being transported. Under specific cellular conditions, unfolded protein can accumulate and initiate the unfolded protein response (UPR). In mammals, this adaptative response includes transcriptional activation of genes which enhances endoplasmic reticulum folding and endoplasmic reticulum-associated degradation capacities, and translation attenuation to limit further entry of proteins in the endoplasmic reticulum. The intracellular signal transduction cascades are mediated by endoplasmic reticulum transmembrane proteins and involve unconventional mRNA splicing. If this adaptative response is not sufficient, apoptotic death is triggered. The endoplasmic reticulum stress and/or cellular death, sometimes induced during UPR, seem involved in the physiopathology of some disease such as α1-antitrypsine deficiency and AR-JP, a specific form of Parkinson’s disease. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | Le Magazine : Articles de Synthèse | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2002, Vol. 18, N° 5; p. 585-594 | fr_FR |
| dc.title | Le stress du réticulum endoplasmique : adaptation et toxicité | fr |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Inserm U.490,Toxicologie moléculaire, Centre universitairedes Saints-Pères, Faculté de Médecine, 45, rue des Saints-Pères, 75270 Paris Cedex 06, France | fr_FR |
| dc.identifier.doi | 10.1051/medsci/2002185585 | fr_FR |