| dc.contributor.author | Parent, Lucie | - |
| dc.contributor.author | Sauvé, Rémy | - |
| dc.contributor.author | Bernèche, Simon | - |
| dc.contributor.author | Roux, Benoît | - |
| dc.date.accessioned | 2014-02-14T13:05:26Z | |
| dc.date.available | 2014-02-14T13:05:26Z | |
| dc.date.issued | 2002 | fr_FR |
| dc.identifier.citation | Parent, Lucie ; Sauvé, Rémy ; Bernèche, Simon ; Roux, Benoît ; A bas les barrières… d’énergie dans les canaux potassiques !, Med Sci (Paris), 2002, Vol. 18, N° 5; p. 605-609 ; DOI : 10.1051/medsci/2002185605 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/4973 | |
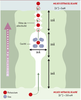
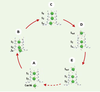
| dc.description.abstract | Un des grands défis de l’électrophysiologie cellulaire des 50 dernières années fut de comprendre comment la très grande sélectivité des canaux ioniques peut être compatible avec le flux rapide des ions (106 à 108 ions par seconde). Trois articles récents jettent un éclairage nouveau sur ce dilemme en décrivant, au niveau atomique, le passage des ions dans le canal KcsA, un canal potassique initialement isolé de la bactérie Streptomyces lividans. Le pore du canal est constitué de 7 sites de liaison principaux pour les ions potassiques répartis entre la cavité interne (1 site), le filtre de sélectivité (4 sites) et le vestibule externe du pore (2 sites). Seuls deux ions peuvent être présents de façon simultanée dans le filtre de sélectivité et la diffusion des ions dans le filtre procède dès lors par un mécanisme de knock-on où le passage d’un ion de la cavité centrale dans le site voisin du filtre entraîne la sortie d’un des ions déjà présent au niveau des sites externes. Les calculs d’énergie libre révèlent que le passage d’un ion d’un site à un site voisin se produit avec un minimum de changement dans l’énergie potentielle de l’ion. Cette conclusion est d’autant plus inattendue qu’elle remet en cause un des dogmes les plus importants de la théorie de la diffusion dans les canaux ioniques, selon lequel la déshydratation des ions constitue la plus haute barrière d’énergie que doit surmonter un ion pour diffuser dans un canal ionique. | fr |
| dc.description.abstract | K+ channels are transmembrane proteins that are essential for the transmission of nerve impulses. Three articles recently published in Nature attempts to elucidate the ion conduction through K+ channels at the atomic level using complementary approaches. There are seven main sites for ions along the pore axis: one in the pore cavity, closer to the intracellular face of the channel, four in the selectivity filter and two just beyond the external end of the pore. The internal cavity site is fully occupied by a single K+ ion but only half of the remaining six sites are occupied at any one time. The K+ ion in the internal cavity is stabilized by eight molecules of water. The crystal structure and the molecular dynamics free energy simulations concur that two distinct binding sites for K+ ions are present in the extracellular entryway. The ions in the selectivity filter (narrow region of the pore) move in a concerted fashion between two configurations, K+-water-K+-water and water-K+-water-K+, until a third ion enters, displacing the ion on the opposite side of the queue. For K+, the energy difference bet-ween these two configurations is close to zero implying that the process of ion conduction is limited by diffusion. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | Le Magazine : Mini-Synthèses | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2002, Vol. 18, N° 5; p. 605-609 | fr_FR |
| dc.title | A bas les barrières… d’énergie dans les canaux potassiques ! | fr |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Groupe de recherche en transport membranaire, Département de physiologie, Université de Montréal, CP 6128, Succursalle Centre-ville, Montréal, Québec, H3C 3J7, Canada | fr_FR |
| dc.contributor.affiliation | Groupe de recherche en transport membranaire, Department of Biochemistry, Weill Medical College of Cornell University, 1300 York Avenue, New York, NY 10021, États-Unis | fr_FR |
| dc.identifier.doi | 10.1051/medsci/2002185605 | fr_FR |