| dc.contributor.author | Lamour-Isnard, C | fr_FR |
| dc.contributor.author | Griffin-Shea, R | fr_FR |
| dc.date.accessioned | 2012-07-11T08:42:18Z | |
| dc.date.available | 2012-07-11T08:42:18Z | |
| dc.date.issued | 1997 | fr_FR |
| dc.identifier.citation | Lamour-Isnard, C ; Griffin-Shea, R, La voie des récepteurs Torso et Sevenless chez la drosophile : un modèle pour l'étude de la signalisation cellulaire par les récepteurs tyrosine kinase., Med Sci (Paris), 1997, Vol. 13, N° 10; p.1131-44 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/521 | |
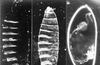
| dc.description.abstract | Chez la drosophile, des stratégies génétiques très efficaces
ont été mises au point pour étudier la transmission du
signal par les récepteurs tyrosine kinase Torso et Sevenless.
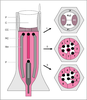
Ceux-ci sont impliqués respectivement dans la formation
des régions terminales de l’embryon, et dans celle de la cellule
photoréceptrice R7. Les composants de ces voies de
transmission du signal ont été identifiés et ordonnés depuis
la réception de ce signal jusqu’à la réponse nucléaire. Le
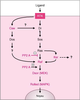
signal transmis par les RTK de drosophile emprunte la voie
des MAP-kinases, très conservée dans le monde animal.
D’autres intervenants récemment caractérisés modulent la
transmission du signal et contribuent à la spécificité cellulaire. | fr |
| dc.description.abstract | Comparative studies of signal transduction in vertebrates and invertebrates have revealed a universal intermediates signalling pathway between specific membrane tyrosine-kinase receptors (TKRs) and their downstream nuclear effectors. In Drosophila, powerful genetic techniques have enabled the identification and characterisation of the members of two TKR systems: the activation of the Torso receptor which triggers a cascade of kinase-related phosphorylations driving nuclear targets to direct specification of embryonic termini; and the Sevenless TKR which acts through the same intermediates to induce the differentiation of a specific photoreceptor cell (R7) in the eye ommatidium. Initially, mutant screens based on loss-of-function phenotypes (no embryonic ends, no R7 cell) succeeded in capturing those genes functioning only at the extremes of the signal chain - at the membrane (receptors, ligands and ligand-specific activators) and nuclear (transcription factors) levels. To isolate intermediate pathway members, common to multiple vital processes, screens were devised in which mutations altering the dosage of these gene products to sub-lethal levels nonetheless enhanced (enhancer mutations) or suppressed (suppressor mutations) phenotypes associated with mutated forms of Torso or Sevenless receptor partners. Once isolated, these loss-of-function and gain-of-function mutations are combined in the same animal to determine the order of gene functions. Furthermore, clones of homozygous mutant cells can be generated in heterozygous animals to pinpoint in vivo sites of action. Finally, the ability to introduce genes that have been mutagenised in vitro into fly embryos provides the ultimate test for hypotheses derived from genetic, biochemical and molecular biological analyses. Through these strategies, not only have the now-familiar Ras-MAPK intermediates been identified, but some 30-40 potentially new interacting genes have been defined, which reveal new aspects of these pathways, their fine regulation and the mechanisms providing the specificity of the cellular response. [References: 46] | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | Masson, Paris | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [revue papier, ISSN : 0767-0974], 1997, Vol. 13, N° 10; p.1131-44 | fr_FR |
| dc.title | La voie des récepteurs Torso et Sevenless chez la drosophile : un modèle pour l'étude de la signalisation cellulaire par les récepteurs tyrosine kinase. | fr |
| dc.title.alternative | The Torso and Sevenless pathways in Drosophila : a model system for cellular signalisation by tyrosine-kinase receptors | fr_FR |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Laboratoire de genetique du developpement et evolution, Institut Jacques-Monod, 2, place Jussieu, 75251 Paris, France; UMR 314 CEA/Cnrs, departement de biologie moleculaire et biophysique des systemes integres, CEA/Grenoble, 17, rue des Martyrs, 38054 Grenoble, France | - |
| dc.identifier.doi | 10.4267/10608/521 | |