| dc.contributor.author | Maurin, Jean-Christophe | - |
| dc.contributor.author | Couble, Marie-Lise | - |
| dc.contributor.author | Thivichon-Prince, Béatrice | - |
| dc.contributor.author | Magloire, Henri | - |
| dc.date.accessioned | 2018-02-21T12:26:04Z | |
| dc.date.available | 2018-02-21T12:26:04Z | |
| dc.date.issued | 2013 | |
| dc.identifier.citation | Maurin, Jean-Christophe ; Couble, Marie-Lise ; Thivichon-Prince, Béatrice ; Magloire, Henri ; L’odontoblaste : Un acteur incontournable de la perception de la douleur dentinaire, Med Sci (Paris), 2013, Vol. 29, N° 3 ; p. 293-299 ; DOI : 10.1051/medsci/2013293016 | |
| dc.identifier.issn | 1958-5381 | |
| dc.identifier.uri | http://hdl.handle.net/10608/8086 | |
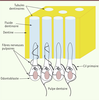
| dc.description.abstract | La sensibilité dentinaire est une situation clinique à laquelle est quotidiennement confronté le praticien, et elle constitue la symptomatologie de l’hyperesthésie dentinaire. L’hyperesthésie dentinaire est une pathologie fréquente, affectant le confort et la fonction buccale. Sa prise en charge est un véritable défi, car les mécanismes biologiques sous-tendant ces phénomènes sont encore très mal connus, probablement dus à l’architecture du complexe dentino-pulpaire et aux fonctionnalités particulières des odontoblastes. Ces cellules ciliées sont suspectées de jouer un rôle dans la transmission de la douleur. Leur situation spatiale unique, en relation étroite avec les terminaisons nerveuses pulpaires, suggère qu’elles pourraient jouer un rôle clé dans la transduction sensorielle des évènements survenant au sein de la dentine. Nos travaux ont permis l’identification, sur un plan morphologique et fonctionnel, de canaux ioniques mécano et/ou thermosensibles : canaux thermo-TRP (transient receptor potential) V1-4 (vanilloïde), A8 (ankyrine), et M3 (mélastatine), canaux K+ activés par l’entrée du Ca2+ (KCa), TWIK-related K+ channel (TREK)-1, et polycystines (PC1 et PC2). Ces canaux, situés sur la membrane odontoblastique et à la base du cil, sont susceptibles d’être impliqués dans la perception des variations de température et des mouvements du fluide dentinaire à l’intérieur des tubules. De plus, de nombreux canaux sodiques dépendant du voltage leur confèrent des propriétés d’excitabilité en réponse à l’injection d’un courant dépolarisant. Ces données renforcent ainsi l’hypothèse selon laquelle l’odontoblaste pourrait agir comme une cellule sensorielle impliquée dans la perception et la transmission de signaux nociceptifs. Cependant, les mécanismes d’intégration des signaux perçus par l’odontoblaste et leur transmission aux fibres nerveuses adjacentes restent à préciser. | fr |
| dc.description.abstract | Dentinal sensitivity is a clinical condition daily encountered by practitioners and constitutes the symptoms of dentinal hypersensitivity, a common dental pain affecting on average 30% of the population. However, the management of this pathology is not always effective due to the lack of knowledge particularly concerning the means by which dental nociceptive signals are transduced. The mechanisms underlying dentin sensitivity still remain unclear probably due to the structural and functional complexity of the players including odontoblasts, nerve endings and dentinal fluid running in the dentinal tubules. The unique spatial situation of odontoblasts, ciliated cells in close relationship with nerve terminals, suggests that they could play a pivotal role in the transduction of sensory events occurring within the dentin tissue. Our studies have identified mechano-thermosensitive transient receptor potential ion channels (TRPV1-4, TRPA8, TRPM3, KCa, TREK-1, PC1, PC2) localised on the odontoblastic membrane and at the base of the cilium. They could sense temperature variations or movements of dentinal fluid within tubules. Moreover, several voltage-gated sodium channels confer excitable properties to odontoblasts in response to injection of depolarizing currents. In vivo, these channels co-localize with nerve endings at the apical pole of odontoblasts, and their expression pattern seems to be correlated with the spatial distribution of stretch-activated KCa channels. All these data strengthen the hypothesis that odontoblasts could act as sensor cells able to transmit nociceptive signals. However, how cells sense signals and how the latter are transmitted to axons represent the main issue to be solved. | en |
| dc.language.iso | fr | |
| dc.publisher | Éditions EDK/Groupe EDP Sciences | |
| dc.relation.ispartof | M/S Revues | |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2013, Vol. 29, N° 3; p. 293-299 | |
| dc.subject.mesh | Voies afférentes | fr |
| dc.subject.mesh | Pulpe dentaire | fr |
| dc.subject.mesh | innervation | fr |
| dc.subject.mesh | Hypersensibilité dentinaire | fr |
| dc.subject.mesh | Température élevée | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Odontoblastes | fr |
| dc.subject.mesh | physiologie | fr |
| dc.subject.mesh | Perception de la douleur | fr |
| dc.subject.mesh | Dent | fr |
| dc.title | L’odontoblaste : Un acteur incontournable de la perception de la douleur dentinaire | fr |
| dc.title.alternative | Odontoblast: a key cell involved in the perception of dentinal pain | en |
| dc.type | Article | |
| dc.contributor.affiliation | EA 4691 biomatériaux et inflammation en site osseux, SFR CAP-Santé, université Reims Champagne-Ardenne, UFR d’odontologie, 2, rue du Général Koenig, 51100 Reims, France | |
| dc.contributor.affiliation | Pôle odontologie, CHU de Reims, Reims, France | |
| dc.contributor.affiliation | Institut de génomique fonctionnelle de Lyon, équipe odontoblaste et régénération des tissus dentaires, UMR CNRS 5242, école normale supérieure de Lyon, Lyon, France | |
| dc.contributor.affiliation | Université Claude Bernard, faculté d’odontologie, Lyon, France | |
| dc.identifier.doi | 10.1051/medsci/2013293016 | |
| dc.identifier.pmid | 23544384 | |