| dc.contributor.author | Le Douce, Valentin | - |
| dc.contributor.author | Cherrier, Thomas | - |
| dc.contributor.author | Riclet, Raphaël | - |
| dc.contributor.author | Rohr, Olivier | - |
| dc.contributor.author | Schwartz, Christian | - |
| dc.date.accessioned | 2018-04-24T12:59:40Z | |
| dc.date.available | 2018-04-24T12:59:40Z | |
| dc.date.issued | 2014 | |
| dc.identifier.citation | Le Douce, Valentin ; Cherrier, Thomas ; Riclet, Raphaël ; Rohr, Olivier ; Schwartz, Christian ; CTIP2, une protéine multifonctionnelle : Implication en physiopathologie cellulaire et en thérapeutique, Med Sci (Paris), 2014, Vol. 30, N° 8-9 ; p. 797-802 ; DOI : 10.1051/medsci/20143008019 | |
| dc.identifier.issn | 1958-5381 | |
| dc.identifier.uri | http://hdl.handle.net/10608/8453 | |
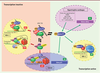
| dc.description.abstract | Le facteur de transcription CTIP2 (chicken ovalbumin upstream promoter transcription factor-interacting protein 2, ou BCL11b [B-cell lymphoma/leukemia 11b]) est une protéine aux rôles nombreux et dont l’importance dans la physiologie des cellules est maintenant bien étayée. Les mécanismes d’action de cette protéine commencent à être compris et font appel à des régulations épigénétiques de l’expression des gènes, ainsi qu’au contrôle de l’activité du facteur d’élongation P-TEFb (positive transcription elongation factor b). Grâce aux dérégulations de l’expression de CTIP2, nous comprenons mieux son association à de nombreuses pathologies, telles que le cancer et l’hypertrophie cardiaque. Une meilleure compréhension des mécanismes moléculaires impliqués dans ces processus physiopathologiques devraient permettre le développement de nouvelles voies thérapeutiques visant à corriger les effets délétères des dérégulations de CTIP2. Par ailleurs, CTIP2 et les protéines qui lui sont associées constituent aussi des cibles potentielles dans le cadre des stratégies de purge/réduction des réservoirs latents pour le VIH-1 (virus de l’immunodéficience humaine-1). | fr |
| dc.description.abstract | The transcription factor CTIP2 (BCL11B) is a multifunctional protein involved in numerous cell physiological processes. To date, many molecular mechanisms underlying this process have been discovered, which highlighted the importance of the epigenetic regulation of genes and the regulation of the elongation factor P-TEFb. Furthermore studies of the deregulation of CTIP2 showed the association of CTIP2 to numerous pathologies including cancer and cardiac hypertrophy. A better comprehension of the physiopathology of these diseases might lead to the design of therapeutical strategies intending to prevent CTIP2 deregulation. Moreover, CTIP2 and its associated proteins constitute potential targets in strategies aiming to reduce and/or purge HIV-1 cell reservoirs. | en |
| dc.language.iso | fr | |
| dc.publisher | Éditions EDK, Groupe EDP Sciences | |
| dc.relation.ispartof | M/S Revues | |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2014, Vol. 30, N° 8-9; p. 797-802 | |
| dc.subject.mesh | Syndrome d'immunodéficience acquise | fr |
| dc.subject.mesh | génétique | fr |
| dc.subject.mesh | thérapie | fr |
| dc.subject.mesh | virologie | fr |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Cardiomégalie | fr |
| dc.subject.mesh | Épigenèse génétique | fr |
| dc.subject.mesh | Infections à VIH | fr |
| dc.subject.mesh | traitement médicamenteux | fr |
| dc.subject.mesh | VIH-1 (Virus de l'Immunodéficience Humaine de type 1) | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Thérapie moléculaire ciblée | fr |
| dc.subject.mesh | Tumeurs | fr |
| dc.subject.mesh | Facteur B d'élongation transcriptionnelle positive | fr |
| dc.subject.mesh | antagonistes et inhibiteurs | fr |
| dc.subject.mesh | Protéines de répression | fr |
| dc.subject.mesh | physiologie | fr |
| dc.subject.mesh | Protéines suppresseurs de tumeurs | fr |
| dc.subject.mesh | Latence virale | fr |
| dc.title | CTIP2, une protéine multifonctionnelle : Implication en physiopathologie cellulaire et en thérapeutique | fr |
| dc.title.alternative | CTIP2, a multifunctional protein: cellular physiopathology and therapeutic implications | en |
| dc.type | Article | |
| dc.contributor.affiliation | Institut de parasitologie et de pathologie tropicale, EA7292, université de Strasbourg, Strasbourg, France | |
| dc.contributor.affiliation | Laboratory of protein interactions and signaling, université de Liège, Liège, Belgique | |
| dc.contributor.affiliation | IUT de Schiltigheim, 1 allée d’Athènes, Schiltigheim, France | |
| dc.contributor.affiliation | Institut universitaire de France, 103, boulevard Saint-Michel, 75005 Paris, France | |
| dc.identifier.doi | 10.1051/medsci/20143008019 | |
| dc.identifier.pmid | 25174758 | |