Cancer du sein
2008
| ANALYSE |
26-
Classification histologique et pathologie moléculaire
Le cancer du sein est le premier cancer de la femme en France mais il demeure encore une maladie mal connue. Afin d’appliquer le traitement le mieux adapté à chaque patiente, en fonction du type et de la gravité de sa maladie, il est nécessaire d’aborder le cancer du sein dans sa complexité. Pour atteindre ce but, de nombreuses questions restent à résoudre : quelles sont les différentes classes de cancers du sein ? Quels sont les gènes altérés à l’origine de l’oncogenèse mammaire ? Quelles sont les cellules touchées par ces altérations ? Des éléments de réponse à ces différentes questions existent dans les données actuelles de la littérature, et nous en présentons ici les principaux points, à côté des données histologiques classiques.
Classifications anatomopathologiques classiques
Classiquement on distingue les cancers in situ et les cancers infiltrants.
Cancers in situ
Les lésions correspondent à une prolifération de cellules malignes sans rupture de la membrane basale, donc ne comportant pas de risque théorique d’envahissement ganglionnaire.
Carcinomes canalaires in situ
Ce sont les plus fréquents, représentant 15 à 20 % des cancers du sein. La prolifération intéresse les canaux de petit, moyen et grand calibre. Plusieurs types architecturaux sont décrits et la classification actuelle reconnue d’après la conférence de consensus européenne de 1997 se fonde à la fois sur le grade cytologique, et la présence ou non de nécrose. La limite est floue entre carcinome in situ et lésions dites prénéoplasiques, les hyperplasies atypiques. Tavassoli (2005 ) unifie l’ensemble des néoplasies canalaires ou ductal intraepithelial neoplasia (DIN) et lobulaires ou lobular intraepithelial neoplasia (LIN) sous le terme de mammary intraepithelial neoplasia (MIN). L’auteur propose de faire rentrer les carcinomes in situ dans le même cadre nosologique de DIN 1c. La présence d’une microinfiltration (définie comme la présence d’un ou plusieurs foyers infiltrant de 1 mm ou moins), doit être précisée ; elle est d’autant plus fréquente que le grade est élevé, et s’associe à un risque théorique d’envahissement ganglionnaire.
) unifie l’ensemble des néoplasies canalaires ou ductal intraepithelial neoplasia (DIN) et lobulaires ou lobular intraepithelial neoplasia (LIN) sous le terme de mammary intraepithelial neoplasia (MIN). L’auteur propose de faire rentrer les carcinomes in situ dans le même cadre nosologique de DIN 1c. La présence d’une microinfiltration (définie comme la présence d’un ou plusieurs foyers infiltrant de 1 mm ou moins), doit être précisée ; elle est d’autant plus fréquente que le grade est élevé, et s’associe à un risque théorique d’envahissement ganglionnaire.
 ) unifie l’ensemble des néoplasies canalaires ou ductal intraepithelial neoplasia (DIN) et lobulaires ou lobular intraepithelial neoplasia (LIN) sous le terme de mammary intraepithelial neoplasia (MIN). L’auteur propose de faire rentrer les carcinomes in situ dans le même cadre nosologique de DIN 1c. La présence d’une microinfiltration (définie comme la présence d’un ou plusieurs foyers infiltrant de 1 mm ou moins), doit être précisée ; elle est d’autant plus fréquente que le grade est élevé, et s’associe à un risque théorique d’envahissement ganglionnaire.
) unifie l’ensemble des néoplasies canalaires ou ductal intraepithelial neoplasia (DIN) et lobulaires ou lobular intraepithelial neoplasia (LIN) sous le terme de mammary intraepithelial neoplasia (MIN). L’auteur propose de faire rentrer les carcinomes in situ dans le même cadre nosologique de DIN 1c. La présence d’une microinfiltration (définie comme la présence d’un ou plusieurs foyers infiltrant de 1 mm ou moins), doit être précisée ; elle est d’autant plus fréquente que le grade est élevé, et s’associe à un risque théorique d’envahissement ganglionnaire.Les facteurs qui gèrent le caractère infiltrant ne sont pas encore connus précisément mais des études par microdissection et puces à ADN sont en train d’émerger, et vont proposer un panel d’expression différentielle de gènes entre carcinome in situ associé ou non au caractère infiltrant, qui aideront sûrement à mieux comprendre le phénomène.
Carcinomes lobulaires in situ
Ils sont rares (environ 0,5 % des carcinomes mammaires) et sont actuellement plutôt considérés comme des marqueurs de risque de développer un cancer infiltrant (risque de 8 par rapport à la population normale) qu’il soit homo- ou controlatéral. La fréquence de survenue d’un cancer infiltrant est estimée entre 20 et 30 %, mais cette survenue est tardive dans les 10 à 25 ans suivant le diagnostic. Le cancer infiltrant qui se développe est à part égale lobulaire ou canalaire.
Cependant, des données moléculaires concernant le gène de la E-cadhérine révèle que des anomalies y sont retrouvées de façon précoce, dans ces stades in situ, et à un stade tardif lorsqu’il s’agit d’un carcinome lobulaire infiltrant, ce qui est relativement spécifique du caractère lobulaire. Les mécanismes d’inactivation dans les cancers lobulaires peuvent être multiples (hyperméthylation, mutations somatiques, modifications post-traductionnelles…), mais il ne semble pas en tous cas que des mutations germinales soient en cause, en d’autres termes la E-cadhérine ne fonctionne pas comme un gène de susceptibilité au cancer lobulaire.
Carcinomes infiltrants
Dans ce cadre, la prolifération tumorale dépasse la membrane basale et envahit le conjonctif palléal. L’origine du cancer est l’unité terminale ductulo-lobulaire. Plusieurs types histologiques sont décrits même si la grande majorité des cancers sont de type canalaire.
Le carcinome canalaire infiltrant représente plus de 70 % des carcinomes infiltrants. Il reproduit l’architecture des acini mammaires.
Deux étapes essentielles de la progression, sortes d’« intermédiaire » entre carcinome in situ et infiltrant sont les carcinomes microinvasifs et canalaires infiltrants à prédominance endocanalaire (CCIPE). La première définition correspond d’après l’OMS à un cancer infiltrant développé à partir d’un carcinome canalaire in situ dont il ne grève pas le pronostic. La définition de la microinfiltration n’est pas toujours consensuelle selon les auteurs, mais la définition TNM1
se fonde sur une taille < 1 mm, sans définir exactement le nombre de foyers. La deuxième entité, individualisée en 1982, est caractérisée par une prolifération tumorale constituée au moins aux trois-quarts de cancers in situ. La composante canalaire extensive en périphérie est souvent source de récidives locales.
Le carcinome lobulaire infiltrant est plus rare, représentant de 5 à 15 % des cancers infiltrants. Il est constitué de petites cellules généralement régulières et peu mitotiques, comportant une inclusion de mucus dans le cytoplasme. Ces cellules sont non cohésives et se disposent souvent « en file indienne » respectant les structures pré-existantes et le pronostic de ces cancers longtemps donné comme meilleur rejoint finalement celui des ductaux infiltrants.
D’autres formes existent comme le carcinome médullaire qui représente environ 1 à 5 % des cancers du sein et dont la définition histologique répond aux 5 critères définis par Ridolfi et coll. (1977 ) : plus de 75 % de circonscription de la tumeur, architecture syncitiale dans plus de 75 % de la tumeur, stroma lymphoplasmocytaire modéré à marqué, atypies nucléaires modérées à marquées, absence de différenciation glandulaire. Il touche souvent des femmes d’âge plutôt jeune, inférieur à 50 ans et est souvent retrouvé chez les patientes ayant une mutation de BRCA1.
) : plus de 75 % de circonscription de la tumeur, architecture syncitiale dans plus de 75 % de la tumeur, stroma lymphoplasmocytaire modéré à marqué, atypies nucléaires modérées à marquées, absence de différenciation glandulaire. Il touche souvent des femmes d’âge plutôt jeune, inférieur à 50 ans et est souvent retrouvé chez les patientes ayant une mutation de BRCA1.
 ) : plus de 75 % de circonscription de la tumeur, architecture syncitiale dans plus de 75 % de la tumeur, stroma lymphoplasmocytaire modéré à marqué, atypies nucléaires modérées à marquées, absence de différenciation glandulaire. Il touche souvent des femmes d’âge plutôt jeune, inférieur à 50 ans et est souvent retrouvé chez les patientes ayant une mutation de BRCA1.
) : plus de 75 % de circonscription de la tumeur, architecture syncitiale dans plus de 75 % de la tumeur, stroma lymphoplasmocytaire modéré à marqué, atypies nucléaires modérées à marquées, absence de différenciation glandulaire. Il touche souvent des femmes d’âge plutôt jeune, inférieur à 50 ans et est souvent retrouvé chez les patientes ayant une mutation de BRCA1.D’autres formes existent encore, dites de « bon pronostic » comme le carcinome tubuleux, composé essentiellement de petits tubes à une seule couche de cellules tumorales régulières ; le carcinome mucineux qui est une forme rare de la femme âgée, comportant de larges flaques de mucus extracellulaire, au sein desquelles flottent des îlots de cellules malignes ; le carcinome adénoïde cystique ou cylindrome comportant comme au niveau des glandes salivaires, une prolifération biphasique de petites cellules basaloïdes et un contingent de cellules épithéliales, l’ensemble s’agençant sur un mode cribriforme, tubulaire, trabéculaire ou massif ; le carcinome cribriforme infiltrant constitué en majorité de travées infiltrantes d’architecture cribriforme avec atypies légères à modérées.
Certaines formes sont connues pour leur mauvais pronostic comme le carcinome inflammatoire, défini sur des critères cliniques (sein rouge, chaud, aspect de peau d’orange, évolutivité rapide de la tumeur) et/ou pathologiques comme la présence d’emboles dans les lymphatiques du derme superficiel. Il correspond au stade T4d de la classification TNM. Le type histologique du carcinome n’est qu’un paramètre pronostique parmi d’autres dont la taille tumorale, le grade, le statut ganglionnaire… Une multitude de paramètres dont l’impact pronostique est variable a été diversement évalué selon les études (récepteurs hormonaux, surexpressions d’ERBB22
, mutation de p53...). À côté de l’histologie classique, la compréhension de ce qu’est et comment se développe le sein est une aide pour mieux appréhender le cancer du sein. Une nouvelle taxonomie moléculaire en découle.
Structure de l’épithélium mammaire : une communautécellulaire provenant de cellules souches
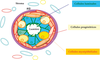
Pour comprendre l’oncogenèse mammaire et la classification actuelle des cancers du sein, il faut connaître l’histologie de l’épithélium mammaire normal. Ce dernier comprend deux types de cellules différenciées, les cellules luminales et les cellules myoépithéliales (figure 26.1 ). À cela il faut ajouter les cellules souches et les progéniteurs plus ou moins engagés sur une voie de différenciation. Les cellules luminales bordent la lumière des canaux et des lobules. Les cellules myoépithéliales entourent les cellules luminales et sont en contact avec la lame basale et le stroma environnant. Les cellules souches, plus rares, sont situées en position basale ou supra-basale, probablement au niveau de niches spécialisées.
). À cela il faut ajouter les cellules souches et les progéniteurs plus ou moins engagés sur une voie de différenciation. Les cellules luminales bordent la lumière des canaux et des lobules. Les cellules myoépithéliales entourent les cellules luminales et sont en contact avec la lame basale et le stroma environnant. Les cellules souches, plus rares, sont situées en position basale ou supra-basale, probablement au niveau de niches spécialisées.
 ). À cela il faut ajouter les cellules souches et les progéniteurs plus ou moins engagés sur une voie de différenciation. Les cellules luminales bordent la lumière des canaux et des lobules. Les cellules myoépithéliales entourent les cellules luminales et sont en contact avec la lame basale et le stroma environnant. Les cellules souches, plus rares, sont situées en position basale ou supra-basale, probablement au niveau de niches spécialisées.
). À cela il faut ajouter les cellules souches et les progéniteurs plus ou moins engagés sur une voie de différenciation. Les cellules luminales bordent la lumière des canaux et des lobules. Les cellules myoépithéliales entourent les cellules luminales et sont en contact avec la lame basale et le stroma environnant. Les cellules souches, plus rares, sont situées en position basale ou supra-basale, probablement au niveau de niches spécialisées.Les cellules luminales expriment des marqueurs associés aux récepteurs hormonaux (récepteurs des œstrogènes et de la progestérone), certaines cytokératines (CK8, CK18) ainsi que des facteurs de transcription spécifiques comme GATA3 et FOXA1. Les cellules myoépithéliales expriment d’autres cytokératines (CK14) et, à l’état très différencié, des marqueurs du muscle lisse (actine du muscle lisse).
L’orientation d’une cellule épithéliale mammaire vers le lignage luminal ou myoépithélial pourrait être sous le contrôle de gènes « maîtres ». GATA3 pourrait être un de ces gènes « maîtres » pour le lignage luminal. Chez la souris, la perte de GATA3 provoquée par une invalidation génique conditionnelle conduit à une expansion des cellules progénitrices luminales. GATA3 pourrait jouer le rôle de régulateur important de la différenciation luminale en maintenant l’état quiescent des cellules progénitrices et l’état différencié des cellules luminales (Al Hajj et coll., 2003 ; Asselin-Labat et coll., 2006
; Asselin-Labat et coll., 2006 et 2007
et 2007 ; Kouros-Mehr et coll., 2006
; Kouros-Mehr et coll., 2006 ). Pour démontrer le caractère « maître » de GATA3, ce facteur a été exprimé dans des cellules souches et les résultats montrent qu’il induirait bien une différenciation luminale. L’ensemble de ces données récentes suggère une implication de GATA3 dans les cancers du sein. De fait, une expression élevée de GATA3 est une signature des cancers luminaux peu envahissants (Bertucci et coll., 2000
). Pour démontrer le caractère « maître » de GATA3, ce facteur a été exprimé dans des cellules souches et les résultats montrent qu’il induirait bien une différenciation luminale. L’ensemble de ces données récentes suggère une implication de GATA3 dans les cancers du sein. De fait, une expression élevée de GATA3 est une signature des cancers luminaux peu envahissants (Bertucci et coll., 2000 ; Jenssen et coll., 2002
; Jenssen et coll., 2002 ). À l’inverse, il reste à prouver que la perte d’expression de GATA3 donne des tumeurs peu différenciées et envahissantes et à déterminer le rôle exact joué par GATA3 dans la progression des tumeurs du sein.
). À l’inverse, il reste à prouver que la perte d’expression de GATA3 donne des tumeurs peu différenciées et envahissantes et à déterminer le rôle exact joué par GATA3 dans la progression des tumeurs du sein.
 ; Asselin-Labat et coll., 2006
; Asselin-Labat et coll., 2006 et 2007
et 2007 ; Kouros-Mehr et coll., 2006
; Kouros-Mehr et coll., 2006 ). Pour démontrer le caractère « maître » de GATA3, ce facteur a été exprimé dans des cellules souches et les résultats montrent qu’il induirait bien une différenciation luminale. L’ensemble de ces données récentes suggère une implication de GATA3 dans les cancers du sein. De fait, une expression élevée de GATA3 est une signature des cancers luminaux peu envahissants (Bertucci et coll., 2000
). Pour démontrer le caractère « maître » de GATA3, ce facteur a été exprimé dans des cellules souches et les résultats montrent qu’il induirait bien une différenciation luminale. L’ensemble de ces données récentes suggère une implication de GATA3 dans les cancers du sein. De fait, une expression élevée de GATA3 est une signature des cancers luminaux peu envahissants (Bertucci et coll., 2000 ; Jenssen et coll., 2002
; Jenssen et coll., 2002 ). À l’inverse, il reste à prouver que la perte d’expression de GATA3 donne des tumeurs peu différenciées et envahissantes et à déterminer le rôle exact joué par GATA3 dans la progression des tumeurs du sein.
). À l’inverse, il reste à prouver que la perte d’expression de GATA3 donne des tumeurs peu différenciées et envahissantes et à déterminer le rôle exact joué par GATA3 dans la progression des tumeurs du sein.Cette coupe montre les différentes cellules épithéliales entourées de stroma. On distingue trois types de cellules : les cellules luminales, en contact avec la lumière, les cellules myoépithéliales, en contact avec la membrane basale (MB) et les cellules progénitrices (cellules souches et précurseurs immatures) en position basale ou supra-basale.
Proposition d’une classification pertinente
Jusqu’à la fin des années 1990, seules les données histologiques et cliniques permettaient de classer les différents types de cancer du sein. Plus récemment, l’utilisation de techniques génomiques à haut débit comme les puces à ADN a permis d’y ajouter une caractérisation moléculaire. Les premières études d’expression génique des cancers du sein ont montré au niveau moléculaire l’hétérogénéité de la maladie, déjà suspectée au vu des données cliniques et histologiques. Cinq sous-types majeurs exclusifs de cancers du sein ont été identifiés sur la base de l’expression transcriptionnelle d’environ 500 gènes (Sorlie et coll., 2003 ) : luminal A, luminal B, basal, ERBB2 et normal. Cette classification a ensuite été validée par plusieurs plateformes d’analyse transcriptionnelle, pour différentes populations de patientes et sur différentes formes anatomocliniques de la maladie. Elle permet de dégager des groupes de pronostic différent. Combinée à la classification histoclinique classique (Birnbaum et coll., 2004
) : luminal A, luminal B, basal, ERBB2 et normal. Cette classification a ensuite été validée par plusieurs plateformes d’analyse transcriptionnelle, pour différentes populations de patientes et sur différentes formes anatomocliniques de la maladie. Elle permet de dégager des groupes de pronostic différent. Combinée à la classification histoclinique classique (Birnbaum et coll., 2004 ; Charafe-Jauffret et coll., 2005
; Charafe-Jauffret et coll., 2005 ), elle représente une base nosologique, et confirmé l’intérêt de l’analyse transcriptionnelle.
), elle représente une base nosologique, et confirmé l’intérêt de l’analyse transcriptionnelle.
 ) : luminal A, luminal B, basal, ERBB2 et normal. Cette classification a ensuite été validée par plusieurs plateformes d’analyse transcriptionnelle, pour différentes populations de patientes et sur différentes formes anatomocliniques de la maladie. Elle permet de dégager des groupes de pronostic différent. Combinée à la classification histoclinique classique (Birnbaum et coll., 2004
) : luminal A, luminal B, basal, ERBB2 et normal. Cette classification a ensuite été validée par plusieurs plateformes d’analyse transcriptionnelle, pour différentes populations de patientes et sur différentes formes anatomocliniques de la maladie. Elle permet de dégager des groupes de pronostic différent. Combinée à la classification histoclinique classique (Birnbaum et coll., 2004 ; Charafe-Jauffret et coll., 2005
; Charafe-Jauffret et coll., 2005 ), elle représente une base nosologique, et confirmé l’intérêt de l’analyse transcriptionnelle.
), elle représente une base nosologique, et confirmé l’intérêt de l’analyse transcriptionnelle.Les sous-types luminaux A et basaux sont les plus affirmés et sont très différents l’un de l’autre (environ 20 % de gènes différentiellement exprimés). Le sous-type luminal A correspond à des cancers généralement de bas grade, exprimant des récepteurs hormonaux et d’évolution plutôt favorable. Leur traitement inclus de l’hormonothérapie dans la majorité des cas. Les gènes exprimés dans ces cancers sont associés au récepteur aux œstrogènes (Er) et à la différenciation luminale (GATA3). Les cancers basaux n’expriment ni les récepteurs hormonaux, ni ERBB2. Contrairement aux cancers luminaux, ils sont de haut grade et de mauvais pronostic. Très prolifératifs, ils expriment les gènes codant pour des régulateurs du cycle (cyclines, CDK…) et présentent fréquemment des mutations de TP53. Ce sous-type, traité classiquement par chimiothérapie, ne dispose pas encore de thérapie spécifique mais plusieurs cibles potentielles figurent dans la liste des gènes surexprimés (kinases, gènes du cycle…). Dans les lignées cellulaires dérivées de cancer du sein, il est possible de subdiviser le sous-type basal en A et B (Neve et coll., 2006 ). Le sous-type basal B pourrait être déterminé par l’expression de marqueurs du mésenchyme (vimentine). Il serait similaire au sous-type décrit dans les lignées comme « mésenchymal » (Charafe-Jauffret et coll., 2006
). Le sous-type basal B pourrait être déterminé par l’expression de marqueurs du mésenchyme (vimentine). Il serait similaire au sous-type décrit dans les lignées comme « mésenchymal » (Charafe-Jauffret et coll., 2006 ). La définition formelle des sous-types repose sur les profils d’expression mais, pour des raisons pratiques, beaucoup assimilent le sous-type basal aux cancers du sein « triple négatifs » (n’exprimant pas les récepteurs hormonaux et ne surexprimant pas ERBB2). Le sous-type ERBB2 se caractérise par une forte expression de ERBB2 et des gènes de l’unité d’amplification 17q12 autour de ERBB2 (Bertucci et coll., 2004
). La définition formelle des sous-types repose sur les profils d’expression mais, pour des raisons pratiques, beaucoup assimilent le sous-type basal aux cancers du sein « triple négatifs » (n’exprimant pas les récepteurs hormonaux et ne surexprimant pas ERBB2). Le sous-type ERBB2 se caractérise par une forte expression de ERBB2 et des gènes de l’unité d’amplification 17q12 autour de ERBB2 (Bertucci et coll., 2004 ). Ce sous-type peut être traité par un anticorps qui inhibe la voie ERBB2 comme le trastuzumab (Herceptine TM) ou un inhibiteur de tyrosine kinase comme le lapatinib (Konecny et coll., 2006
). Ce sous-type peut être traité par un anticorps qui inhibe la voie ERBB2 comme le trastuzumab (Herceptine TM) ou un inhibiteur de tyrosine kinase comme le lapatinib (Konecny et coll., 2006 ). Le sous-type luminal B regrouperait des cas luminaux moins différenciés et plus prolifératifs, et le sous-type normal reste assez mal défini. De nombreux cas de cancers du sein ne peuvent être inclus dans ces sous-types et demandent à être mieux caractérisés.
). Le sous-type luminal B regrouperait des cas luminaux moins différenciés et plus prolifératifs, et le sous-type normal reste assez mal défini. De nombreux cas de cancers du sein ne peuvent être inclus dans ces sous-types et demandent à être mieux caractérisés.
 ). Le sous-type basal B pourrait être déterminé par l’expression de marqueurs du mésenchyme (vimentine). Il serait similaire au sous-type décrit dans les lignées comme « mésenchymal » (Charafe-Jauffret et coll., 2006
). Le sous-type basal B pourrait être déterminé par l’expression de marqueurs du mésenchyme (vimentine). Il serait similaire au sous-type décrit dans les lignées comme « mésenchymal » (Charafe-Jauffret et coll., 2006 ). La définition formelle des sous-types repose sur les profils d’expression mais, pour des raisons pratiques, beaucoup assimilent le sous-type basal aux cancers du sein « triple négatifs » (n’exprimant pas les récepteurs hormonaux et ne surexprimant pas ERBB2). Le sous-type ERBB2 se caractérise par une forte expression de ERBB2 et des gènes de l’unité d’amplification 17q12 autour de ERBB2 (Bertucci et coll., 2004
). La définition formelle des sous-types repose sur les profils d’expression mais, pour des raisons pratiques, beaucoup assimilent le sous-type basal aux cancers du sein « triple négatifs » (n’exprimant pas les récepteurs hormonaux et ne surexprimant pas ERBB2). Le sous-type ERBB2 se caractérise par une forte expression de ERBB2 et des gènes de l’unité d’amplification 17q12 autour de ERBB2 (Bertucci et coll., 2004 ). Ce sous-type peut être traité par un anticorps qui inhibe la voie ERBB2 comme le trastuzumab (Herceptine TM) ou un inhibiteur de tyrosine kinase comme le lapatinib (Konecny et coll., 2006
). Ce sous-type peut être traité par un anticorps qui inhibe la voie ERBB2 comme le trastuzumab (Herceptine TM) ou un inhibiteur de tyrosine kinase comme le lapatinib (Konecny et coll., 2006 ). Le sous-type luminal B regrouperait des cas luminaux moins différenciés et plus prolifératifs, et le sous-type normal reste assez mal défini. De nombreux cas de cancers du sein ne peuvent être inclus dans ces sous-types et demandent à être mieux caractérisés.
). Le sous-type luminal B regrouperait des cas luminaux moins différenciés et plus prolifératifs, et le sous-type normal reste assez mal défini. De nombreux cas de cancers du sein ne peuvent être inclus dans ces sous-types et demandent à être mieux caractérisés.La différence entre les cancers basaux et luminaux est importante. Il s’agit probablement de deux maladies différentes. Ceci exige leur reconnaissance en routine et un traitement approprié. Ces sous-types peuvent être également reconnus au niveau protéique. Des études d’expression par immunohistochimie sur « tissue microarray » (microréseaux tissulaires) ont permis d’identifier les sous-types luminaux et basaux ainsi que des marqueurs protéiques de sous-types, comme P-cadhérine, moésine et CD44 pour les cancers basaux (Nielsen et coll., 2004 ; Abd El-Rehim et coll., 2005
; Abd El-Rehim et coll., 2005 ; Jacquemier et coll., 2005
; Jacquemier et coll., 2005 ; Dolled-Filhart et coll., 2006
; Dolled-Filhart et coll., 2006 ).
).
 ; Abd El-Rehim et coll., 2005
; Abd El-Rehim et coll., 2005 ; Jacquemier et coll., 2005
; Jacquemier et coll., 2005 ; Dolled-Filhart et coll., 2006
; Dolled-Filhart et coll., 2006 ).
).Différentes formes histocliniques de cancer du sein ont été étudiées. Les cancers du sein inflammatoires contiennent les cinq sous-types (Bertucci et coll., 2005 ), avec une prédominance de cancers basaux et ERBB2 (Van Laere et coll., 2006
), avec une prédominance de cancers basaux et ERBB2 (Van Laere et coll., 2006 ). Les cancers du sein médullaires sont des cancers exclusivement basaux, de même que les cancers héréditaires associés à une mutation de BRCA1 (Turner et Reis-Filho, 2006
). Les cancers du sein médullaires sont des cancers exclusivement basaux, de même que les cancers héréditaires associés à une mutation de BRCA1 (Turner et Reis-Filho, 2006 ). Les cancers du sein lobulaires seraient de deux types, luminal et normal (Korkola et coll., 2003
). Les cancers du sein lobulaires seraient de deux types, luminal et normal (Korkola et coll., 2003 ; Zhao et coll., 2004
; Zhao et coll., 2004 ). La possibilité d’intégrer ainsi progressivement la classification histoclinique et la classification moléculaire (Charafe-Jauffret et coll., 2005
). La possibilité d’intégrer ainsi progressivement la classification histoclinique et la classification moléculaire (Charafe-Jauffret et coll., 2005 ) devrait permettre une meilleure approche des traitements.
) devrait permettre une meilleure approche des traitements.
 ), avec une prédominance de cancers basaux et ERBB2 (Van Laere et coll., 2006
), avec une prédominance de cancers basaux et ERBB2 (Van Laere et coll., 2006 ). Les cancers du sein médullaires sont des cancers exclusivement basaux, de même que les cancers héréditaires associés à une mutation de BRCA1 (Turner et Reis-Filho, 2006
). Les cancers du sein médullaires sont des cancers exclusivement basaux, de même que les cancers héréditaires associés à une mutation de BRCA1 (Turner et Reis-Filho, 2006 ). Les cancers du sein lobulaires seraient de deux types, luminal et normal (Korkola et coll., 2003
). Les cancers du sein lobulaires seraient de deux types, luminal et normal (Korkola et coll., 2003 ; Zhao et coll., 2004
; Zhao et coll., 2004 ). La possibilité d’intégrer ainsi progressivement la classification histoclinique et la classification moléculaire (Charafe-Jauffret et coll., 2005
). La possibilité d’intégrer ainsi progressivement la classification histoclinique et la classification moléculaire (Charafe-Jauffret et coll., 2005 ) devrait permettre une meilleure approche des traitements.
) devrait permettre une meilleure approche des traitements.Gènes altérés dans les cancers du sein
L’identification de nouveaux gènes cibles altérés est nécessaire pour améliorer et diversifier les traitements. Les gènes dont l’implication dans l’oncogenèse mammaire est prouvée sont encore peu nombreux, mais leur effectif pourrait croître rapidement. Certains de ces gènes sont activés par amplification de leur région chromosomique, comme CCND1 (11q13) et ERBB2 (17q12). D’autres gènes sont altérés par délétion, mutation ou perte d’expression, comme CDH1 (cadhérine E) dans les cancers lobulaires, P53, et BRCA1 et BRCA2 dans les cancers héréditaires. L’unité catalytique p110 de la phosphatidyl-inositol-3 kinase est fréquemment mutée dans les cancers lobulaires (Buttitta et coll., 2006 ).
).
 ).
).De nombreuses amplifications et délétions récurrentes ciblant des régions chromosomiques précises ont été identifiées par hybridation génomique comparative. Cette approche, réalisée sur des cibles chromosomiques dans sa forme classique, et plus récemment sur puces à ADN3
(CGH-array pour comparative genomic hybridization4
), montre deux types d’altérations. Le premier type est représenté par des gains ou pertes de grandes portions de matériel génétique. L’étendue de ces altérations qui peuvent impliquer un bras entier de chromosome rend difficile l’identification des éléments importants pour l’oncogenèse. Le deuxième type est fait d’altérations plus régionales voire très localisées. Les gènes concernés sont plus faciles à identifier mais des études de validation sont généralement nécessaires. Dans le cas de l’amplification 8p12 par exemple, le rôle de FGFR1, qui code pour un récepteur aux facteurs de croissance des fibroblastes, n’est toujours pas bien établi (Gelsi-Boyer et coll., 2005 ; Chin et coll., 2006
; Chin et coll., 2006 ; Ray et coll., 2004
; Ray et coll., 2004 ; Reis-Filho et coll., 2006
; Reis-Filho et coll., 2006 ). Certaines amplifications ont été associées à des impacts cliniques variables (Letessier et coll., 2006
). Certaines amplifications ont été associées à des impacts cliniques variables (Letessier et coll., 2006 ). Depuis peu, la très haute densité de puces à ADN commerciales pangénome (ex : Agilent 244A®, Affymetrix GeneChip human mapping 500K set®; Illumina®, Nimblegen 385K®) permet, par CGH-array, une détection des déséquilibres génomiques importants (Coe et coll., 2007
). Depuis peu, la très haute densité de puces à ADN commerciales pangénome (ex : Agilent 244A®, Affymetrix GeneChip human mapping 500K set®; Illumina®, Nimblegen 385K®) permet, par CGH-array, une détection des déséquilibres génomiques importants (Coe et coll., 2007 ). Combinée à l’étude d’expression, voire à d’autres analyses telles que le FISH (Fluorescence in Situ Hybridization) et la Q-PCR (quantitative Polymerase Chain Reaction), l’approche CGH-array à haute résolution se révèle très puissante. Ceci devrait permettre d’identifier des régions et des gènes altérés ayant échappé jusque-là aux analyses plus grossières et de comparer plus finement les génomes des sous-types moléculaires de cancer du sein (pour revue, Edgren et Kallioniemi, 2006
). Combinée à l’étude d’expression, voire à d’autres analyses telles que le FISH (Fluorescence in Situ Hybridization) et la Q-PCR (quantitative Polymerase Chain Reaction), l’approche CGH-array à haute résolution se révèle très puissante. Ceci devrait permettre d’identifier des régions et des gènes altérés ayant échappé jusque-là aux analyses plus grossières et de comparer plus finement les génomes des sous-types moléculaires de cancer du sein (pour revue, Edgren et Kallioniemi, 2006 ; Sorlie, 2007
; Sorlie, 2007 ).
).
 ; Chin et coll., 2006
; Chin et coll., 2006 ; Ray et coll., 2004
; Ray et coll., 2004 ; Reis-Filho et coll., 2006
; Reis-Filho et coll., 2006 ). Certaines amplifications ont été associées à des impacts cliniques variables (Letessier et coll., 2006
). Certaines amplifications ont été associées à des impacts cliniques variables (Letessier et coll., 2006 ). Depuis peu, la très haute densité de puces à ADN commerciales pangénome (ex : Agilent 244A®, Affymetrix GeneChip human mapping 500K set®; Illumina®, Nimblegen 385K®) permet, par CGH-array, une détection des déséquilibres génomiques importants (Coe et coll., 2007
). Depuis peu, la très haute densité de puces à ADN commerciales pangénome (ex : Agilent 244A®, Affymetrix GeneChip human mapping 500K set®; Illumina®, Nimblegen 385K®) permet, par CGH-array, une détection des déséquilibres génomiques importants (Coe et coll., 2007 ). Combinée à l’étude d’expression, voire à d’autres analyses telles que le FISH (Fluorescence in Situ Hybridization) et la Q-PCR (quantitative Polymerase Chain Reaction), l’approche CGH-array à haute résolution se révèle très puissante. Ceci devrait permettre d’identifier des régions et des gènes altérés ayant échappé jusque-là aux analyses plus grossières et de comparer plus finement les génomes des sous-types moléculaires de cancer du sein (pour revue, Edgren et Kallioniemi, 2006
). Combinée à l’étude d’expression, voire à d’autres analyses telles que le FISH (Fluorescence in Situ Hybridization) et la Q-PCR (quantitative Polymerase Chain Reaction), l’approche CGH-array à haute résolution se révèle très puissante. Ceci devrait permettre d’identifier des régions et des gènes altérés ayant échappé jusque-là aux analyses plus grossières et de comparer plus finement les génomes des sous-types moléculaires de cancer du sein (pour revue, Edgren et Kallioniemi, 2006 ; Sorlie, 2007
; Sorlie, 2007 ).
).Dans le même temps, des études de séquençage massif des cancers (Benvenuti et coll., 2005 ; Sjoblom et coll., 2006
; Sjoblom et coll., 2006 ; Chanock et coll., 2007
; Chanock et coll., 2007 ) ont été entreprises. Les premiers résultats font état de mutations dans de nombreux gènes (Benvenuti et coll., 2005
) ont été entreprises. Les premiers résultats font état de mutations dans de nombreux gènes (Benvenuti et coll., 2005 ; Sjoblom et coll., 2006
; Sjoblom et coll., 2006 ; Chanock et coll., 2007
; Chanock et coll., 2007 ).
).
 ; Sjoblom et coll., 2006
; Sjoblom et coll., 2006 ; Chanock et coll., 2007
; Chanock et coll., 2007 ) ont été entreprises. Les premiers résultats font état de mutations dans de nombreux gènes (Benvenuti et coll., 2005
) ont été entreprises. Les premiers résultats font état de mutations dans de nombreux gènes (Benvenuti et coll., 2005 ; Sjoblom et coll., 2006
; Sjoblom et coll., 2006 ; Chanock et coll., 2007
; Chanock et coll., 2007 ).
).Grâce à l’ensemble de ces approches, un répertoire des altérations présentes dans les cancers du sein sera bientôt disponible. Chacune de ces altérations devra faire l’objet d’une validation fonctionnelle prouvant son implication dans l’oncogenèse mammaire. Ceci pourra se faire par différentes méthodes, par exemple modulation de l’expression (surexpression, inhibition d’expression par « siRNA »5
) et utilisation de modèles animaux. Un exemple de ce type de démarche est décrit dans une étude récente sur le gène CRYAB, surexprimé dans les cancers du sein de sous-type basal (Moyano et coll., 2006 ). Une liste de cibles validées sera alors disponible pour développer de nouveaux traitements.
). Une liste de cibles validées sera alors disponible pour développer de nouveaux traitements.
 ). Une liste de cibles validées sera alors disponible pour développer de nouveaux traitements.
). Une liste de cibles validées sera alors disponible pour développer de nouveaux traitements.Cellules à l’origine des cancers du sein
L’efficacité d’un traitement sera maximale s’il touche la bonne cellule. Un nombre croissant d’arguments permettent de penser que le cancer du sein se développe à partir des cellules souches mammaires (ou de leur descendants immédiats, les progéniteurs précoces) après une série d’altérations génétiques. Ces cellules, définies ainsi comme cellules souches cancéreuses (CSC) et dotées de la capacité à s’auto-renouveler, seraient les seules à alimenter la prolifération et la croissance de la tumeur. Elles seraient également à l’origine des métastases. Un traitement ne pourrait donc être réellement efficace que s’il cible et détruit ces CSC. Le problème majeur est de les isoler et de les caractériser. Plusieurs techniques ont été décrites afin d’isoler des cellules souches de la glande mammaire normale ou cancéreuse. Certaines sont fondées sur les propriétés intrinsèques de ces cellules à exclure les colorants vitaux (technique de « side population » Kondo et coll., 2004 ; Moyano et coll., 2006
; Moyano et coll., 2006 ), d’autres s’appuient sur leur capacité à survivre et à proliférer dans un milieu sans sérum et en condition non adhérentes (formation de mammosphères ou de « tumorosphères » Dontu et coll., 2003
), d’autres s’appuient sur leur capacité à survivre et à proliférer dans un milieu sans sérum et en condition non adhérentes (formation de mammosphères ou de « tumorosphères » Dontu et coll., 2003 ; Ponti et coll., 2005
; Ponti et coll., 2005 ), d’autres encore ont proposé des marqueurs utilisables pour trier les cellules en cytométrie de flux. Dans cette dernière catégorie, un phénotype particulier, CD44+/CD24- /lin-, a été associé aux CSC humaines (Al Hajj et coll., 2003
), d’autres encore ont proposé des marqueurs utilisables pour trier les cellules en cytométrie de flux. Dans cette dernière catégorie, un phénotype particulier, CD44+/CD24- /lin-, a été associé aux CSC humaines (Al Hajj et coll., 2003 ). Ces cellules ont été étudiées par puces à ADN et une signature d’expression génique a été établie ; elle est associée à une valeur pronostique (Al Hajj et coll., 2003
). Ces cellules ont été étudiées par puces à ADN et une signature d’expression génique a été établie ; elle est associée à une valeur pronostique (Al Hajj et coll., 2003 ; Liu et coll., 2007
; Liu et coll., 2007 ). Il a été démontré récemment (Bertucci et coll., 2006
). Il a été démontré récemment (Bertucci et coll., 2006 ) que cette signature permettait de différencier les cancers du sein de sous-type luminal versus basal, avec une surexpression dans le sous-type basal des gènes surexprimés dans les CSC. CD133 serait également un bon marqueur des cellules souches mammaires.
) que cette signature permettait de différencier les cancers du sein de sous-type luminal versus basal, avec une surexpression dans le sous-type basal des gènes surexprimés dans les CSC. CD133 serait également un bon marqueur des cellules souches mammaires.
 ; Moyano et coll., 2006
; Moyano et coll., 2006 ), d’autres s’appuient sur leur capacité à survivre et à proliférer dans un milieu sans sérum et en condition non adhérentes (formation de mammosphères ou de « tumorosphères » Dontu et coll., 2003
), d’autres s’appuient sur leur capacité à survivre et à proliférer dans un milieu sans sérum et en condition non adhérentes (formation de mammosphères ou de « tumorosphères » Dontu et coll., 2003 ; Ponti et coll., 2005
; Ponti et coll., 2005 ), d’autres encore ont proposé des marqueurs utilisables pour trier les cellules en cytométrie de flux. Dans cette dernière catégorie, un phénotype particulier, CD44+/CD24- /lin-, a été associé aux CSC humaines (Al Hajj et coll., 2003
), d’autres encore ont proposé des marqueurs utilisables pour trier les cellules en cytométrie de flux. Dans cette dernière catégorie, un phénotype particulier, CD44+/CD24- /lin-, a été associé aux CSC humaines (Al Hajj et coll., 2003 ). Ces cellules ont été étudiées par puces à ADN et une signature d’expression génique a été établie ; elle est associée à une valeur pronostique (Al Hajj et coll., 2003
). Ces cellules ont été étudiées par puces à ADN et une signature d’expression génique a été établie ; elle est associée à une valeur pronostique (Al Hajj et coll., 2003 ; Liu et coll., 2007
; Liu et coll., 2007 ). Il a été démontré récemment (Bertucci et coll., 2006
). Il a été démontré récemment (Bertucci et coll., 2006 ) que cette signature permettait de différencier les cancers du sein de sous-type luminal versus basal, avec une surexpression dans le sous-type basal des gènes surexprimés dans les CSC. CD133 serait également un bon marqueur des cellules souches mammaires.
) que cette signature permettait de différencier les cancers du sein de sous-type luminal versus basal, avec une surexpression dans le sous-type basal des gènes surexprimés dans les CSC. CD133 serait également un bon marqueur des cellules souches mammaires.À côté de ces marqueurs de surface, un nouveau marqueur témoignant de la fonction d’une enzyme impliquée dans la différenciation, apparaît très prometteur (Ginestier et coll., 2007 ). Il s’agit de l’activité enzymatique de l’aldéhyde déshydrogénase (ALDH), qui intervient dans le métabolisme oxydatif de l’acide rétinoïque et qui est mesurable par fluorescence grâce à un kit commercial approprié, Aldefluor (StemCell technologies, Durham, NC, États-Unis). Les cellules Aldefluor-positives issues de mammoplastie de réduction sont capables de reconstituer les différents lignages cellulaires de l’épithélium mammaire normal in vitro et in vivo. Des cellules Aldefluor-positives issues de tumeur sont jusqu’à 1 000 fois plus tumorigènes que les cellules Aldefluor-négatives, et peuvent reconstituer l’hétérogénéité de la tumeur initiale. Ces marqueurs permettront d’isoler les CSC et de les étudier. Sur ces populations enrichies et leurs dérivés xénotransplantés il sera possible de pratiquer nombre d’études in vitro et in vivo (expression génique, protéomique, tests de tumorigénicité, de sensibilité aux drogues, obtention de lignées, étude du rôle des micros ARN…) qui augmenteront notre compréhension de la maladie.
). Il s’agit de l’activité enzymatique de l’aldéhyde déshydrogénase (ALDH), qui intervient dans le métabolisme oxydatif de l’acide rétinoïque et qui est mesurable par fluorescence grâce à un kit commercial approprié, Aldefluor (StemCell technologies, Durham, NC, États-Unis). Les cellules Aldefluor-positives issues de mammoplastie de réduction sont capables de reconstituer les différents lignages cellulaires de l’épithélium mammaire normal in vitro et in vivo. Des cellules Aldefluor-positives issues de tumeur sont jusqu’à 1 000 fois plus tumorigènes que les cellules Aldefluor-négatives, et peuvent reconstituer l’hétérogénéité de la tumeur initiale. Ces marqueurs permettront d’isoler les CSC et de les étudier. Sur ces populations enrichies et leurs dérivés xénotransplantés il sera possible de pratiquer nombre d’études in vitro et in vivo (expression génique, protéomique, tests de tumorigénicité, de sensibilité aux drogues, obtention de lignées, étude du rôle des micros ARN…) qui augmenteront notre compréhension de la maladie.
 ). Il s’agit de l’activité enzymatique de l’aldéhyde déshydrogénase (ALDH), qui intervient dans le métabolisme oxydatif de l’acide rétinoïque et qui est mesurable par fluorescence grâce à un kit commercial approprié, Aldefluor (StemCell technologies, Durham, NC, États-Unis). Les cellules Aldefluor-positives issues de mammoplastie de réduction sont capables de reconstituer les différents lignages cellulaires de l’épithélium mammaire normal in vitro et in vivo. Des cellules Aldefluor-positives issues de tumeur sont jusqu’à 1 000 fois plus tumorigènes que les cellules Aldefluor-négatives, et peuvent reconstituer l’hétérogénéité de la tumeur initiale. Ces marqueurs permettront d’isoler les CSC et de les étudier. Sur ces populations enrichies et leurs dérivés xénotransplantés il sera possible de pratiquer nombre d’études in vitro et in vivo (expression génique, protéomique, tests de tumorigénicité, de sensibilité aux drogues, obtention de lignées, étude du rôle des micros ARN…) qui augmenteront notre compréhension de la maladie.
). Il s’agit de l’activité enzymatique de l’aldéhyde déshydrogénase (ALDH), qui intervient dans le métabolisme oxydatif de l’acide rétinoïque et qui est mesurable par fluorescence grâce à un kit commercial approprié, Aldefluor (StemCell technologies, Durham, NC, États-Unis). Les cellules Aldefluor-positives issues de mammoplastie de réduction sont capables de reconstituer les différents lignages cellulaires de l’épithélium mammaire normal in vitro et in vivo. Des cellules Aldefluor-positives issues de tumeur sont jusqu’à 1 000 fois plus tumorigènes que les cellules Aldefluor-négatives, et peuvent reconstituer l’hétérogénéité de la tumeur initiale. Ces marqueurs permettront d’isoler les CSC et de les étudier. Sur ces populations enrichies et leurs dérivés xénotransplantés il sera possible de pratiquer nombre d’études in vitro et in vivo (expression génique, protéomique, tests de tumorigénicité, de sensibilité aux drogues, obtention de lignées, étude du rôle des micros ARN…) qui augmenteront notre compréhension de la maladie.Synthèse très schématique et provisoire
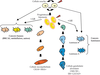
Que peut-on tirer comme enseignement de ces différentes études ? La meilleure caractérisation des cellules souches6
et des deux lignages mammaires ainsi que la définition des sous-types moléculaires dans les cancers du sein permettent de dégager des grandes lignes cohérentes et un schéma provisoire (figure 26.2 ).
).
 ).
).La dichotomie luminale/myoépithéliale cadre bien avec la différence luminal/basal des cancers du sein. Les cancers du sein auraient leur origine au niveau des cellules souches ou progénitrices (figure 26.2 ). Selon le type d’altérations génétiques, et probablement aussi selon l’environnement dans lequel elles évoluent, les cellules issues des CSC progresseraient de façon plus ou moins importante vers un stade différencié. Les cancers de sous-type luminal proviendraient de CSC donnant une descendance capable de se différencier en cellules luminales de façon plus ou moins complète (luminaux A et luminaux B, respectivement). Les cancers de sous-type basal auraient au contraire pour origine des cellules donnant une descendance capable de s’engager dans la différenciation myoépithéliale ou dans les deux lignages. Certains cancers du sein seraient ainsi constitués de cellules relativement bien différenciées (cancers luminaux A) et d’autres de cellules plus immatures (blocage précoce de la différenciation) au pronostic plus sévère. Ces derniers seraient plus graves que les premiers. La différenciation des cellules tumorales ne va cependant pas jusqu’aux cellules à différenciation terminale, comme les cellules glandulaires produisant du lait ou les cellules myoépithéliales les plus matures. Des exceptions possibles sont les rarissimes cancers sécrétoires, caractérisés sur le plan moléculaire par le gène de fusion ETV6-NTRK3 (Tognon et coll., 2002
). Selon le type d’altérations génétiques, et probablement aussi selon l’environnement dans lequel elles évoluent, les cellules issues des CSC progresseraient de façon plus ou moins importante vers un stade différencié. Les cancers de sous-type luminal proviendraient de CSC donnant une descendance capable de se différencier en cellules luminales de façon plus ou moins complète (luminaux A et luminaux B, respectivement). Les cancers de sous-type basal auraient au contraire pour origine des cellules donnant une descendance capable de s’engager dans la différenciation myoépithéliale ou dans les deux lignages. Certains cancers du sein seraient ainsi constitués de cellules relativement bien différenciées (cancers luminaux A) et d’autres de cellules plus immatures (blocage précoce de la différenciation) au pronostic plus sévère. Ces derniers seraient plus graves que les premiers. La différenciation des cellules tumorales ne va cependant pas jusqu’aux cellules à différenciation terminale, comme les cellules glandulaires produisant du lait ou les cellules myoépithéliales les plus matures. Des exceptions possibles sont les rarissimes cancers sécrétoires, caractérisés sur le plan moléculaire par le gène de fusion ETV6-NTRK3 (Tognon et coll., 2002 ), et par les non moins rarissimes myoépithéliomes7
. Les cancers ERBB2 pourraient dériver de CSC ayant la capacité de s’orienter soit vers un lignage, soit vers l’autre, soit vers les deux. Le sous-type ERBB2 ne correspondrait pas à un lignage mais à une anomalie génétique capable de conférer à la tumeur des propriétés d’agressivité et un transcriptome particulier.
), et par les non moins rarissimes myoépithéliomes7
. Les cancers ERBB2 pourraient dériver de CSC ayant la capacité de s’orienter soit vers un lignage, soit vers l’autre, soit vers les deux. Le sous-type ERBB2 ne correspondrait pas à un lignage mais à une anomalie génétique capable de conférer à la tumeur des propriétés d’agressivité et un transcriptome particulier.
 ). Selon le type d’altérations génétiques, et probablement aussi selon l’environnement dans lequel elles évoluent, les cellules issues des CSC progresseraient de façon plus ou moins importante vers un stade différencié. Les cancers de sous-type luminal proviendraient de CSC donnant une descendance capable de se différencier en cellules luminales de façon plus ou moins complète (luminaux A et luminaux B, respectivement). Les cancers de sous-type basal auraient au contraire pour origine des cellules donnant une descendance capable de s’engager dans la différenciation myoépithéliale ou dans les deux lignages. Certains cancers du sein seraient ainsi constitués de cellules relativement bien différenciées (cancers luminaux A) et d’autres de cellules plus immatures (blocage précoce de la différenciation) au pronostic plus sévère. Ces derniers seraient plus graves que les premiers. La différenciation des cellules tumorales ne va cependant pas jusqu’aux cellules à différenciation terminale, comme les cellules glandulaires produisant du lait ou les cellules myoépithéliales les plus matures. Des exceptions possibles sont les rarissimes cancers sécrétoires, caractérisés sur le plan moléculaire par le gène de fusion ETV6-NTRK3 (Tognon et coll., 2002
). Selon le type d’altérations génétiques, et probablement aussi selon l’environnement dans lequel elles évoluent, les cellules issues des CSC progresseraient de façon plus ou moins importante vers un stade différencié. Les cancers de sous-type luminal proviendraient de CSC donnant une descendance capable de se différencier en cellules luminales de façon plus ou moins complète (luminaux A et luminaux B, respectivement). Les cancers de sous-type basal auraient au contraire pour origine des cellules donnant une descendance capable de s’engager dans la différenciation myoépithéliale ou dans les deux lignages. Certains cancers du sein seraient ainsi constitués de cellules relativement bien différenciées (cancers luminaux A) et d’autres de cellules plus immatures (blocage précoce de la différenciation) au pronostic plus sévère. Ces derniers seraient plus graves que les premiers. La différenciation des cellules tumorales ne va cependant pas jusqu’aux cellules à différenciation terminale, comme les cellules glandulaires produisant du lait ou les cellules myoépithéliales les plus matures. Des exceptions possibles sont les rarissimes cancers sécrétoires, caractérisés sur le plan moléculaire par le gène de fusion ETV6-NTRK3 (Tognon et coll., 2002 ), et par les non moins rarissimes myoépithéliomes7
. Les cancers ERBB2 pourraient dériver de CSC ayant la capacité de s’orienter soit vers un lignage, soit vers l’autre, soit vers les deux. Le sous-type ERBB2 ne correspondrait pas à un lignage mais à une anomalie génétique capable de conférer à la tumeur des propriétés d’agressivité et un transcriptome particulier.
), et par les non moins rarissimes myoépithéliomes7
. Les cancers ERBB2 pourraient dériver de CSC ayant la capacité de s’orienter soit vers un lignage, soit vers l’autre, soit vers les deux. Le sous-type ERBB2 ne correspondrait pas à un lignage mais à une anomalie génétique capable de conférer à la tumeur des propriétés d’agressivité et un transcriptome particulier.Comme pour les leucémies le point de départ cellulaire du cancer du sein pourrait être double (Wicha et coll., 2006 ). Le cancer peut trouver son origine dans la cellule souche elle-même. Celle-ci étant dotée de capacité d’auto-renouvellement et d’une longue durée de vie, les altérations génétiques sont principalement à l’origine de la prolifération continue. Le cancer pourrait également débuter dans les progéniteurs prolifératifs précoces. Les cancers basaux, très prolifératifs, pourraient dériver de tels progéniteurs. Les altérations génétiques modifient alors le programme moléculaire de façon à ce que la cellule acquière un auto-renouvellement et une survie prolongée. Les cancers issus de ces deux origines pourraient avoir des propriétés différentes.
). Le cancer peut trouver son origine dans la cellule souche elle-même. Celle-ci étant dotée de capacité d’auto-renouvellement et d’une longue durée de vie, les altérations génétiques sont principalement à l’origine de la prolifération continue. Le cancer pourrait également débuter dans les progéniteurs prolifératifs précoces. Les cancers basaux, très prolifératifs, pourraient dériver de tels progéniteurs. Les altérations génétiques modifient alors le programme moléculaire de façon à ce que la cellule acquière un auto-renouvellement et une survie prolongée. Les cancers issus de ces deux origines pourraient avoir des propriétés différentes.
 ). Le cancer peut trouver son origine dans la cellule souche elle-même. Celle-ci étant dotée de capacité d’auto-renouvellement et d’une longue durée de vie, les altérations génétiques sont principalement à l’origine de la prolifération continue. Le cancer pourrait également débuter dans les progéniteurs prolifératifs précoces. Les cancers basaux, très prolifératifs, pourraient dériver de tels progéniteurs. Les altérations génétiques modifient alors le programme moléculaire de façon à ce que la cellule acquière un auto-renouvellement et une survie prolongée. Les cancers issus de ces deux origines pourraient avoir des propriétés différentes.
). Le cancer peut trouver son origine dans la cellule souche elle-même. Celle-ci étant dotée de capacité d’auto-renouvellement et d’une longue durée de vie, les altérations génétiques sont principalement à l’origine de la prolifération continue. Le cancer pourrait également débuter dans les progéniteurs prolifératifs précoces. Les cancers basaux, très prolifératifs, pourraient dériver de tels progéniteurs. Les altérations génétiques modifient alors le programme moléculaire de façon à ce que la cellule acquière un auto-renouvellement et une survie prolongée. Les cancers issus de ces deux origines pourraient avoir des propriétés différentes.Il est possible de placer sur ce schéma des listes de gènes exprimés de manière spécifique de lignage, et bientôt des gènes spécifiques des cellules souches mammaires. Les avancées moléculaires et cellulaires, conjointes et cohérentes, font progresser notre connaissance de l’oncogenèse mammaire. Et cela devrait encore s’accélérer. L’application de méthodes de criblage type « Chip on chip 8
» permettra d’établir des réseaux de régulation de la différenciation et de définir une hiérarchie dans leurs interactions (Carroll et coll., 2006 ; Kouros-Mehr et coll., 2006
; Kouros-Mehr et coll., 2006 ). Les études génomiques permettront de définir des altérations spécifiques de chaque sous-type de cancer (Bergamaschi et coll., 2006
). Les études génomiques permettront de définir des altérations spécifiques de chaque sous-type de cancer (Bergamaschi et coll., 2006 ), comme par exemple l’amplification de la région 12p13 dans les cancers du sein basaux (Letessier et coll., 2006
), comme par exemple l’amplification de la région 12p13 dans les cancers du sein basaux (Letessier et coll., 2006 ; Yao et coll., 2006
; Yao et coll., 2006 ). De ces études dériveront marqueurs et cibles permettant le développement de l’arsenal thérapeutique et son application précise à chaque cas de cancer. La caractérisation des CSC permettra de les cibler par ces traitements adaptés.
). De ces études dériveront marqueurs et cibles permettant le développement de l’arsenal thérapeutique et son application précise à chaque cas de cancer. La caractérisation des CSC permettra de les cibler par ces traitements adaptés.
 ; Kouros-Mehr et coll., 2006
; Kouros-Mehr et coll., 2006 ). Les études génomiques permettront de définir des altérations spécifiques de chaque sous-type de cancer (Bergamaschi et coll., 2006
). Les études génomiques permettront de définir des altérations spécifiques de chaque sous-type de cancer (Bergamaschi et coll., 2006 ), comme par exemple l’amplification de la région 12p13 dans les cancers du sein basaux (Letessier et coll., 2006
), comme par exemple l’amplification de la région 12p13 dans les cancers du sein basaux (Letessier et coll., 2006 ; Yao et coll., 2006
; Yao et coll., 2006 ). De ces études dériveront marqueurs et cibles permettant le développement de l’arsenal thérapeutique et son application précise à chaque cas de cancer. La caractérisation des CSC permettra de les cibler par ces traitements adaptés.
). De ces études dériveront marqueurs et cibles permettant le développement de l’arsenal thérapeutique et son application précise à chaque cas de cancer. La caractérisation des CSC permettra de les cibler par ces traitements adaptés.En conclusion, on regroupe sans doute sous le terme de sous-type moléculaire plusieurs catégories de différences, associées aux lignages épithéliaux, aux stades de différenciation cellulaires et aux influences des anomalies génétiques. Une meilleure définition des sous-types moléculaires est donc nécessaire mais un modèle est né. Bien entendu, comme tous les modèles, celui-ci est destiné à être amélioré, modifié, contesté, remplacé, jusqu’à ce qu’un modèle consensuel, plus juste, plus complet et plus précis, soit utilisé en recherche comme en clinique. L’intérêt de ce premier modèle est néanmoins de montrer un début de cohérence et de convergence issu d’études diverses, moléculaires et cellulaires, et de poser les bases de réflexion pour les études et les prises en charge futures de la maladie.
Bibliographie
[1] abd el-rehim dm, ball g, pinder se, rakha e, paish c, et coll.. High-throughput protein expression analysis using tissue microarray technology of a large well-characterised series identifies biologically distinct classes of breast cancer confirming recent cDNA expression analyses.
Int J Cancer. 2005;
116:340350

[2] al hajj m, wicha ms, benito-hernandez a, morrison sj, clarke mf. Prospective identification of tumorigenic breast cancer cells.
Proc Natl Acad Sci USA. 2003;
100:39833988

[3] asselin-labat ml, shackleton m, stingl j, vaillant f, forrest nc, et coll.. Steroid hormone receptor status of mouse mammary stem cells.
J Natl Cancer Inst. 2006;
98:10111014

[4] asselin-labat ml, sutherland kd, barker h, thomas r, shackleton m, et coll.. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation.
Nat Cell Biol. 2007;
9:201209

[5] benvenuti s, arena s, bardelli a. Identification of cancer genes by mutational profiling of tumor genomes.
FEBS Lett. 2005;
579:18841890

[6] bergamaschi a, kim yh, wang p, sørlie t, hernandez-boussard t, et coll.. Distinct patterns of DNA copy number alteration are associated with different clinicopathological features and gene-expression subtypes of breast cancer.
Genes Chromosomes Cancer. 2006;
45:10331040

[7] bertucci f, borie n, ginestier c, groulet a, charafe-jauffret e, et coll.. Identification and validation of an ERBB2 gene expression signature in breast cancers.
Oncogene. 2004;
23:25642575

[8] bertucci f, finetti p, cervera n, charafe-jauffret e, mamessier e, et coll.. Gene expression profiling shows medullary breast cancer is a subgroup of basal breast cancers.
Cancer Res. 2006;
66:46364644

[9] bertucci f, finetti p, rougemont j, charafe-jauffret e, cervera n, et coll.. Gene expression profiling identifies molecular subtypes of inflammatory breast cancer.
Cancer Res. 2005;
65:21702178

[10] bertucci f, houlgatte r, benziane a, granjeaud s, adélaïde j, et coll.. Gene expression profiling of primary breast carcinomas using arrays of candidate genes.
Hum Mol Genet. 2000;
9:29812991

[11] birnbaum d, bertucci f, ginestier c, tagett r, jacquemier j, charafe-jauffret e. Basal and luminal breast cancers: basic or luminous?.
Int J Oncol. 2004;
25:249258

[12] buttitta f, felicioni l, barassi f, martella c, paolizzi d, et coll.. PIK3CA mutation and histological type in breast carcinoma: high frequency of mutations in lobular carcinoma.
J Pathol. 2006;
208:350355

[13] carroll js, brown m. Estrogen receptor target gene: an evolving concept.
Mol Endocrinol. 2006;
20:17071714

[14] chanock sj, burdett l, yeager m, llaca v, langerød a, et coll.. Somatic sequence alterations in twenty-one genes selected by expression profile analysis of breast carcinomas.
Breast Cancer Res. 2007;
9:R5

[15] charafe-jauffret e, ginestier c, monville f, fekairi s, jacquemier j, et coll.. How to best classify breast cancer: conventional and novel classifications.
Int J Oncol. 2005;
27:13071313

[16] charafe-jauffret e, ginestier c, monville f, finetti p, adélaïde j, et coll.. Gene expression profiling of breast cell lines identifies potential new basal markers.
Oncogene. 2006;
25:22732284

[17] chin k, devries s, fridlyand j, spellman pt, roydasgupta r, et coll.. Genomic and transcriptional aberrations linked to breast cancer pathophysiologies.
Cancer Cell. 2006;
10:529541

[18] coe bp, ylstra b, carvalho b, meijer ga, macaulay c, lam wl. Resolving the resolution of array CGH.
Genomics. 2007;
89:647653

[19] dolled-filhart m, ryden l, cregger m, et coll.. Classification of breast cancer using genetic algorithms and tissue microarrays.
Clin Cancer Res. 2006;
12:64596468

[20] dontu g, abdallah wm, foley jm, jirström k, harigopal m, et coll.. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells.
Genes Dev. 2003;
17:12531270

[22] gelsi-boyer v, orsetti b, cervera n, finetti p, sircoulomb f, et coll.. Comprehensive profiling of 8p11-12 amplification in breast cancer.
Mol Cancer Res. 2005;
3:655667

[23] ginestier c, hur mh, charafe-jauffret e, monville f, dutcher j, et coll.. ALDH1 Is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome.
Cell Stem Cell. 2007;
1:555567

[24] jacquemier j, ginestier c, rougemont j, bardou vj, charafe-jauffret e, et coll.. Protein expression profiling identifies subclasses of breast cancer and predicts prognosis.
Cancer Res. 2005;
65:767779

[25] jenssen tk, kuo wp, stokke t, hovig e. Associations between gene expressions in breast cancer and patient survival.
Hum Genet. 2002;
111:411420

[26] kondo t, setoguchi t, taga t. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line.
Proc Natl Acad Sci USA. 2004;
101:781786

[27] konecny ge, pegram md, venkatesan n, finn r, yang g, et coll.. Activity of the dual kinase inhibitor lapatinib (GW572016) against HER-2-overexpressing and trastuzumab-treated breast cancer cells.
Cancer Res. 2006;
66:16301639

[28] korkola je, devries s, fridlyand j, hwang es, estep al, et coll.. Differentiation of lobular versus ductal breast carcinomas by expression microarray analysis.
Cancer Res. 2003;
63:71677175

[29] kouros-mehr h, slorach em, sternlicht md, werb z. GATA-3 maintains the differentiation of the luminal cell fate in the mammary gland.
Cell. 2006;
127:10411055

[30] letessier a, sircoulomb f, ginestier c, cervera n, monville f, et coll.. Frequency, prognostic impact, and subtype association of 8p12, 8q24, 11q13, 12p13, 17q12, and 20q13 amplifications in breast cancers.
BMC Cancer. 2006;
6:245

[31] liu r, wang x, chen gy, dalerba p, gurney a, et coll.. The prognostic role of a gene signature from tumorigenic breast-cancer cells.
N Engl J Med. 2007;
356:217226

[32] moyano jv, evans jr, chen f, lu m, werner me, et coll.. AlphaB-crystallin is a novel oncoprotein that predicts poor clinical outcome in breast cancer.
J Clin Invest. 2006;
116:26170

[33] neve rm, chin k, fridlyand j, yeh j, baehner fl, et coll.. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes.
Cancer Cell. 2006;
10:515527

[34] nielsen to, hsu fd, jensen k, cheang m, karaca g, et coll.. Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma.
Clin Cancer Res. 2004;
10:53675374

[35] ponti d, costa a, zaffaroni n, pratesi g, petrangolini g, et coll.. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties.
Cancer Res. 2005;
65:55065511

[36] ray me, yang zq, albertson d, kleer cg, washburn jg, et coll.. Genomic and expression analysis of the 8p11-12 amplicon in human breast cancer cell lines.
Cancer Res. 2004;
64:4047

[37] reis-filho js, simpson pt, turner nc, lambros mb, jones c, et coll.. FGFR1 emerges as a potential therapeutic target for lobular breast carcinomas.
Clin Cancer Res. 2006;
12:66526662

[38] ridolfi rl, rosen pp, port a, kinne d, mike v. Medullary carcinoma of the breast: a clinicopathologic study with 10 year follow-up.
Cancer. 1977;
40:13651385

[39] sjoblom t, jones s, wood ld, parsons dw, lin j, et coll.. The consensus coding sequences of human breast and colorectal cancers.
Science. 2006;
314:268274

[40] sorlie t, tibshirani r, parker j, hastie t, marron js, et coll.. Repeated observation of breast tumor subtypes in independent gene expression data sets.
Proc Natl Acad Sci USA. 2003;
100:84188423

[41] sorlie t. Molecular classification of breast tumors: toward improved diagnostics and treatments.
Methods Mol Biol. 2007;
360:91114

[42] tavassoli fa. Breast pathology: rationale for adopting the ductal intraepithelial neoplasia (DIN) classification.
Nat Clin Pract Oncol. 2005;
2:116117

[43] tognon c, knezevich sr, huntsman d, roskelley cd, melnyk n, et coll.. Expression of the ETV6-NTRK3 gene fusion as a primary event in human secretory breast carcinoma.
Cancer Cell. 2002;
2:367376

[44] turner nc, reis-filho js. Basal-like breast cancer and the BRCA1 phenotype.
Oncogene. 2006;
25:58465853

[45] van laere sj, van den eynden gg, van der auwera i, vandenberghe m, van dam p, et coll.. Identification of cell-of-origin breast tumor subtypes in inflammatory breast cancer by gene expression profiling.
Breast Cancer Res Treat. 2006;
95:243255

[46] wicha ms, liu s, dontu g. Cancer stem cells: an old idea-a paradigm shift.
Cancer Res. 2006;
66:18831890

[47] yao j, weremowicz s, feng b, gentleman rc, marks jr, et coll.. Combined cDNA array comparative genomic hybridization and serial analysis of gene expression analysis of breast tumor progression.
Cancer Res. 2006;
66:40654078

[48] zhao h, langerod a, ji y, nowels kw, nesland jm, et coll.. Different gene expression patterns in invasive lobular and ductal carcinomas of the breast.
Mol Biol Cell. 2004;
15:25232536

→ Aller vers le SOMMAIRE de l'ouvrage