Cancer de l’ovaire
2008
32-
Classification histologique et pathologie moléculaire
Les tumeurs de l’ovaire se placent au 5
e rang des néoplasies féminines avec un pic de fréquence chez les femmes de 60 à 70 ans. Les tumeurs ovariennes les plus fréquentes sont les tumeurs stromales-épithéliales. Elles proviennent de l’épithélium de surface de l’ovaire ou de ses dérivés. Elles surviennent essentiellement chez des femmes en période d’activité génitale ou plus tardivement. Histologiquement, elles sont composées d’un ou plusieurs types épithéliaux, mélangés avec une proportion variable de stroma. Le pronostic dépend du type histologique mais dans l’ensemble il est mauvais. Ce mauvais pronostic est largement lié à une découverte à un stade tardif de la maladie, du fait du caractère peu symptomatique des stades débutants. Les cancers de l’ovaire représentent environ 30 % des cancers du tractus génital féminin (Seidman et Kurman, 2003

). Dans les pays occidentalisés, ils sont presque aussi fréquents que les cancers du corps ou du col de l’utérus. Deux facteurs sont associés avec un risque diminué de développer la maladie : une grande parité et l’utilisation de contraceptifs oraux, ce qui suggère un rapport direct avec l’ovulation dans l’étiologie de la maladie. Le rythme de vie, l’obésité en particulier, est associé à un risqué élevé de développer un cancer de l’ovaire dans les pays industrialisés. Le rôle du traitement hormonal substitutif est également discuté.
Généralités et pronostic
Le cancer de l’ovaire est une tumeur maligne qui atteint un ou les deux ovaires (Shibata et coll., 2003

). Lorsqu’on évoque les cancers de l’ovaire, on exclut les cancers métastatiques (cancers secondaires) qui se sont formés à partir de cellules cancéreuses provenant d’un autre organe (estomac, poumon, foie...) et qui ont migré vers les ovaires. Cette occurrence n’est pas exceptionnelle. Le cancer de l’ovaire est essentiellement un adénocarcinome, c’est-à-dire une tumeur maligne qui s’organise en formant des structures glandulaires dans cet organe.
Étant donné la situation intra-péritonéale des ovaires et une origine commune avec la séreuse péritonéale, les cellules malignes diffusent spontanément dans la cavité abdomino-pelvienne, se greffent sur le péritoine et peuvent aller envahir les différents organes contenus dans cette cavité. Associé à la situation anatomique profonde des ovaires qui rend les tumeurs très peu symptomatiques à des stades précoces, ceci explique la découverte de ces cancers à des stades souvent évolués. Cliniquement, il peut s’agir d’une vague douleur pelvienne, d’une ascite, ou de nodules de carcinose palpables à l’examen clinique. Un retentissement digestif (occlusion, nausée, vomissements, troubles du transit) n’est pas exceptionnel. Il existe de nombreuses formes histologiques de cancers de l’ovaire ; les plus fréquents sont les cancers épithéliaux.
Il existe une forme particulière de tumeur ovarienne, nommée « borderline » (frontière) (Seidman et coll., 2002

; Kurman et coll., 2005

). Elle représente 10 à 15 % des tumeurs ovariennes. C’est une forme intermédiaire entre tumeur bénigne et cancer. Ces tumeurs surviennent à un âge plus précoce que le cancer de l’ovaire. Elles sont beaucoup moins agressives que les précédentes et leur pronostic est bon, quoique incertain d’où leur appellation.
Extension
Environ 70-75 % des patientes atteintes ont une extension au pelvis au moment du diagnostic. Les disséminations se font par extension locale, par dissémination intra-abdominale, ou lymphatique, rarement par voie sanguine. Deux systèmes de stadification de la maladie existent : le système FIGO (Federation of Gynecology and Obstetrics) et le pTNM (Singh et coll., 2008

). Le premier système établit le stade du cancer en fonction de l’envahissement d’un, des 2 ovaires, de la cavité péritonéale, des organes de voisinage, le deuxième est basé sur les données anatomopathologiques, donc post-opératoires.
Rappel histologique
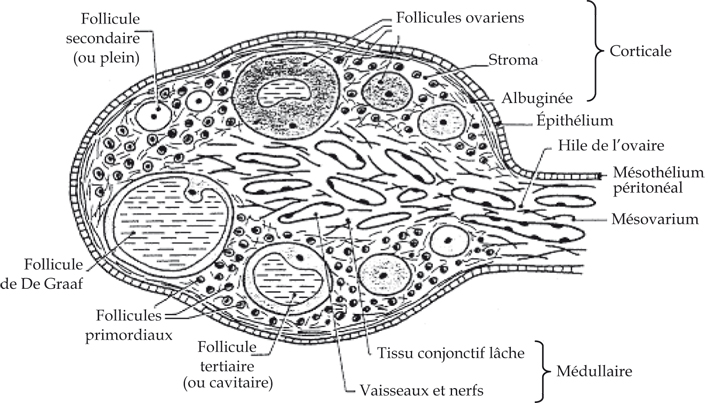
L’ovaire est revêtu par un épithélium pavimenteux ou cubique simple. L’ovaire comprend deux zones : la corticale et la médullaire. La zone corticale, épaisse, est située à la périphérie ; elle comporte des follicules ovariens contenant les ovocytes et le stroma ovarien. La zone médullaire est située au centre de l’ovaire, elle est faite d’un tissu conjonctif lâche. Elle contient des nerfs, des vaisseaux sanguins et lymphatiques (figure 32.1

).
Histogenèse
L’origine la plus probable des tumeurs épithéliales de l’ovaire est la surface mésothéliale qui entoure les ovaires et qui s’invagine dans le cortex ovarien superficiel, formant des kystes d’inclusion.
Susceptibilité génétique
Une histoire familiale est souvent retrouvée, avec un risque plus élevé si les parents au premier degré sont touchés, d’autant plus s’il s’agit d’une mère et d’une sœur. Les gènes de susceptibilité BRCA1 et BRCA2 sont fréquemment impliqués, et à un moindre degré les gènes du système de réparation MLH1 et MSH2 dans le cadre des syndromes HNPCC (Hereditary Non Polyposis Colon Cancer) (Gras et coll., 2001

; Wenham et coll., 2003

; Walsh et King, 2007

).
Classification
La complexité des tumeurs ovariennes tient à la multiplicité des types lésionnels rencontrés, conséquences d’une embryogenèse complexe. La classification histologique de l’OMS est la plus utilisée. Elle distingue plusieurs groupes de tumeurs primitives ovariennes en se basant sur les corrélations morphologiques existant entre l’aspect histologique de la tumeur et l’aspect histologique des constituants de l’ovaire normal. Elle distingue trois grands types histologiques : les tumeurs épithéliales représentent 90 % de l’ensemble des tumeurs de l’ovaire, les tumeurs du mésenchyme et des cordons sexuels 5 à 6 % et les tumeurs des cellules germinales 1 à 5 % (Seidman et Kurman, 2003

; Scully, 1977

). Les tumeurs épithéliales sont composées en majorité de tumeurs séreuses (50 %) puis par ordre de fréquence décroissant de tumeurs mucineuses, endométrioïdes, à cellules claires, les tumeurs de Brenner, les tumeurs mixtes mülleriennes malignes, les carcinomes indifférenciés et les tumeurs mixtes épithéliales.
Tumeurs séreuses
Ces tumeurs ovariennes sont caractérisées dans leurs formes les mieux différenciées par des cellules ressemblant à celles de la trompe. Macroscopiquement, il s’agit de tumeurs kystiques et papillaires, volontiers bilatérales. L’aspect histologique est celui d’une prolifération de cellules très proches des cellules tubaires si la tumeur est bien différenciée, ou d’aspect anaplasique avec atypies sévères si elle est peu différenciée. L’architecture est glandulaire, papillaire ou solide. Des nombreuses calcifications (calcosphérites ou psammomes) sont présents.
Le système de « grading » de Silverberg en 3 points semble le plus fiable mais ne fait pas l’unanimité (Singh et coll., 2008

).
Des anomalies à type de mutations de P53 sont fréquemment retrouvées. Des mutations de KRAS sont également fréquentes.
Tumeurs séreuses à la limite de la malignité (TSLM)
Critères de définition
Le diagnostic est porté d’après l’examen histologique de la lésion ovarienne qu’il existe ou non des localisations extra-ovariennes. Le critère essentiel et indispensable est l’absence d’infiltration du stroma ovarien (Seidman et Kurman, 1996

; Eichhorn et coll., 1999

; Wong et Gershenson, 2007

; Kurman et coll., 2005

).
Caractéristiques histologiques habituelles
Ces tumeurs sont caractérisées par un bourgeonnement épithélial, une pluristratification, une activité mitotique et des atypies cytonucléaires. Les TSLM représentent entre 10 et 15 % de l’ensemble des tumeurs séreuses et 20 % à 30 % des tumeurs séreuses malignes de l’ovaire. Le pic de fréquence correspond aux quatrième et cinquième décades. La découverte est pour 40 à 84 % au stade I, 7 à 22 % au stade II et 4 à 40 % au stade III. Il n’y a aucune aucune spécificité macroscopique mais la tumeur est souvent (25 à 33 %) bilatérale.
Ces tumeurs sont kystiques et à développement endophytique, contenant un liquide clair, eau de roche ou citrin ; elles présentent des végétations et papilles plus ou moins coalescentes ; les territoires solides présentent une composante adénofibromateuse.
Certaines tumeurs (25 %) présentent un développement endophytique et exophytique avec des végétations de surface. Plus rarement, le développement se fait en surface de l’ovaire (papillome séreux de surface). Leur taille est variable (diamètre de 5 à 20 cm) ; leur structure est homogène ; l’architecture est très souvent papillaire et elles présentent de nombreuses végétations soit dans la lumière des kystes ou à la surface de l’ovaire. La bordure épithéliale est plus ou moins pluristratifiée, désorganisée. Les atypies cytonucléaires sont modérées, les mitoses peu nombreuses (< 4/10 HPF). Des calcosphérites (marqueur d’une différenciation papillaire) sont présents dans plus de 50 %. On note un discret infiltrat lymphocytaire dans 25 % des cas. Il existe de nombreuses invaginations épithéliales au sein des axes papillaires, dans le stroma ovarien adjacent mais ces invaginations ne s’accompagnent pas de modification du stroma.
Principaux problèmes des tumeurs frontières séreuses
Il ne faut pas méconnaître un carcinome séreux invasif, il faut reconnaître une micro-invasion, discriminer les différents types d’implants et identifier la variante micropapillaire.
Environ 10 % des TSLM comportent des secteurs de micro-invasion de certains axes papillaires. Ces aspects sont apparemment dépourvus de signification pronostique péjorative (Seidman et Kurman, 2000

). Au sein des axes papillaires on observe des cellules isolées ou des formations glandulaires et micropapillaires à contours irréguliers et à limites estompées, entourées d’un stroma réactionnel, inflammatoire et desmoplastique (Hart, 1977

; Seidman et coll., 2002

).
En 1996, Kurman et coll. ont proposé de reconnaître une entité particulière caractérisée par la fréquence des implants péritonéaux associés, notamment de type invasifs : les tumeurs séreuses micropapillaire ou MicroPapillary Serous Carcinoma « MPSC » (Katabuchi et coll., 1998

; Eichhorn et coll., 1999

; Gras et coll., 2001

; Gershenson, 2002

; Nassar et coll., 2004

; Smith Sehdev et coll., 2003

). Leur architecture est micropapillaire ou cribriforme. Au niveau de l’ovaire, elles peuvent être non infiltrantes ou micro infiltrantes Une zone micropapillaire d’au moins 5 mm de diamètre est présente sur les échantillons. Leur pronostic plus péjoratif que celui des tumeurs séreuses à la limite de la malignité « classiques » appelées « tumeurs séreuses atypiques et proliférantes » (Atypical Proliferative Serous Tumors APST).
Tumeurs mucineuses
Les tumeurs épithéliales mucineuses représentent environ 12-15 % des tumeurs ovariennes, la plupart sont bénignes (75 %), 15 % sont à malignité limite (TML) (borderline) et 10 % sont carcinomateuses. Elles sont caractérisées par une prolifération de cellules mucosécrétantes, rappelant l’épithélium endocervical ou intestinal
Cette différenciation détermine des entités clinicopathologiques de TML, de présentation et devenir différents. La plupart des tumeurs bénignes sont de type endocervical, environ 85 % des TML sont de type intestinal, de même que pratiquement tous les carcinomes invasifs. Un continuum lésionnel est souvent observé dans les tumeurs mucineuses (bénin, prolifératif, malin) et, au sein d’une tumeur maligne, différents degrés de malignité peuvent être observés.
Tumeurs mucineuses à malignité limite (TML)
Les tumeurs mucineuses peuvent présenter une différenciation mucineuse intestinale ou endocervicale. Cette différenciation détermine des entités clinicopathologiques de TML de présentation et devenir différents. Elles représentent 40 à 50 % de toutes les tumeurs mucineuse malignes et 70 % des tumeurs de stade I (Chaitin et coll., 1985

; Hoerl et Hart, 1998

; Nomura et Aizawa, 2000

; Hart et Norris, 1973

).
TML endocervicales
Elles sont rares et représentent environ 15 % des TML mucineuses. Elles présentent les caractéristiques clinicopathologiques suivantes : un âge moyen (30 ans), une bilatéralité dans 40 % des cas, une extension extra ovarienne dans 20 % des cas lors du diagnostic, une association avec une endométriose. Macroscopiquement les lésions sont essentiellement uniloculaires, kystiques. Microscopiquement, l’architecture est proche des TML séreuses : les papilles nombreuses sont revêtues par des cellules mucosécrétantes, plus ou moins atypiques, et réalisant de nombreuses touffes desquamant dans la lumière des kystes. Il n’y a pas de cellules caliciformes mais des cellules éosinophiles, de type endocervical. Il n’y a pas de critères cellulaires ou architecturaux de malignité. L’inflammation stromale et intra épithéliale est constante. Le pronostic est excellent, proche de celui des TML séreuses.
TML mucineuses de type intestinal
Fréquentes, elles représentent environ 85 % des TML mucineuses. Elles présentent les caractéristiques clinicopathologiques suivantes : un âge moyen de 41 ans ; une bilatéralité rare, dans moins de 10 % des cas, une extension extra-ovarienne rare (90 % de stade I). Macroscopiquement les lésions sont essentiellement multiloculaires, kystiques. Microscopiquement, on observe des kystes et des glandes bordées d’un épithélium intestinal atypique. Les cellules en gobelets présentent une stratification sous forme de 2 à 3 couches avec atypies nucléaires discrètes à modérées ; le nombre de mitoses est variable (Riopel et coll., 1999

).
La distinction entre TML mucineuse intestinale et carcinome mucineux invasif est difficile. À l’opposé, des TML séreuses qui sont des entités cliniques à part entière (rares formes de passage ou rechute sous la forme d’un carcinome invasif), les TML intestinales représentent des lésions « pré-invasives » et donc il faut rechercher attentivement les foyers de carcinome intra épithélial et de microinvasion.
Définition histopathologique du carcinome mucineux ovarien primitif versus TML mucineuse
La frontière entre une lésion proliférative et carcinomateuse mucineuse est un sujet de controverses. Ce problème ne se pose en fait que pour les tumeurs à différenciation intestinale.
La classification de 1973 de l’OMS propose le critère suivant : les TML mucineuses sont des lésions montrant un degré de prolifération épithéliale plus important que dans les cystadénomes bénins, mais, restant dépourvues d’invasion stromale. Cependant, l’évaluation d’une invasion stromale est difficile en raison de l’architecture irrégulière des tumeurs mucineuses, des structures glandulaires étant retrouvées en profondeur et une réaction inflammatoire du stroma peut se voir dans les TML mucineuses intestinales. Hart et Norris ont donc proposé une nouvelle classification en 1977 (Hart, 1977

). Une tumeur sort de la catégorie des TML mucineuses et devient un carcinome mucineux non invasif lorsqu’elle présente un revètement épithélial pluristratifié de 4 couches ou plus et des anomalies cytonucléaires, une architecture cribriforme et/ou des papilles cellulaires pleines, sans axe. Dans leur série, ces auteurs ont pu mettre en évidence une différence de survie nette entre des TML (survie de 96 % à 10 ans) et des carcinomes mucineux non invasifs de stade I (survie de 67 % à 10 ans). Cette classification s’est donc considérablement développée aux États-Unis. Cependant plusieurs études récentes (Rodriguez et coll., 2004

; Rodriguez et Prat, 2002

) ont conclu qu’il n’y avait pas de différence significative en terme de survie à distinguer un carcinome mucineux non invasif au sein du groupe des TML et que le critère d’invasion du stroma restait le plus fort. Scully et coll. (1998

) ont donc proposé de conserver les critères diagnostiques de l’OMS pour les TML et de subdiviser les tumeurs intestinales en TML :
• avec atypies cytonucléaires (moins de 4 couches de cellules, grade nucléaire 1 ou 2) ;
• avec carcinome intraépithélial (plus de 4 couches de cellules, cribriforme, papilles sans axes, grade nucléaire 3) ;
• microinvasif (se voit dans les deux entités) ;
• carcinome invasif.
Définition de la microinvasion
Des petits foyers de cellules tumorales isolées ou en amas peuvent se rencontrer au sein d’un stroma réactionnel, au contact de TML intestinales par ailleurs typiques.
La micro invasion a été arbitrairement définie comme inférieure à 10 mm2 soit au plus 3 mm dans les deux dimensions (seuil utilisé pour les TML séreuses), sur un ou plusieurs foyers. La présence de granulomes de mucine dans le stroma ne doit pas être interprétée comme un signe d’infiltration du stroma.
Carcinomes mucineux invasifs
Il s’agit d’un diagnostic rare, d’élimination. Deux formes architecturales de carcinome mucineux invasif intestinal sont décrites (Lee et Scully, 2000

) :
• les formes infiltrantes avec invasion évidente du stroma sous la forme de glandes, d’amas cellulaires ou de cellules isolées associée le plus souvent à un stroma desmoplastique ;
• les formes expansives avec front d’invasion constitué de glandes confluentes ou complexes sans stroma ou presque, mesurant plus de 10 mm2 de surface.
La seconde forme histopathologique présente un pronostic excellent pour les tumeurs de stade I.
Diagnostic différentiel
Le diagnostic différentiel des TML de type intestinal doit être fait avec les métastases du tractus digestif (essentiellement), de la vésicule biliaire, du pancréas et du col utérin. Il faut aussi éliminer les métastases sous forme de TML d’une tumeur appendiculaire, les carcinomes séreux et endométrioïdes riches en mucines, la tumeur de Sertoli Leydig à contingent hétérologue mucineux et les tumeurs neuroendocrines mucineuses métastatiques.
Pendant de nombreuses années, lorsqu’une lésion de pseudomyxoma peritonei (masses mucineuses, filantes infiltrant le pelvis et l’abdomen) était associée à une masse ovarienne mucineuse kystique, la lésion était considérée comme d’origine ovarienne primitive de stade II ou III. Sur le plan microscopique la lésion ovarienne correspond le plus souvent à une TML intestinale. En fait, l’appendice était atteint macroscopiquement dans 60 % des cas. Les études les plus récentes montrent que ces lésions correspondent en fait dans la plupart des cas à des carcinomes appendiculaires, métastasant aux ovaires. Les arguments en faveur de cette hypothèse sont la bilatéralité fréquente des tumeurs ovariennes, la latéralisation à droite en cas de tumeur ovarienne unique, l’atteinte appendiculaire microscopique dans plus de 80 % des cas, et des similitudes morphologiques (forme à grandes cellules hautes), immunohistochimiques (CK20+, CK7-), génétiques (mutations de K-ras). En outre, on retrouve fréquemment un aspect de TML dans l’ovaire (contrastant avec l’intensité de l’extension péritonéale). Enfin, on note l’absence d’atteinte appendiculaire en cas de carcinome mucineux sans atteintes péritonéale et sans pseudomyxoma péritonei. Cependant, certains auteurs, pensent qu’il pourrait s’agir néanmoins, dans certains cas, de deux entités tumorales indépendantes et synchrones. Dans ce cas, l’atteinte ovarienne est plus souvent unilatérale, les phénotypes des deux tumeurs sont différents et le pronostic est plus favorable.
Tumeurs endométrioïdes
Cette variété de tumeurs concerne 10 à 20 % des cancers de l’ovaire, et survient chez les femmes dans la 5
e et 6
e décade. Elles sont bilatérales dans 30 % des cas. Histologiquement, la tumeur est identique à un adénocarcinome de l’endomètre. Dans 20 % des cas, il s’y associe un adénocarcinome de l’endomètre. Elle pourrait être développée sur endométriose (Young et coll., 1982

; Nogales et coll., 1996

).
Histologie
L’aspect est celui de carcinome endomètrioïde classique, c’est-à-dire évoquant la muqueuse endométriale à architecture tubulaire, cribriforme ou villoglandulaire.
Les cellules tumorales expriment la vimentine, les kératines, l’antigène épithélial de membrane, les récepteurs hormonaux. L’alpha-inhibine n’est pas exprimée. Il existe des formes bénigne, borderline et maligne. La difficulté diagnostique réside dans les formes borderline (TBL) qui intéressent souvent un contingent épithélial et/ou stromal.
TBL endométrioïde
L’adénofibrome endométrioïde présente sur un fond fibromateux abondant (semblable au stroma ou au fibrome ovarien) des glandes bordées par un épithélium cylindrique de type endométrial (Snyder et coll., 1988

). L’absence de chorion cytogène le distingue de l’endométriose ovarienne. Lorsque les glandes sont régulières, sans adossement, et bordées d’un épithélium dépourvu d’atypie nucléaire, on parle d’adénofibrome endométrioïde bénin. L’adénofibrome endométrioïde borderline se caractérise par des glandes d’architecture complexe, bordées de structures papillaires, ou encore des glandes irrégulières qui s’adossent. Les noyaux peuvent être plus ou moins atypiques. Si les atypies sont importantes et en l’absence d’invasion stromale, le terme d’adénofibrome borderline avec carcinome intra-épithélial est employé. La distinction entre un adénofibrome borderline et un carcinome invasif peut être très difficile (Tornos et coll., 1995

). Cependant, cette distinction est essentielle car les adénofibromes borderline ont un excellent pronostic après annexectomie unilatérale. La stroma-réaction desmoplastique et l’infiltration irrégulière et désordonnée des glandes dans ce stroma identifient le carcinome infiltrant. À l’inverse, l’adénofibrome conserve un stroma fibromateux abondant, et il n’y pas de nécrose tumorale, en dehors de la nécrose centrale éventuelle dans les foyers de métaplasie malpighienne.
Génétique
Les carcinomes endométrioïdes ovariens se caractérisent par des anomalies génétiques qui diffèrent de celles observées dans d’autres types histologiques de carcinomes ovariens et se rapprochent de celles constatées dans les cancers de l’endomètre. Des anomalies semblables sont observées dans les carcinomes à cellules claires de l’ovaire, histogénétiquement très proches puisque ces deux types histologiques de carcinomes peuvent se développer dans un kyste d’endométriose, et coexistent fréquemment dans une même tumeur (environ 25 % des cas) (Mizuno et coll., 2006

; Eltabbakh et coll., 2006

; Willner et coll., 2007

).
PTEN (phosphate and tensin homolog deleted on chromosom ten) encore appelé MMAC1 (Mutated in Multiple Advanced Cancers 1) est un gène suppresseur de tumeur localisé sur le chromosome 10q23, dont le produit interviendrait dans le contrôle de la prolifération cellulaire et l’organisation tissulaire. Une fréquence accrue (43 %) de perte d’hétérozygotie à ce locus (10q23) a été constatée dans les carcinomes endométrioïdes de l’ovaire accompagnée d’une mutation somatique du gène dans 21 % des cas alors qu’aucune anomalie de PTEN n’est détectée dans les autres formes histologiques. Ces anomalies (délétion d’un allèle et mutation de l’allèle restant) ont également été constatées dans 8 % des carcinomes à cellules claires et 20 % des kystes d’endométriose de l’ovaire, suggérant que l’inactivation de PTEN est un événement génétique précoce dans la carcinogenèse ovarienne (Kolasa et coll., 2006

; Tornos et coll., 1995

).
Le gène CTNNB1 localisé sur le chromosome 3p code pour la beta caténine, une protéine connue comme molécule d’adhésion et facteur de transcription. Une mutation somatique, activatrice située sur l’exon 3 de ce gène est identifiée dans 50 % des carcinomes endométrioïdes de l’ovaire, aboutissant à une accumulation anormale de la protéine dans le noyau (détectable par immunohistochimie), alors qu’aucun des autres types de carcinomes ovariens, y compris les carcinomes à cellules claires, ne présente d’anomalie de ce gène (Palacios et Gamalo, 1998

).
Les carcinomes endométrioïdes représentent le type histologique de cancer ovarien où le taux d’instabilité des microsatellites est le plus élevé. Ces anomalies rentrent dans le cadre des formes familiales (syndrome de Lynch) avec une mutation germinale des gènes de réparation de l’ADN (hMLH1 ou hMSH2). L’instabilité des microsatellites est également détectée dans 12 à 19 % des carcinomes endométrioïdes ovariens sporadiques, secondaire à une inactivation du gène hMLH-1 par hyperméthylation de son promoteur (Gras et coll., 2001

).
Pronostic et évolution
La survie à 5 ans des patientes est de 78 %, 63 %, 24 % et 6 %, pour les stades I, II, III et IV, respectivement. Les carcinomes de grade 1 ou 2 ont un meilleur pronostic que les carcinomes de grade 3, à stade égal.
Cancer à cellules claires
Il s’agit d’une autre forme histologique, souvent mélangée aux autres. Caractérisée par la présence de cellules claires ou « en galet », il est classiquement de haut grade et de mauvais pronostic. Cependant, des formes bénignes et borderline ont été décrites.
Autres types histologiques
Les carcinomes indifférenciés représentent 4 à 5 % des tumeurs de l’ovaire. Le pronostic est extrêmement péjoratif, et la difficulté du diagnostic est dans le diagnostic différentiel, notamment avec une tumeur de la granulosa.
Les tumeurs de Brenner ou carcinomes transitionnels représentent 1 à 2 % des tumeurs de l’ovaire et se classent en bénigne, borderline ou maligne. Elles sont composées d’éléments épithéliaux qui ressemblent histologiquement à l’urothélium et aux cancers qui s’y développent. Le pronostic pour les carcinomes transitionnels est de 35-40 % à 5 ans.
Les tumeurs mixtes mülleriennes/mésodermiques malignes (TMMM), ou carcinosarcomes, comportent à la fois un contingent épithélial et mésenchymateux malin. Elles sont rares (< 1 % des cancers de l’ovaire) et surviennent plutot en post-ménopause. Elles sont très agressives sur le plan clinique.
Les tumeurs mixtes épithéliales sont des tumeurs épithéliales associant en proportion variable 2 ou plus des types histologiques majeurs (séreux, mucineux, endométrioïde, à cellules claires et Brenner/transitionnel). L’incidence est variable de 0,5 à 4 %. Elles sont classées en bénignes, borderline ou malignes.
En conclusion, il existe de nombreuses formes histologiques du cancer de l’ovaire. Nous avons décrit les principales, celles qui sont les enjeux thérapeutiques actuels et de demain.
Bibliographie
[1] chaitin ba,
gershenson dm,
evans hl. Mucinous tumors of the ovary. A clinicopathologic study of 70 cases.
Cancer. 1985;
55:19581962

[2] eichhorn jh,
bell da,
young rh,
scully re. Ovarian serous borderline tumors with micropapillary and cribriform patterns: a study of 40 cases and comparison with 44 cases without these patterns.
Am J Surg Pathol. 1999;
23:397409

[3] eltabbakh gh,
mount sl,
beatty b,
simmons-arnold l,
cooper k. Clinical and molecular differences between clear cell and papillary serous ovarian carcinoma.
J Surg Oncol. 2006;
93:379386

[4] fernando ms,
amarasekera lr. Micropapillary serous carcinoma of the ovary: a report of three cases.
Ceylon Med J. 1999;
44:137139

[5] gershenson dm. Is micropapillary serous carcinoma for real?.
Cancer. 2002;
95:677680

[6] gras e,
catasus l,
arguelles r,
moreno-bueno g,
palacios j, et coll.. Microsatellite instability, MLH-1 promoter hypermethylation, and frameshift mutations at coding mononucleotide repeat microsatellites in ovarian tumors.
Cancer. 2001;
92:28292836

[7] hart wr. Ovarian epithelial tumors of borderline malignancy (carcinomas of low malignant potential).
Hum Pathol. 1977;
8:541549

[8] hart wr,
norris hj. Borderline and malignant mucinous tumors of the ovary. Histologic criteria and clinical behavior.
Cancer. 1973;
31:10311045

[9] hoerl hd,
hart wr. Primary ovarian mucinous cystadenocarcinomas: a clinicopathologic study of 49 cases with long-term follow-up.
Am J Surg Pathol. 1998;
22:14491462

[10] katabuchi h,
tashiro h,
cho kr,
kurman rj,
hedrick el. Micropapillary serous carcinoma of the ovary: an immunohistochemical and mutational analysis of p53.
Int J Gynecol Pathol. 1998;
17:5460

[11] kolasa ik,
rembiszewska a,
janiec-jankowska a,
dansonka-mieszkowska a,
lewandowska am, et coll.. PTEN mutation, expression and LOH at its locus in ovarian carcinomas. Relation to TP53, K-RAS and BRCA1 mutations.
Gynecol Oncol. 2006;
103:692697

[12] kurman rj,
seidman jd,
shih im. Serous borderline tumours of the ovary.
Histopathology. 2005;
47:310315

[13] lee kr,
scully re. Mucinous tumors of the ovary: a clinicopathologic study of 196 borderline tumors (of intestinal type) and carcinomas, including an evaluation of 11 cases with ’pseudomyxoma peritonei’.
Am J Surg Pathol. 2000;
24:14471464

[14] matias-guiu x,
lagarda h,
catasus l,
bussaglia e,
gallardo a, et coll.. Clonality analysis in synchronous or metachronous tumors of the female genital tract.
Int J Gynecol Pathol. 2002;
21:205211

[15] mizuno m,
kikkawa f,
shibata k,
kajiyama h,
ino k, et coll.. Long-term follow-up and prognostic factor analysis in clear cell adenocarcinoma of the ovary.
J Surg Oncol. 2006;
94:138143

[16] nassar h,
pansare v,
zhang h,
che m,
sakr w, et coll.. Pathogenesis of invasive micropapillary carcinoma: role of MUC1 glycoprotein.
Mod Pathol. 2004;
17:10451050

[17] nogales ff,
bergeron c,
carvia re,
alvaro t,
fulwood hr. Ovarian endometrioid tumors with yolk sac tumor component, an unusual form of ovarian neoplasm. Analysis of six cases.
Am J Surg Pathol. 1996;
20:10561066

[18] nomura k,
aizawa s. Noninvasive, microinvasive, and invasive mucinous carcinomas of the ovary: a clinicopathologic analysis of 40 cases.
Cancer. 2000;
89:15411546

[19] obata k,
morland sj,
watson rh,
hitchcock a,
chenevix-trench g, et coll.. Frequent PTEN/MMAC mutations in endometrioid but not serous or mucinous epithelial ovarian tumors.
Cancer Res. 1998;
58:20952097

[20] palacios j,
gamallo c. Mutations in the beta-catenin gene (CTNNB1) in endometrioid ovarian carcinomas.
Cancer Res. 1998;
58:13441347

[21] riopel ma,
ronnett bm,
kurman rj. Evaluation of diagnostic criteria and behavior of ovarian intestinal-type mucinous tumors: atypical proliferative (borderline) tumors and intraepithelial, microinvasive, invasive, and metastatic carcinomas.
Am J Surg Pathol. 1999;
23:617635

[22] rodriguez im,
prat j. Mucinous tumors of the ovary: a clinicopathologic analysis of 75 borderline tumors (of intestinal type) and carcinomas.
Am J Surg Pathol. 2002;
26:139152

[23] rodriguez im,
irving ja,
prat j. Endocervical-like mucinous borderline tumors of the ovary: a clinicopathologic analysis of 31 cases.
Am J Surg Pathol. 2004;
28:13111318

[24] sato n,
tsunoda h,
nishida m,
morishita y,
takimoto y,
kubo t,
noguchi m. Loss of heterozygosity on 10q23.3 and mutation of the tumor suppressor gene PTEN in benign endometrial cyst of the ovary: possible sequence progression from benign endometrial cyst to endometrioid carcinoma and clear cell carcinoma of the ovary.
Cancer Res. 2000;
60:70527056

[25] scully re,
young rh,
clement pb. Tumors of the ovary, maldeveloped gonads, fallopian tube, and broad ligament.
Atlas of tumor pathology. Third Series. Fascicule 23. Washington DC:1998;
51168

[26] scully re. Ovarian tumors. A review.
Am J Pathol. 1977;
87:686720

[27] seidman jd,
kurman rj. Ovarian serous borderline tumors: a critical review of the literature with emphasis on prognostic indicators.
Hum Pathol. 2000;
31:539557

[28] seidman jd,
kurman rj. Pathology of ovarian carcinoma.
Hematol Oncol Clin North Am. 2003;
17:909925vii:

[29] seidman jd,
kurman rj. Subclassification of serous borderline tumors of the ovary into benign and malignant types. A clinicopathologic study of 65 advanced stage cases.
Am J Surg Pathol. 1996;
20:13311345

[30] seidman jd,
kurman rj. Treatment of micropapillary serous ovarian carcinoma (the aggressive variant of serous borderline tumors).
Cancer. 2002;
95:675676

[31] seidman jd,
ronnett bm,
kurman rj. Pathology of borderline (low malignant potential) ovarian tumours.
Best Pract Res Clin Obstet Gynaecol. 2002;
16:499512

[32] shibata k,
kikkawa f,
mika m,
suzuki y,
kajiyama h, et coll.. Neoadjuvant chemotherapy for FIGO stage III or IV ovarian cancer: Survival benefit and prognostic factors.
Int J Gynecol Cancer. 2003;
13:587592

[33] singh n,
ayhan a,
menon u,
chin aleong ja,
faruqi az, et coll.. Grading of serous ovarian carcinoma: further evidence of a lack of agreement between conventional grading systems.
Histopathology. 2008;
52:393395

[34] smith sehdev ae,
sehdev ps,
kurman rj. Noninvasive and invasive micropapillary (low-grade) serous carcinoma of the ovary: a clinicopathologic analysis of 135 cases.
Am J Surg Pathol. 2003;
27:725736

[35] snyder rr,
norris hj,
tavassoli f. Endometrioid proliferative and low malignant potential tumors of the ovary. A clinicopathologic study of 46 cases.
Am J Surg Pathol. 1988;
12:661671

[36] tornos c,
silva eg,
ordonez ng,
gershenson dm,
young rh,
scully re. Endometrioid carcinoma of the ovary with a prominent spindle-cell component, a source of diagnostic confusion. A report of 14 cases.
Am J Surg Pathol. 1995;
19:13431353

[37] walsh t,
king mc. Ten genes for inherited breast cancer.
Cancer Cell. 2007;
11:103105

[38] wenham rm,
schildkraut jm,
mclean k,
calingaert b,
bentley rc, et coll.. Polymorphisms in BRCA1 and BRCA2 and risk of epithelial ovarian cancer.
Clin Cancer Res. 2003;
9:43964403

[39] willner j,
wurz k,
allison kh,
galic v,
garcia rl, et coll.. Alternate molecular genetic pathways in ovarian carcinomas of common histological types.
Hum Pathol. 2007;
38:607613

[40] wong kk,
gershenson d. The continuum of serous tumors of low malignant potential and low-grade serous carcinomas of the ovary.
Dis Markers. 2007;
23:377387

[41] young rh,
prat j,
scully re. Ovarian endometrioid carcinomas resembling sex cord-stromal tumors. A clinicopathological analysis of 13 cases.
Am J Surg Pathol. 1982;
6:513522

→ Aller vers le SOMMAIRE de l'ouvrage
 ). Dans les pays occidentalisés, ils sont presque aussi fréquents que les cancers du corps ou du col de l’utérus. Deux facteurs sont associés avec un risque diminué de développer la maladie : une grande parité et l’utilisation de contraceptifs oraux, ce qui suggère un rapport direct avec l’ovulation dans l’étiologie de la maladie. Le rythme de vie, l’obésité en particulier, est associé à un risqué élevé de développer un cancer de l’ovaire dans les pays industrialisés. Le rôle du traitement hormonal substitutif est également discuté.
). Dans les pays occidentalisés, ils sont presque aussi fréquents que les cancers du corps ou du col de l’utérus. Deux facteurs sont associés avec un risque diminué de développer la maladie : une grande parité et l’utilisation de contraceptifs oraux, ce qui suggère un rapport direct avec l’ovulation dans l’étiologie de la maladie. Le rythme de vie, l’obésité en particulier, est associé à un risqué élevé de développer un cancer de l’ovaire dans les pays industrialisés. Le rôle du traitement hormonal substitutif est également discuté. ). Lorsqu’on évoque les cancers de l’ovaire, on exclut les cancers métastatiques (cancers secondaires) qui se sont formés à partir de cellules cancéreuses provenant d’un autre organe (estomac, poumon, foie...) et qui ont migré vers les ovaires. Cette occurrence n’est pas exceptionnelle. Le cancer de l’ovaire est essentiellement un adénocarcinome, c’est-à-dire une tumeur maligne qui s’organise en formant des structures glandulaires dans cet organe.
). Lorsqu’on évoque les cancers de l’ovaire, on exclut les cancers métastatiques (cancers secondaires) qui se sont formés à partir de cellules cancéreuses provenant d’un autre organe (estomac, poumon, foie...) et qui ont migré vers les ovaires. Cette occurrence n’est pas exceptionnelle. Le cancer de l’ovaire est essentiellement un adénocarcinome, c’est-à-dire une tumeur maligne qui s’organise en formant des structures glandulaires dans cet organe. ; Kurman et coll., 2005
; Kurman et coll., 2005 ). Elle représente 10 à 15 % des tumeurs ovariennes. C’est une forme intermédiaire entre tumeur bénigne et cancer. Ces tumeurs surviennent à un âge plus précoce que le cancer de l’ovaire. Elles sont beaucoup moins agressives que les précédentes et leur pronostic est bon, quoique incertain d’où leur appellation.
). Elle représente 10 à 15 % des tumeurs ovariennes. C’est une forme intermédiaire entre tumeur bénigne et cancer. Ces tumeurs surviennent à un âge plus précoce que le cancer de l’ovaire. Elles sont beaucoup moins agressives que les précédentes et leur pronostic est bon, quoique incertain d’où leur appellation. ). Le premier système établit le stade du cancer en fonction de l’envahissement d’un, des 2 ovaires, de la cavité péritonéale, des organes de voisinage, le deuxième est basé sur les données anatomopathologiques, donc post-opératoires.
). Le premier système établit le stade du cancer en fonction de l’envahissement d’un, des 2 ovaires, de la cavité péritonéale, des organes de voisinage, le deuxième est basé sur les données anatomopathologiques, donc post-opératoires. ).
). ; Wenham et coll., 2003
; Wenham et coll., 2003 ; Walsh et King, 2007
; Walsh et King, 2007 ).
). ; Scully, 1977
; Scully, 1977 ). Les tumeurs épithéliales sont composées en majorité de tumeurs séreuses (50 %) puis par ordre de fréquence décroissant de tumeurs mucineuses, endométrioïdes, à cellules claires, les tumeurs de Brenner, les tumeurs mixtes mülleriennes malignes, les carcinomes indifférenciés et les tumeurs mixtes épithéliales.
). Les tumeurs épithéliales sont composées en majorité de tumeurs séreuses (50 %) puis par ordre de fréquence décroissant de tumeurs mucineuses, endométrioïdes, à cellules claires, les tumeurs de Brenner, les tumeurs mixtes mülleriennes malignes, les carcinomes indifférenciés et les tumeurs mixtes épithéliales. ).
). ; Eichhorn et coll., 1999
; Eichhorn et coll., 1999 ; Wong et Gershenson, 2007
; Wong et Gershenson, 2007 ; Kurman et coll., 2005
; Kurman et coll., 2005 ).
). ). Au sein des axes papillaires on observe des cellules isolées ou des formations glandulaires et micropapillaires à contours irréguliers et à limites estompées, entourées d’un stroma réactionnel, inflammatoire et desmoplastique (Hart, 1977
). Au sein des axes papillaires on observe des cellules isolées ou des formations glandulaires et micropapillaires à contours irréguliers et à limites estompées, entourées d’un stroma réactionnel, inflammatoire et desmoplastique (Hart, 1977 ; Seidman et coll., 2002
; Seidman et coll., 2002 ).
). ; Eichhorn et coll., 1999
; Eichhorn et coll., 1999 ; Gras et coll., 2001
; Gras et coll., 2001 ; Gershenson, 2002
; Gershenson, 2002 ; Nassar et coll., 2004
; Nassar et coll., 2004 ; Smith Sehdev et coll., 2003
; Smith Sehdev et coll., 2003 ). Leur architecture est micropapillaire ou cribriforme. Au niveau de l’ovaire, elles peuvent être non infiltrantes ou micro infiltrantes Une zone micropapillaire d’au moins 5 mm de diamètre est présente sur les échantillons. Leur pronostic plus péjoratif que celui des tumeurs séreuses à la limite de la malignité « classiques » appelées « tumeurs séreuses atypiques et proliférantes » (Atypical Proliferative Serous Tumors APST).
). Leur architecture est micropapillaire ou cribriforme. Au niveau de l’ovaire, elles peuvent être non infiltrantes ou micro infiltrantes Une zone micropapillaire d’au moins 5 mm de diamètre est présente sur les échantillons. Leur pronostic plus péjoratif que celui des tumeurs séreuses à la limite de la malignité « classiques » appelées « tumeurs séreuses atypiques et proliférantes » (Atypical Proliferative Serous Tumors APST). ; Hoerl et Hart, 1998
; Hoerl et Hart, 1998 ; Nomura et Aizawa, 2000
; Nomura et Aizawa, 2000 ; Hart et Norris, 1973
; Hart et Norris, 1973 ).
). ).
). ). Une tumeur sort de la catégorie des TML mucineuses et devient un carcinome mucineux non invasif lorsqu’elle présente un revètement épithélial pluristratifié de 4 couches ou plus et des anomalies cytonucléaires, une architecture cribriforme et/ou des papilles cellulaires pleines, sans axe. Dans leur série, ces auteurs ont pu mettre en évidence une différence de survie nette entre des TML (survie de 96 % à 10 ans) et des carcinomes mucineux non invasifs de stade I (survie de 67 % à 10 ans). Cette classification s’est donc considérablement développée aux États-Unis. Cependant plusieurs études récentes (Rodriguez et coll., 2004
). Une tumeur sort de la catégorie des TML mucineuses et devient un carcinome mucineux non invasif lorsqu’elle présente un revètement épithélial pluristratifié de 4 couches ou plus et des anomalies cytonucléaires, une architecture cribriforme et/ou des papilles cellulaires pleines, sans axe. Dans leur série, ces auteurs ont pu mettre en évidence une différence de survie nette entre des TML (survie de 96 % à 10 ans) et des carcinomes mucineux non invasifs de stade I (survie de 67 % à 10 ans). Cette classification s’est donc considérablement développée aux États-Unis. Cependant plusieurs études récentes (Rodriguez et coll., 2004 ; Rodriguez et Prat, 2002
; Rodriguez et Prat, 2002 ) ont conclu qu’il n’y avait pas de différence significative en terme de survie à distinguer un carcinome mucineux non invasif au sein du groupe des TML et que le critère d’invasion du stroma restait le plus fort. Scully et coll. (1998
) ont conclu qu’il n’y avait pas de différence significative en terme de survie à distinguer un carcinome mucineux non invasif au sein du groupe des TML et que le critère d’invasion du stroma restait le plus fort. Scully et coll. (1998 ) ont donc proposé de conserver les critères diagnostiques de l’OMS pour les TML et de subdiviser les tumeurs intestinales en TML :
) ont donc proposé de conserver les critères diagnostiques de l’OMS pour les TML et de subdiviser les tumeurs intestinales en TML : ) :
) : ; Nogales et coll., 1996
; Nogales et coll., 1996 ).
). ). L’absence de chorion cytogène le distingue de l’endométriose ovarienne. Lorsque les glandes sont régulières, sans adossement, et bordées d’un épithélium dépourvu d’atypie nucléaire, on parle d’adénofibrome endométrioïde bénin. L’adénofibrome endométrioïde borderline se caractérise par des glandes d’architecture complexe, bordées de structures papillaires, ou encore des glandes irrégulières qui s’adossent. Les noyaux peuvent être plus ou moins atypiques. Si les atypies sont importantes et en l’absence d’invasion stromale, le terme d’adénofibrome borderline avec carcinome intra-épithélial est employé. La distinction entre un adénofibrome borderline et un carcinome invasif peut être très difficile (Tornos et coll., 1995
). L’absence de chorion cytogène le distingue de l’endométriose ovarienne. Lorsque les glandes sont régulières, sans adossement, et bordées d’un épithélium dépourvu d’atypie nucléaire, on parle d’adénofibrome endométrioïde bénin. L’adénofibrome endométrioïde borderline se caractérise par des glandes d’architecture complexe, bordées de structures papillaires, ou encore des glandes irrégulières qui s’adossent. Les noyaux peuvent être plus ou moins atypiques. Si les atypies sont importantes et en l’absence d’invasion stromale, le terme d’adénofibrome borderline avec carcinome intra-épithélial est employé. La distinction entre un adénofibrome borderline et un carcinome invasif peut être très difficile (Tornos et coll., 1995 ). Cependant, cette distinction est essentielle car les adénofibromes borderline ont un excellent pronostic après annexectomie unilatérale. La stroma-réaction desmoplastique et l’infiltration irrégulière et désordonnée des glandes dans ce stroma identifient le carcinome infiltrant. À l’inverse, l’adénofibrome conserve un stroma fibromateux abondant, et il n’y pas de nécrose tumorale, en dehors de la nécrose centrale éventuelle dans les foyers de métaplasie malpighienne.
). Cependant, cette distinction est essentielle car les adénofibromes borderline ont un excellent pronostic après annexectomie unilatérale. La stroma-réaction desmoplastique et l’infiltration irrégulière et désordonnée des glandes dans ce stroma identifient le carcinome infiltrant. À l’inverse, l’adénofibrome conserve un stroma fibromateux abondant, et il n’y pas de nécrose tumorale, en dehors de la nécrose centrale éventuelle dans les foyers de métaplasie malpighienne. ; Eltabbakh et coll., 2006
; Eltabbakh et coll., 2006 ; Willner et coll., 2007
; Willner et coll., 2007 ).
). ; Tornos et coll., 1995
; Tornos et coll., 1995 ).
). ).
). ).
).