Questions posées par l’évaluation quantitative des risques aux faibles doses
2008
58-
Exemples des rayonnements ionisants et des dioxines
L’objet de ce chapitre est de fournir une illustration des questions posées par l’approche d’évaluation quantitative des risques sur la base d’exemples issus de la présente expertise. Nous avons retenu deux exemples de cancérogènes, les rayonnements ionisants et les dioxines et composés voisins, pour lesquels des données épidémiologiques de qualité suffisante existent pour la modélisation de la relation dose-réponse. Ce chapitre résume les données disponibles, et discute des problèmes rencontrés, en cherchant à expliciter les hypothèses et approximations sous-jacentes à la démarche. Il aborde pour l’essentiel les problèmes posés par l’extrapolation et dans une moindre mesure ceux posés par la transposition des résultats obtenus dans une population humaine à une autre population et enfin par l’analogie, en particulier pour ce qui concerne les rayonnements ionisants. Pour faciliter le parallèle entre les deux exemples, la discussion a été focalisée sur l’évaluation du risque tous cancers, sans considérer de site de cancer spécifiquement.
Rayonnements ionisants
L’existence d’effets stochastiques radio-induits a été démontrée par de nombreuses études expérimentales et épidémiologiques. Les études épidémiologiques ont porté sur des populations et des modes d’exposition très variés : expositions médicales (thérapeutiques ou diagnostiques), suivi des survivants des bombardements de Hiroshima et Nagasaki, expositions professionnelles (radiologues, travailleurs de l’industrie nucléaire, mineurs d’uranium…), expositions accidentelles (Tchernobyl), expositions environnementales (radon domestique…). Les résultats de ces études sont régulièrement évalués et synthétisés par des comités scientifiques tels que l’Unscear (United Nations Scientific Committee on the Effects of Atomic Radiation) (Unscear, 2000

) ou le Comité BEIR (Biological Effects of Ionising Radiations) (NRC, 2005

). Certaines de ces études, disposant de données d’exposition et sanitaires fiables, ont permis de mettre en évidence l’existence de relations exposition-réponse ou dose-réponse. Néanmoins, des questions persistent sur la validité de ces relations en deçà du domaine où les effets sont observés (extrapolation) (Brenner et coll., 2003

) et sur l’applicabilité de ces relations pour des populations différentes de celle dans laquelle elles ont été établies (transposition) (Hubert, 2003

).
Les effets stochastiques dépendent de nombreux facteurs : dose, nature du rayonnement (particules alpha, rayonnements bêta, gamma, X, neutrons), faible/fort transfert d’énergie linéique, voie d’exposition (inhalation, ingestion, irradiation externe), débit de dose (dose aiguë, fractionnée, chronique), partie du corps irradiée (corps entier, sensibilité, latence selon l’organe), facteurs individuels (sexe, âge, comportements tels que le tabagisme). La plupart des résultats épidémiologiques proviennent de populations ayant reçu des expositions externes, corps entier, et sur une courte période. Des hypothèses sont alors nécessaires (analogie) pour appliquer les relations dose-réponse estimées à des populations soumises à des expositions de type différent (exposition chronique, contaminations internes par ingestion ou inhalation…).
Depuis les années 1920, une solide doctrine de radioprotection s’est développée au plan international. La Commission internationale de protection radiologique (CIPR) a été créée en 1928. Elle s’appuie sur la synthèse des connaissances acquises en radiobiologie, en biologie moléculaire, en cancérologie et en épidémiologie, mais également sur de nombreux autres éléments (acceptabilité, précaution, coût...) pour définir des recommandations qui sont ensuite transformées en normes de protection (ICRP, 1991

). Des indicateurs synthétiques ont été élaborés dans un but de gestion en radioprotection. Ces indicateurs (détriment sanitaire, risque vie entière) reposent sur de nombreuses hypothèses, en particulier sur l’extrapolation des fortes doses aux faibles doses, sur l’analogie d’expositions ponctuelles à des expositions prolongées, et sur la transposition entre différentes populations. Ces hypothèses sont plus ou moins explicites (IPSN, 2002

), l’objectif étant d’obtenir des indicateurs applicables à toute population, intégrant les différents effets (mortalité par cancer, qualité de vie, effets héréditaires potentiels) et les différents types d’exposition. On peut souligner les points suivants :
• pour prendre en compte les différents types de rayonnements ionisants et les différences de sensibilité entre organes, des coefficients de pondération d’efficacité des rayonnements (WR) et de sensibilité tissulaire (WT) ont été élaborés. Le concept de dose efficace intègre ces différentes pondérations ;
• pour appliquer les résultats obtenus à niveaux de dose élevés à des doses faibles, il a été fait le choix de l’hypothèse de l’absence de seuil dans la relation dose-réponse (ICRP, 2006

) ;
• l’application d’un coefficient réducteur de l’effet des rayonnements ionisants (DDREF, Dose and Dose Rate Effectiveness Factor) de 2 est proposé pour estimer l’effet des rayonnements délivrés à faible dose (< 200 mSv) et/ou à faible débit de dose (< 100 mGy/h) (ICRP, 1991

) ;
• aucune cohorte n’a aujourd’hui été suivie jusqu’à extinction (c’est-à-dire jusqu’au décès de tous les individus la composant). L’estimation du risque sur la vie entière repose donc sur l’hypothèse d’un excès de risque constant sur toute la durée de vie.
Sur le plan scientifique, de nombreuses incertitudes persistent, qui justifient la continuation des travaux de recherche en cours, en particulier sur les effets des expositions chroniques à faibles doses et sur les effets des expositions internes (Gourmelon et coll., 2005

; Alpha-Risk, 2006

).
Extrapolation aux faibles doses
De nombreuses études montrent une augmentation du risque de cancer avec la dose au-delà de 100 mSv (Unscear, 2000

). En dessous de ce niveau, les effets des rayonnements ionisants ne sont pas démontrés, mais les risques associés représentent un enjeu majeur de santé publique dans la mesure où la population générale est soumise, en grande majorité, à de faibles doses. Notons que l’extrapolation à partir des résultats observables (plus de 100 mSv) vers les faibles doses se fait sur une distance relativement courte, inférieure à deux ordres de grandeur au maximum.
Une récente revue de la littérature concluait à l’absence de preuve d’une augmentation significative pour les doses inférieures à 100 mSv reçues à l’âge adulte (de Vathaire, 2005

). Comme les risques associés à ces niveaux de dose sont faibles, les variations des taux de base de cancer et l’existence de facteurs confondants peuvent rendre ces risques indétectables. Ainsi, peu d’études ont montré des risques significatifs pour des doses inférieures à 100 mSv (Brenner et coll., 2003

). Un cas particulier est l’exposition in utero, pour laquelle une étude anglaise de grande taille (regroupant plus de 80 % de l’information disponible) a montré une augmentation du risque de cancer de l’enfant associé aux expositions médicales in utero à partir de 10 mSv (Wakeford et Little, 2003

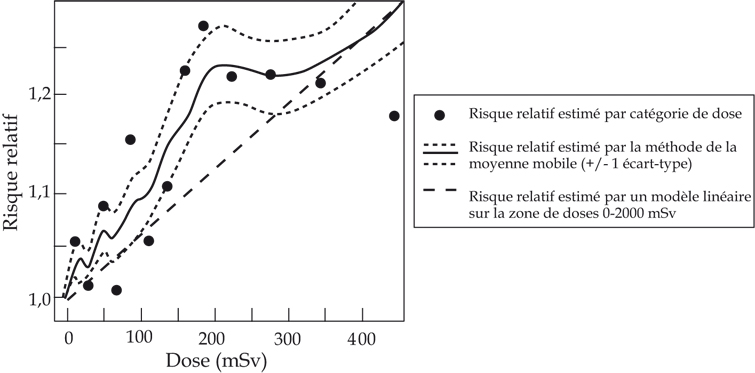
). La cohorte des survivants des bombardements de Hiroshima et Nagasaki a permis une analyse de la relation dose-réponse sur des intervalles de dose restreints (tableau 58.I

). Pour des doses inférieures à 110 mSv, la relation n’est plus significative pour l’ensemble des cancers solides, mais le risque relatif par unité de dose reste très similaire et l’analyse ne suggère pas de diminution de la relation dose-réponse aux faibles doses (Preston et coll., 2003

). Une relation similaire est observée sur des données d’incidence (figure 58.1

).
Sur la base des résultats de l’étude des survivants des bombardements de Hiroshima et Nagasaki, les modèles s’ajustant le mieux aux données sont un modèle linéaire pour les cancers solides et un modèle linéaire-quadratique pour les leucémies. Ces deux modèles présentent des variations du coefficient de risque avec l’âge au bombardement et avec l’âge atteint (Preston et coll., 1994

et 2004

).
Tableau 58.I Excès de risque relatif de mortalité par cancers solides sur des intervalles de doses restreints chez les survivants des bombardements de Hiroshima et Nagasaki (d’après Preston et coll., 2003 )
)
|
Intervalle de dose (Sv)
|
Excès de risque relatif par Sva
(écart-type)
|
Significativitéb (p)
|
|
0-0,050
|
0,93 (0,85)
|
0,15
|
|
0-0,100
|
0,64 (0,55)
|
0,30
|
|
0-0,125
|
0,74 (0,38)
|
0,025
|
|
0-0,150
|
0,56 (0,32)
|
0,045
|
|
0-0,200
|
0,76 (0,29)
|
0,003
|
|
0-0,500
|
0,44 (0,12)
|
< 0,001
|
|
0-1
|
0,47 (0,10)
|
< 0,001
|
|
0-2
|
0,54 (0,07)
|
< 0,001
|
|
0-4
|
0,47 (0,05)
|
< 0,001
|
a Excès de risque relatif par Sv estimé pour les deux sexes confondus, pour un âge à l’exposition de 30 ans et un âge atteint de 70 ans ; b Test unilatéral d’un excès de risque relatif par Sv égal à zéro
D’autres résultats récents viennent renforcer la connaissance des effets aux faibles doses. Une étude internationale de la mortalité par cancer a été effectuée sur plus de 400 000 travailleurs de l’industrie nucléaire de 15 pays. Cette étude montre une augmentation significative du risque de décès par cancers solides associée à l’exposition externe aux rayonnements durant l’activité professionnelle. Au total, environ 2 % des décès par cancer du sein de la population étudiée pourraient être attribués à ces expositions (Cardis et coll., 2005

). D’autres études conjointes récemment publiées confirment l’existence d’une association entre l’exposition au radon dans les habitations et le risque de cancer du poumon (Darby et coll., 2005

; Krewski et coll., 2005

). Ces dernières études fournissent des résultats significatifs directement sur les populations concernées, à des niveaux d’exposition faibles.
Néanmoins, malgré la cohérence de ces résultats, de nombreuses incertitudes persistent sur les effets des rayonnements ionisants aux faibles doses. La supposition d’une relation linéaire repose sur l’hypothèse d’une réponse autonome et individuelle des cellules, directement proportionnelle à la dose. Durant ces dernières décennies, plusieurs phénomènes biologiques nouveaux ont été mis en évidence, qui viendraient s’ajouter au mécanisme de cancérogenèse classiquement établi. Des exemples de relations supra-linéaires ont été montrés expérimentalement, compatibles avec des mécanismes d’interactions cellulaires aux faibles doses, tels que le « bystander effect » ou l’instabilité génomique, ou avec l’existence de sous-populations hypersensibles aux rayonnements ionisants. Des relations sub-linéaires peuvent également être supposées, sur la base de l’existence d’un seuil de dose ou de phénomènes d’hormésis reposant sur la stimulation aux faibles doses des mécanismes de réparation de l’ADN ou du système immunitaire. Ces phénomènes sont encore très mal connus, et leur impact aux faibles doses pourrait s’exercer dans un sens (relation supra-linéaire) ou dans l’autre (relation sub-linéaire) (Brenner et coll., 2003

; Brenner et Sachs, 2006

).
Deux rapports viennent d’être publiés en France (Tubiana et coll., 2005

) et aux États-Unis (NRC, 2005

), qui aboutissent à des positions opposées quant à l’extrapolation des risques aux faibles doses (Tubiana et coll., 2006

; Bren-ner et Sachs, 2006

). Le rapport des Académies de médecine et des sciences françaises souligne la faiblesse des résultats épidémiologiques aux faibles doses et l’existence de nombreux phénomènes biologiques dont l’impact aux faibles doses n’est pas quantifiable actuellement. Pour ses auteurs, les connaissances scientifiques ne permettent pas de justifier le modèle d’extrapolation linéaire aux faibles doses et les incertitudes actuelles ne permettent pas d’évaluer les risques aux faibles doses de manière fiable (Tubiana et coll., 2005

). Le rapport de l’Académie des Sciences américaine, quant à lui, s’appuie principalement sur l’analyse des résultats épidémiologiques. Il conclut qu’en l’état des connaissances actuelles, le modèle d’extrapolation linéaire aux faibles doses apparaît comme l’hypothèse la plus raisonnable et que les connaissances disponibles sur les effets d’autres phénomènes biologiques aux faibles doses ne permettent pas de remettre en cause cette conclusion (NRC, 2005

).
Transposition entre populations
Dans le domaine des rayonnements ionisants, de nombreuses études épidémiologiques ont été effectuées au sein de populations différentes. Les résultats de ces études ont permis d’établir des relations entre la dose reçue et l’effet, sous la forme de coefficients de risque par unité de dose ou de modèles de relation dose-réponse, directement sur des populations humaines. Les incertitudes associées à la transposition d’une relation dose-réponse à une autre population sont donc a priori faibles. Ainsi, l’utilisation d’une relation dose-réponse ad-hoc ne nécessite pas de transposition inter-espèce. En revanche, la détermination des coefficients de dose (permettant de passer d’une exposition à une dose à un organe donné) repose souvent sur des résultats d’expérimentation, notamment pour ce qui concerne les contaminations internes (Eckerman et Ryman, 1993

; ICRP, 1999

).
Des transpositions restent nécessaires en particulier pour des expositions spécifiques. Par exemple pour l’inhalation de radon, l’évaluation des risques a longtemps dérivé d’études sur des populations de mineurs, qui ne fournissaient pas de résultats sur les femmes ou sur l’effet des expositions durant l’enfance (NRC, 1999

). C’est pourquoi des études ont récemment été lancées également en population générale (Laurier et coll., 2001

; Darby et coll., 2005

; Alpha-Risk, 2006

).
D’autre part, les taux de base de cancer peuvent varier de façon très importante entre différentes populations (Parkin et coll., 2003

). Par exemple, la population japonaise présente des taux de cancer du sein ou du poumon nettement plus faibles que ceux de la population européenne ou américaine. La question de la transposition des coefficients de risque issus de l’étude des survivants de Hiroshima et Nagasaki s’est donc posée (Hubert, 2003

). Selon que l’on considère un modèle d’excès de risque relatif (l’excès de risque associé à l’exposition est proportionnel au taux de base) ou un modèle d’excès de risque absolu (l’excès de risque associé à l’exposition s’ajoute au taux de base dans la population considérée), les résultats pourront être très différents pour ce qui est de la projection du risque sur la vie entière et en ce qui concerne le transfert entre des populations présentant des taux de base différents. Les synthèses des connaissances effectuées par l’Unscear présentent systématiquement les deux estimateurs. L’Unscear considère aujourd’hui que l’excès de risque est relatif pour les cancers solides et absolu pour les leucémies (Unscear, 2000

). Néanmoins, des exceptions pourraient exister pour certains cancers spécifiques, par exemple le cancer du poumon (Pierce et coll., 2005

).
Analogie entre types d’expositions aux rayonnements ionisants
Différents types d’exposition aux rayonnements ionisants doivent être distingués. Dans le cas d’une exposition externe (rayonnement gamma ou X), la dose reçue par chaque organe est en lien direct avec l’énergie délivrée. La relation dose-réponse peut alors être estimée sans étape intermédiaire. En revanche, pour ce qui concerne l’exposition interne (incorporation de radionucléides par inhalation, ingestion), il est nécessaire de connaître le spectre et le devenir des radionucléides incorporés (demi-vie, biocinétique…). L’estimation de la dose implique de connaître précisément la localisation et le temps de résidence des radionucléides dans l’organisme. Ces données sont estimées à partir de modèles biocinétiques, construits le plus souvent à partir de résultats obtenus sur les animaux, qui prédisent le devenir des radionucléides après incorporation. Ces modèles sont sujets à des incertitudes qui influent sur la précision du calcul dosimétrique. Ainsi, des transpositions animal-homme peuvent donc également exister dans le domaine des rayonnements ionisants, en particulier lors de l’élaboration des coefficients de dose associés à l’incorporation de radionucléides.
L’efficacité biologique de chacun des types de rayonnements a été estimée sur la base des résultats expérimentaux et épidémiologiques disponibles (ICRP, 1991

). Dans le but d’établir des indicateurs synthétiques des effets des rayonnements ionisants utilisables en radioprotection, des facteurs de pondération des différents types de rayonnements ont été estimés. Ainsi, pour une même dose absorbée, l’efficacité biologique d’une exposition alpha est ainsi considérée 20 fois supérieure à celle d’une exposition gamma. L’utilisation des facteurs de pondération permet de considérer la dose délivrée à un organe donné exposé à différentes sources d’irradiation. Néanmoins, de nombreuses incertitudes existent sur l’efficacité biologique relative des différents types de rayonnements ionisants. Par exemple, les recherches actuelles sur les effets des expositions au radon suggèrent des facteurs de pondération très inférieurs à 20 (Marsh et coll., 2002

) ainsi que des variations importantes selon l’organe considéré. L’évaluation quantitative des risques devrait donc, lorsque cela est possible, s’appuyer sur une relation dose-réponse ad hoc (même type d’exposition et dose à l’organe pertinent pour le cancer considéré).
Il est depuis longtemps considéré que, pour une même dose cumulée, l’effet d’une exposition aiguë aux rayonnements ionisants est supérieur à celui d’une exposition chronique. Un coefficient réducteur de 2 avait été proposé par la CIPR pour l’estimation du risque de cancers solides au sein d’une population exposée à faible débit de dose (< 100 mGy/h) (ICRP, 1991

). Néanmoins, les études effectuées récemment au sein de populations exposées de façon chronique (cohorte des riverains de la rivière Tetcha en Oural (Krestinina et coll., 2005

), étude conjointe internationale des travailleurs de l’industrie nucléaire de 15 pays (Cardis et coll., 2005

), indiquent l’existence d’une relation dose-réponse, avec des excès de risque relatif par unité de dose cohérents avec ceux obtenus chez les survivants des bombardements de Hiroshima et Nagasaki. L’Académie des Sciences américaine a récemment proposé une valeur de 1,5 au lieu de 2 pour ce coefficient de réduction des effets aux faibles doses et débits de dose (NRC, 2005

).
Facteurs modifiants de la relation dose-réponse
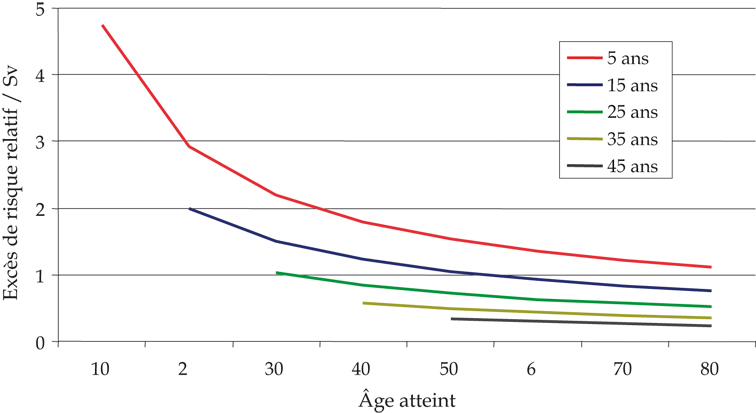
De plus en plus de résultats épidémiologiques confirment l’importance des facteurs modificateurs de la relation entre la dose et le risque de cancer, tels que l’âge à l’exposition, le délai depuis l’exposition ou le débit de dose. Les récentes analyses de la mortalité de la cohorte des survivants des bombardements de Hiroshima et de Nagasaki ont confirmé une diminution du coefficient de risque par Sv avec l’âge à l’exposition, mais également une diminution du risque relatif par Sv avec l’âge atteint (Preston et coll., 2003

) (figure 58.2

).
Un tel effet avait déjà été mis en évidence pour le risque de leucémie radio-induit chez les survivants des bombardements de Hiroshima et Nagasaki (Preston et coll., 1994

) ou chez les enfants traités par radiothérapie (de Vathaire et coll., 1995

). Une forte diminution du risque de cancer du poumon avec le délai depuis l’exposition apparaît également chez les mineurs d’uranium (NRC, 1999

; Tirmarche et coll., 2003

).
La prise en compte de ces facteurs modifiants dans les modèles est importante dans l’évaluation des risques de cancers aux faibles doses de rayonnements ionisants. Les modèles correspondants permettent un meilleur ajustement des coefficients de risque aux caractéristiques des individus de la population considérée. De plus, ces modèles permettent de considérer l’historique de l’exposition des individus, et pas seulement leur exposition cumulée à un moment donné.
Prise en compte de l’hétérogénéité des niveaux d’exposition
Les évaluations quantitatives des risques fournissent en général une estimation du nombre global de cas attribuables à une exposition donnée. Dans le domaine des rayonnements ionisants, les expositions individuelles peuvent être très variables au sein d’une même population. De plus, comme indiqué précédemment, l’incertitude liée aux extrapolations augmente aux très faibles doses. Il est donc important, lorsque cela est possible, de segmenter la population en différents niveaux de dose et d’effectuer une évaluation de risque pour chacune de ces sous-populations (IPSN, 2002

). Ceci devient encore plus pertinent lorsqu’une partie de l’exposition est d’origine naturelle. Il est alors important pour faciliter l’interprétation des résultats de segmenter les expositions et d’identifier la part du risque attribuable aux expositions qu’il est possible de réduire. Ceci est par exemple le cas dans l’évaluation du risque de cancer du poumon attribuable à l’exposition domestique au radon (Pirard et Hubert, 2001

; Catelinois et coll., 2006

).
Dioxines
Pour mémoire, la modélisation des données de cancérogenèse animale in vivo pour la 2,3,7,8-TCDD (dioxine de Seveso ou TCDD) est présentée en détail dans l’expertise collective Inserm sur les dioxines (Inserm, 2000

). Dans la mesure où il n’y a pas eu de développement significatif depuis cette publication, le lecteur est invité à s’y reporter.
Pour l’accident de Seveso (1976), les dosages sériques effectués sur les populations étudiées étaient jusque récemment limités en nombre (482 dosages pour 45 369 sujets des trois zones d’exposition, 52 dosages pour 118 775 sujets de la zone de référence) (Bertazzi et coll., 2001

). Des dosages sanguins ont toutefois été faits entre 1996 et 1998 sur des échantillons recueillis en 1976 chez les 981 femmes étudiées dans la cohorte « Seveso Women Health Study » (SWHS) (Warner et coll., 2002

) mais les résultats disponibles portent uniquement sur le cancer du sein et la modélisation de la relation dose-réponse est à ce stade préliminaire. Quoi qu’il en soit, l’exposition pondérée moyenne dans les deux zones les plus exposées à Seveso est 25 fois moindre que dans les cohortes américaines et allemandes de la méta-analyse de Starr (2001

) (voir paragraphe « Approche sans seuil : résultats »).
Les données de suivi de la cohorte « Ranch hand » de soldats de l’armée américaine ayant manipulé des phénoxy-herbicides contaminés par des dioxines lors de la guerre du Vietnam n’ont pas été modélisées pour la relation dose-réponse, car ne montrant pas d’excès de risque de cancer pour des localisations multiples (Akhtar et coll., 2004

).
Seules les études qui ont été conduites en milieu professionnel sur la mortalité par cause des travailleurs de l’industrie chimique ont donné lieu à des modélisations de la relation dose-réponse, rendues possibles par la qualité des données d’exposition disponibles : dosages sériques de TCDD pour des effectifs conséquents, associés à un travail solide de reconstruction des expositions par élaboration d’une matrice emploi-exposition. Au final, il est possible d’estimer une exposition et une dose cumulée pour chacun des sujets de ces cohortes.
On considère ici la TCDD et les TEQ (unité de toxicité relative pour les composés similaires à la dioxine, définie comme la quantité de TCDD qui produirait la même toxicité que le mélange de ces composés ; le principe de calcul est détaillé dans le chapitre sur les expositions du présent ouvrage). Les questions soulevées par l’approche TEQ sont discutées plus loin.
Extrapolation aux faibles doses
Deux approches sont utilisées pour estimer les risques de cancer liés à de faibles doses de dioxines. Pour l’US-EPA (United States Environmental Protection Agency) et dans les publications des épidémiologistes présentées ci-dessous, les données observées sont compatibles avec une absence de seuil d’effet et toute dose de dioxine est responsable d’un excès de risque. Dans l’approche toxicologique, retenue notamment par l’OMS, ce sont les considérations mécanistiques qui priment et il est admis sur cette base qu’il y a un seuil de dose en deçà duquel il n’y a pas de risque cancérogène. La logique scientifique des deux approches est fondamentalement différente, mais rien ne permet de démontrer que l’une est plus valide que l’autre (Bard, 2006

).
Relation dose-réponse sans seuil : la méthode de l’US-EPA
Dans la méthode employée par l’US-EPA (United States Environmental Protection Agency, 2003

) ainsi que dans les méta-analyses de Starr (Starr, 2001

) et de Crump et collaborateurs (Crump et coll., 2003

), les données du domaine observable sont modélisées. Après test d’adéquation du modèle, les estimations centrales et des intervalles de confiance à 95 % sont extrapolées jusqu’à un niveau de dose correspondant à un excès de risque spécifié (voir figure 58.3

). Ce dernier, appelé point de départ (PDD ici ; Point of departure ou POD) doit se situer près de la limite du domaine observable et dépend donc de la puissance de l’étude. Celle-ci peut autoriser par exemple un PDD à 1 % (Dose effective 1 % ou DE01), 5 % (Dose effective 5 % ou DE05) ou autre. On peut partir de l’estimation centrale ou de la limite supérieure de l’intervalle de confiance à 95 % pour le risque et dans ce cas retenir la limite inférieure de l’intervalle de confiance à 95 % pour la dose effective (LIDExx), qui est en général le PDD retenu. Des tests statistiques peuvent être conduits sur le comportement du ratio (DExx/LIDExx) entre estimation centrale et limite inférieure de l’intervalle de confiance à 95 % pour la dose effective afin d’évaluer jusqu’à quel point les données disponibles justifient les estimations du modèle pour un niveau de réponse donné.
Si l’on retient le principe d’une relation dose-réponse sans seuil (cancérogènes mutagènes ou génotoxiques), la dose repère retenue est extrapolée linéairement à l’ordonnée à l’origine, sauf si les données disponibles et les résultats de la modélisation justifient l’usage d’un modèle différent. Dans le cas d’une extrapolation linéaire à partir du PDD, la pente est alors 0,10/LED10 si le PDD choisi est la LIDE10. Le RRDE10 (risque relatif pour une dose égale à DE10) est estimé par :
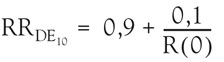
où R(0) est le risque de base. Le risque absolu est obtenu en multipliant le risque relatif par R(0). Les difficultés méthodologiques spécifiques aux données continues sont discutées dans le rapport de l’US-EPA (US-EPA, 2003

). À l’équilibre (steady-state conditions), on peut calculer la charge corporelle à partir de l’exposition et vice-versa en utilisant l’équation :
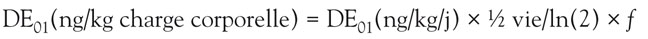
où f est la biodisponibilité (posée à 50 % pour la TCDD présente dans l’alimentation et 100 % pour les autres voies d’exposition).
Approche sans seuil : résultats
La méta-analyse de Starr (2001

) a été effectuée sur trois cohortes de travailleurs de l’industrie chimique, deux en Allemagne, une aux États-Unis, en se basant sur les données de l’étude originelle de cette dernière (Fingerhut et coll., 1991

). La dosimétrie utilisée était la charge corporelle moyenne en concentration dans les lipides. À travers une estimation du taux standardisé de mortalité (SMR), il conclut que les données de ces trois études groupées montrent un risque accru de décès par cancer pour une exposition au niveau du bruit de fond. Ces données sont compatibles, sur la base d’un test d’adéquation, avec une absence d’effet cancérogène de l’exposition à la TCDD dans ces cohortes.
Crump et collaborateurs (2003

) ont conduit une méta-analyse des données des trois cohortes déjà citées. Les données utilisées sont présentées au tableau 58.II

. Il est important de noter que les données de la cohorte NIOSH (National Institute for Occupational Safety and Health) ne sont pas, contrairement à l’analyse de Starr, celles dont fait état la publication originelle (Fingerhut et coll., 1991

) mais comportent des données d’exposition plus élaborées et un suivi allongé de six ans, apportant donc a priori une puissance améliorée (Starr, 2001

; Steenland et coll., 2001

; Steenland et Deddens, 2003

). La modélisation de la relation dose-réponse repose sur l’hypothèse que le SMR est fonction linéaire de la concentration lipidique sérique cumulative (CSLC) (unité : ppt/an), ajustée sur le bruit de fond (en TEQ). Des tests de non-linéarité potentielle de la relation dose-réponse ont été conduits, qui ne remettent pas en question l’hypothèse de linéarité. Les doses effectives 10, 05, 01 ont été calculées sur la base d’une dose quotidienne moyenne sur la vie entière. Pour ce faire, le temps de latence a été fixé à 15 ans, la ½ vie à 7,6 ans, la biodisponibilité à 50 % et les auteurs considèrent que les lipides représentent 25 % de la masse corporelle.
Tableau 58.II Données dose-réponse pour les trois études de cohorte de travailleurs de l’industrie chimique exposés aux dioxines (d’après Crump et coll., 2003 )
)
|
Concentration lipidique de TCDD ou TEQ cumulée dans les graisses (ppt-années)
|
Décès par cancer, tous sites
|
|
Observés
|
Attendus
|
SMR
|
Étude de Flesch-Janys et coll., 1998
| | | |
|
180
|
25
|
23,3
|
107
|
|
988
|
34
|
20,8
|
164
|
|
3 416
|
31
|
23,3
|
133
|
|
10 425
|
34
|
20,8
|
164
|
Étude de Ott et Zober, 1996
| | | |
|
605
|
8
|
10,0
|
80
|
|
19 614
|
8
|
6,7
|
120
|
|
55 645
|
8
|
5,7
|
140
|
|
150 454
|
7
|
3,5
|
200
|
Étude de Steenland et coll., 2001 et 2003
| | | |
|
260
|
67
|
68,4
|
98
|
|
402
|
27
|
30
|
90
|
|
853
|
31
|
27,2
|
114
|
|
1 895
|
30
|
25.4
|
118
|
|
4 420
|
34
|
25,6
|
133
|
|
12 125
|
33
|
19,5
|
169
|
|
59 838
|
34
|
22,1
|
154
|
Les résultats sont présentés sur la figure 58.4

.
Les auteurs ont testé diverses possibilités d’estimation du SMR au niveau de référence, fixé à 100 ou variable. Ce dernier choix permet un meilleur ajustement aux données. De fait, le SMR modélisé au niveau d’exposition de référence apparaît clairement supérieur à 100 sur la figure 58.4

.
Des tests de tendance ont permis de déterminer :
• la dose la plus faible pour laquelle il y a une tendance de SMR significative sur les données de cette dose et toutes les doses en deçà ;
• la dose la plus forte sans tendance significative sur les données de cette dose et toutes en deçà.
Les tests de tendance sont compatibles avec la linéarité de la relation dose-réponse à partir d’une exposition quotidienne à 7 pg TEQ/kg/j sur une vie entière, mais pas en dessous. Les diverses valeurs de DE01 produits par les différents auteurs apparaissent au tableau 58.III

.
Tableau 58.III Relations dose-réponse ajustées sur l’exposition de fond (Crump et coll., 2003 )
)
|
Référence
Modèle
|
SMR/bruit de fond
|
Dose, pg/kg/j
|
Charge corporelle à l’équilibre, ppt
|
Test d’adéquation
|
| | |
DE01
|
LIDE01
|
DE01
|
LIDE01
|
P
|
Becher et coll., 1998  Linéaire |
Effectivement estimé
|
4,5
|
NR
|
9,1
|
NR
|
NRa
|
US-EPA, 2003 
Linéaire
|
Fixé (= 100)
|
23
|
15
|
47
|
30
|
NR
|
Starr, 2001 
Linéaire
|
Fixé (= 100)
|
24
|
14
|
47
|
28
|
0,003
|
| |
Estimé
|
72
|
24
|
145
|
49
|
0,31
|
Steenland et coll., 2001 
Linéaire par intervalles
|
Effectivement estimé
|
7,7
|
5,0
|
15
|
10
|
NR
|
|
Méta-analyse
|
Fixé (= 100)
|
25
|
16
|
51
|
33
|
0,08
|
|
Linéaire
|
Estimé
|
45
|
23
|
91
|
47
|
0,29
|
a NR : non rapporté ; DE01 : dose effective 1 % ; LIDE01 : limite inférieure de l’intervalle de confiance à 95 % pour la dose effective
Dans l’analyse de l’US-EPA (2003

), les données des mêmes cohortes ont fait l’objet d’une modélisation du risque de cancer vie entière limitée à 75 ans pour une exposition correspondant à une élévation de 1 pg de la charge corporelle par rapport à celle résultant de l’exposition au bruit de fond.
Les données des trois cohortes ont été ramenées à une dosimétrie commune, toutes les estimations de risque ont été calculées en utilisant les mêmes méthodes que les auteurs originaux, en particulier les mêmes temps de latence et en soustrayant des données de mortalité le risque lié à l’exposition au bruit de fond. Les résultats sont présentés au tableau 58.IV

.
Toutes les estimations LIDE
01 de l’US-EPA se situent selon les études entre 6 et 51 ng en charge corporelle/kg, très comparables avec celles de la méta-analyse de Crump et coll. (2003

) ; les hypothèses de calcul sont similaires : masse grasse corporelle 25 % ; 80 % de la dose de TCDD est absorbée à partir de l’alimentation humaine « standard » ; la ½ vie de la TCDD chez l’homme est posée à 7,1 ans.
Les pentes de la relation dose-réponse (slope factors) se situent entre 0,57 × 10
–3 et 5,1 × 10
–3 (tableau 58.IV

), comparables à celle de la méta-analyse de Crump et coll. (2003

), estimée à 0,37 × 10
–3 (avec un SMR variable).
Tableau 58.IV Modélisation par l’US-EPA du risque de cancer tous sites, chez les hommes (d’après US-EPA, 2003 )
)
|
Référence
Étude, modèle
|
DE01 (LIDE01) ng/kg
|
Pentea,b pour une exposition de 1 pg/kg/j (IC 95 % sup)
|
Becher et coll., 1998 
Cohorte de Hambourg, loi de puissance
|
6
|
5,1.10–3
|
Becher et coll., 1998 
Cohorte de Hambourg, additif
|
18,2
|
1,6.10–3
|
Becher et coll., 1998 
Cohorte de Hambourg, multiplicatif
|
32,2
|
0,89.10–3
|
Steenland et coll., 2001 
Cohorte NIOSH, linéaire par intervallesc
|
18,6 (11,5)
|
1,5.10–3 (2,5.10–3)
|
Ott et Zober, 1996 
Cohorte BASF, multiplicatif
|
50,9 (25,0)
|
0,57.10–3 (1,2.10–3)
|
a Pente : risque de cancer tous sites pour une exposition quotidienne de 1 pg/kg de poids corporel/jour en plus de l’exposition en bruit de fond, posée à 5 pg/g de matière grasse ; IC 95 % sup : limite supérieure de l’intervalle de confiance à 95 %
b Paramètres : masse grasse corporelle 25 % ; 80 % de la dose de TCDD est absorbée à partir de l’alimentation humaine « standard » ; la ½ vie de la TCDD chez l’homme est posée à 7,1 ans ; mortalité par taux de référence calculée jusqu’à 75 ans par tables de survie ; les résultats présentés ne portent que sur les sujets masculins, car leur risque de cancer jusqu’à 75 ans est plus élevé que celui des femmes, conduisant à une pente plus prononcée.
c Les résultats de la modélisation par loi de puissance de Steenland et coll. (2001 ) ne sont pas présentés ici car les risques attribués par ce modèle aux niveaux du bruit de fond dans la population sont déraisonnablement élevés.
) ne sont pas présentés ici car les risques attribués par ce modèle aux niveaux du bruit de fond dans la population sont déraisonnablement élevés.
Les différences entre les estimations reflètent les choix opérés pour la modélisation, notamment le modèle retenu, le temps de latence choisi, le type de modèle dosimétrique (moyenne des concentrations sériques, aire sous la courbe ou concentration cumulative lipidique moyenne) et surtout le choix de la durée de ½ vie. En outre, le choix de modéliser les effets de la seule TCDD ou de raisonner en TEQ peut avoir un impact non négligeable sur les estimations (Starr, 2003

).
En bref, l’analyse des relations dose-réponse obtenues à partir des données de suivi des cohortes de travailleurs exposés montre que sous diverses hypothèses de modélisation, par exemple le temps de latence (comme dans le cas des études de cohortes pour les rayonnements ionisants), la relation dose-réponse est selon l’US-EPA compatible avec une relation linéaire sans seuil, retrouvée avec une pente très voisine à partir des données animales (US-EPA, 2003

). Cet organisme conclut in fine que « la valeur de 1 × 10
–3 par pg TEQ/kg de poids corporel par jour apparaît comme un estimateur de la limite supérieure de la pente de la relation dose-réponse pour le risque de cancer tous sites, à la fois pour l’exposition au niveau de bruit de fond et pour celles survenant au-delà » (US-EPA, 2003

). Il considère en outre que la TCDD est un cancérogène pour l’Homme et que les autres congénères sont vraisemblablement cancérogènes, individuellement et en mélange.
Analogie et transposition
Question dosimétrique et réanalyse de la cohorte NIOSH
Des publications récentes (Geusau et coll., 2002

; Michalek et coll., 2002

; Aylward et coll., 2005

) montrent que l’usage du modèle d’élimination de premier ordre de la TCDD, c’est-à-dire une ½ vie constante (par exemple de 7 ou de 9 ans) quelle que soit la dose ou la charge corporelle sous-estime largement la dose reçue par des individus très exposés, avec une ½ vie effective inférieure à 3 ans lorsque les niveaux sériques lipidiques sont supérieurs à 1 000 ppt. En d’autres termes, les niveaux d’exposition reconstruits chez les sujets les plus exposés des cohortes sont largement sous-estimés dans les études de cohortes de travailleurs de l’industrie chimique. De plus, Aylward et coll. (2005

) ont montré, à la suite de dosages répétés chez des sujets de Seveso, que la vitesse d’élimination décroissait avec l’âge, ce qui contribue aussi à une sous-estimation des doses reçues. Une telle sous-estimation implique que les estimations de risque correspondantes sont surestimées.
Cheng et collaborateurs (2006

) ont reproduit les analyses de Steenland et collaborateurs (Fingerhut et coll., 1991

; Steenland et coll., 2001

; Steenland et Deddens, 2003

) avec des résultats très proches de ceux produits par ces derniers. Ils ont ensuite appliqué un nouveau modèle dosimétrique (modèle CADM pour modèle d’élimination concentration- et âge-dépendant) tenant compte de ces résultats à l’analyse des données individuelles de la cohorte du NIOSH (Fingerhut et coll., 1991

; Steenland et coll., 2001

; Steenland et Deddens, 2003

). Ce modèle dosimétrique a une meilleure adéquation avec les données observées. Les auteurs ont calculé les SMR et appliqué à ces données des temps de latence variables (0, 10 et 15 ans) dans des modèles de Cox dont l’un se basait sur des fonctions splines pénalisées des résultats dosimétriques CADM. Ils ont privilégié les valeurs des doses les moins élevées en excluant dans des analyses de sensibilité les valeurs extrêmes, considérées comme plus sujettes aux erreurs de classement, s’appuyant sur la publication de Stayner et coll. (2003

). Les estimations de doses issues de la dosimétrie CADM sont plus élevées que celles de Steenland et coll. (Steenland et coll., 2001

; Steenland et Deddens, 2003

). L’association entre l’exposition à la TCDD et la mortalité par cancer tous sites était absente ou faible en l’absence de prise en compte d’un temps de latence ou sur des données non transformées ou sur l’ensemble des données disponibles. L’usage du CADM aboutit à des estimations de risque inférieures d’un facteur 6 à un facteur 10 à celles de l’US-EPA (2003

) et le risque de décès par cancer tous sites pour une exposition vie entière au niveau du bruit de fond est dans ces conditions inférieur à 10
–4. Malgré cette réévaluation à la baisse qui répond à celle des doses (à la hausse), les estimations de risque varient sur plus de deux ordres de grandeur, en fonction des modèles utilisés et des différents éléments de calcul.
Prise en compte des congénères autres que la TCDD
Les populations humaines sont exposées quotidiennement à l’ensemble des congénères de la TCDD, ce qui justifie le principe du calcul des équivalences de toxicité (TEQ). Or, la seule cohorte où le risque a été estimé en fonction de l’ensemble des congénères de la dioxine (calcul des TEQ) est celle de Hambourg (Flesch-Janys et coll., 1998

). Les résultats ne montrent pas de tendance significative pour l’excès de mortalité par cancer tous sites ou pour des sites spécifiques lorsque la dose cumulée estimée est calculée en TEQ : les SMR étaient, pour des concentrations cumulées croissantes en TEQ dans les lipides de 107, 164, 133, et 164 (p = 0,48). Le fait que les toxicités relatives des congénères ne soient pas nécessairement les mêmes en termes systémiques et pour les effets des expositions peut pour une part expliquer ces résultats.
La validité des facteurs d’équivalence de toxicité (TEF) pour l’évaluation du risque cancérogène chez l’humain est sujette à controverses (Vidy et Bard, 2003

). Pour résumer, ils sont essentiellement estimés à partir de données expérimentales à court terme, et l’inclusion des PCB « dioxin-like » pour ce risque reste problématique dans la mesure où il existe peu de données de cancérogenèse expérimentale pour ces composés. Une récente étude de cancérogenèse in vivo a cependant montré que les TEF d’un mélange de TCDD, de 2,3,4,7,8-PeCDF et de PCB 126 prédisaient de façon adéquate l’incidence accrue de tumeurs hépatiques induite par le mélange, apportant par là également un certain soutien en faveur de l’additivité des effets des différents congénères (Walker et coll., 2005

).
Par ailleurs, la valeur des TEF fait l’objet de réexamens périodiques. Ainsi, les TEF proposés par l’OMS en 1998 (Van den Berg et coll., 1998

) ont évolué en 2005 (Van den Berg et coll., 2006

; voir la partie « Exposition » du présent ouvrage). Leur usage semble conduire à une diminution aux alentours de 30 % des doses estimées. Il en résulte que le risque à dose donnée exprimée en TEQ est accru par rapport aux estimations précédentes.
Approche de l’OMS : relation dose-réponse à seuil
L’approche mécanistique de l’OMS (van Leeuwen et coll., 2000

; Van den Berg, 2005

) repose sur l’indiscutable caractère promoteur de la cancérogenèse de la dioxine, et sur son absence de mutagénicité démontrée (Inserm, 2000

). Les experts de l’OMS considèrent en conséquence qu’il convient de raisonner selon le modèle de cancérogenèse généralement admis, c’est-à-dire qu’un promoteur est un agent à seuil (Voir la partie « Mécanismes de toxicité » du présent ouvrage et l’expertise préalable Inserm, 2005

). Dans ce cas, « les niveaux d’exposition du public en Europe sont tels que le risque de développer un cancer du fait de l’exposition à la dioxine est nul » au regard de la valeur de référence, dérivée du seuil observé chez l’animal et assorti d’une marge de sécurité. La logique du raisonnement est ainsi de considérer que le modèle de cancérogenèse rend parfaitement compte de la réalité des faits.
En conclusion, il faut garder à l’esprit qu’un modèle de quantification des effets cancérogènes à très faibles doses (et la valeur numérique du risque unitaire qui en découle) sort du domaine purement scientifique, bien que fondé sur des éléments qui le sont mais qui ne peuvent pas faire preuve indiscutable. Il y a en effet jugement et prise de position par les experts évaluateurs.
Les éléments développés plus haut indiquent que l’on peut s’appuyer ou bien sur des considérations mécanistiques (position des Académies de médecine et des sciences françaises pour les rayonnements ionisants ou de l’OMS pour les dioxines) dont on ne peut démontrer qu’elles s’appliquent à l’évaluation du risque de cancer chez l’homme, ou bien privilégier l’observation, épidémiologique au premier chef et procéder à une démarche d’extrapolation qui fait intervenir à son tour des choix subjectifs. La position adoptée constitue un choix des évaluateurs impliqués.
Dans tous les cas de figure, la présentation de résultats d’évaluation quantitative des risques aux faibles doses doit être assortie des réserves nécessaires, de la description claire des hypothèses et choix retenus ainsi que de la mention de la possibilité de choix alternatifs. Il est important que ces éléments ne puissent être dissociés des résultats eux-mêmes lors de leur diffusion. De plus, il est impératif de fournir des éléments de contexte et de comparaison permettant de faciliter l’interprétation des résultats d’une évaluation quantitative des risques (rappels des connaissances scientifiques acquises, risque de base au sein de la population, risque associé aux autres sources d’exposition, segmentation des résultats en différents niveaux d’exposition, illustration des incertitudes…).
Bibliographie
[1] akhtar fz,
garabrant dh,
ketchum ns,
michalek je. Cancer in US Air Force veterans of the Vietnam War.
J Occup Environ Med. 2004;
46:123
-136

[2]alpha-risk. Risks related to internal and external exposures.
In : Euratom Research Projects and Training Activities (Volume I). ISBN 92-79-00064-0. EUR 21229. Catalogue KI-NA-21229-EN-C. 2006;

[3] aylward ll,
brunet rc,
carrier g,
hays sm,
cushing ca, et coll.. Concentration-dependent TCDD elimination kinetics in humans : toxicokinetic modeling for moderately to highly exposed adults from Seveso, Italy, and Vienna, Austria, and impact on dose estimates for the NIOSH cohort.
J Expo Anal Environ Epidemiol. 2005;
15:51
-65

[4] bard d. Les effets des faibles doses : un débat épistémologique et ses conséquences décisionnelles.
Environnement Risques Santé. 2006;
5:65
-66

[5] becher h,
steindorf k,
flesch-janys d. Quantitative cancer risk assessment for dioxins using an occupational cohort.
Environ Health Perspect. 1998;
106:663
-670

[6] bertazzi pa,
consonni d,
bachetti s,
rubagotti m,
baccarelli a, et coll.. Health effects of dioxin exposure : a 20-year mortality study.
Am J Epidemiol. 2001;
153:1031
-1044

[7] brenner dj,
sachs rk. Estimating radiation-induced risks at very low doses : rationale for using a linear no-threshold approach.
Rad Environ Biophys. 2006;
44:253
-256

[8] brenner dj,
doll r,
goodhead dt,
hall ej,
land ce, et coll.. Cancer risks attributable to low doses of ionizing radiation : assessing what we really know.
Proc Natl Acad Sci. 2003;
100:13761
-13766

[9] cardis e,
vrijheid m,
blettner m,
gilbert e,
hakama m, et coll.. Risk of cancer after low doses of ionising radiation : retrospective cohort study in 15 countries.
BMJ. 2005;
331:77

[10] catelinois o,
rogel a,
laurier d,
billon s,
hémon d, et coll.. Lung cancer attributable to indoor radon exposure in France : impact of the risk model and uncertainty analysis.
Environ Health Perspect. 2006;
114:1361
-1366

[11] cheng h,
aylward l,
beall c,
starr tb,
brunet rc, et coll.. TCDD exposure-response analysis and risk assessment.
Risk Anal. 2006;
26:1059
-1071

[12] crump ks,
canady r,
kogevinas m. Meta-analysis of dioxin cancer dose response for three occupational cohorts.
Environ Health Perspect. 2003;
111:681
-687

[13] darby s,
hill d,
auvinen a,
barros-dios jm,
baysson h, et coll.. Radon in homes and risk of lung cancer : collaborative analysis of individual data from 13 European case-control studies.
BMJ. 2005;
330:223
-226

[14] de vathaire f. Données épidémiologiques sur les effets cancérogènes des faibles doses de rayonnements ionisants.
Environnement Risques Santé. 2005;
4:283
-293

[15] de vathaire f,
shamsaldin a,
grimaud e,
campbell s,
guerra m, et coll.. Solid malignant neoplasms after childhood irradiation : decrease of the relative risk with time after irradiation.
Comptes Rendus de l’Académie des Sciences de Paris. 1995;
318:483490

[16] eckerman kf,
ryman jc. External exposures to radionuclides in air, water and soil. Federal Guidance Report 12 (EPA Report 402-R-93-081).
Washington, DC:Environmental Protection Agency. 1993;

[17] fingerhut ma,
halperin we,
marlow da,
piacitelli la,
honchar pa, et coll.. Cancer mortality in workers exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin.
N Engl J Med. 1991;
324:212
-218

[18] flesch-janys d,
steindorf k,
gurn p,
becher h. Estimation of the cumulated exposure to polychlorinated dibenzo-p-dioxins/furans and standardized mortality ratio analysis of cancer mortality by dose in an occupationally exposed cohort.
Environ Health Perspect. 1998;
106:655
-662

[19] geusau a,
schmaldienst s,
derfler k,
papke o,
abraham k. Severe 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) intoxication : kinetics and trials to enhance elimination in two patients.
Arch Toxicol. 2002;
76:316
-325

[20] gourmelon p,
barescut jc,
luccioni c,
paquet f,
rollinger f, et coll.. Les conséquences sanitaires des contaminations internes chroniques par des radio-nucléides. Avis sur le rapport CERI Études des effets sanitaires de l’exposition aux faibles doses de radiations ionisantes à des fins de radioprotection et recommandations de l’IRSN.
Institut de Radioprotection et de Sûreté Nucléaire, Rapport DRPH n° 2005-20. IRSN. Fontenay aux Roses:2005;

[21] hubert p. Pour un meilleur usage du risque attribuable en santé environnementale.
Environnement Risques Santé. 2003;
2:266
-278

[22]inserm. Dioxines dans l’environnement : quels risques pour la santé ?.
Collection Expertise collective. Éditions Inserm;
Paris:2000;

[23]inserm. Cancer : approche méthodologique du lien avec l’environnement.
Collection Expertise collective. Éditions Inserm;
Paris:2005;

[24]institut de protection et de sûreté nucléaire (ipsn). Dose collective, indications et contre-indications. IPSN.
Fontenay aux Roses: Collection IPSN. EDP Sciences;
2002;

[25]international commission for radiation protection (icrp). The ICRP Database of Dose Coefficients: Workers and Members of the Public.
Elsevier;
Amsterdam:1999;

[26]international commission for radiation protection (icrp). Low-dose extrapolation of radiation-related cancer risk. Annals of the ICRP, Publication 99.
In: valentin j, editors.
Elsevier;
Amsterdam:2006;

[27]international commission of radiological protection (icrp). Recommendations of the International Commission on Radiological Protection.
Annals of the ICRP, Publication 60. Pergamon Press;
1991;

[28] krestinina ly,
preston dl,
ostroumova ev,
degteva mo,
ron e, et coll.. Protracted radiation exposure and cancer mortality in the Techa River Cohort.
Radiat Res. 2005;
164:602
-611

[29] krewski d,
lubin jh,
zielinski jm,
alavanja m,
catalan vs, et coll.. Residential radon and risk of lung cancer: a combined analysis of 7 North American case-control studies.
Epidemiology. 2005;
16:137
-145

[30] laurier d,
valenty m,
tirmarche m. Radon exposure and the risk of leukemia : a review of epidemiological studies.
Health Phys. 2001;
81:272
-288

[31] marsh j,
birchall a,
butterweck g,
dorrian md,
huet c, et coll.. Uncertainty analysis of the weighted equivalent lung dose per unit exposure to radon progeny in the home.
Radiat Prot Dosim. 2002;
102:229
-248

[32] michalek je,
pirkle jl,
needham ll,
patterson dg,
caudill jr sp, et coll.. Pharmacokinetics of 2,3,7,8-tetrachlorodibenzo-p-dioxin in Seveso adults and veterans of operation Ranch Hand.
J Expo Anal Environ Epidemiol. 2002;
12:44
-53

[33]national research council (nrc). Committee on Health Risks of Exposure to Radon. Board on Radiation Effects Research. Health effects of exposure to radon.
National Academy Press;
Washington, DC: USA.
BEIR VI report. 1999;

[34]national research council (nrc). Board on Radiation Effects Research. Health risks from exposure to low levels of ionizing radiation.
BEIR, VII Report, phase II. National Academy of Science. Washington, DC:2005;

[35] ott mg,
zober a. Cause specific mortality and cancer incidence among employees exposed to 2,3,7,8-TCDD after a 1953 reactor accident.
Occup Environ Med. 1996;
53:606
-612

[36] parkin dm,
whelan sl,
ferlay j,
teppo l,
thomas db. Cancer Incidence in Five Continents. Vol. VIII.
Lyon:International Agency for Research on Cancer, IARC Scientific Publication. 2003;
155p.

[37] pierce da,
sharp gb,
mabuchi k. Joint effects of radiation and smoking on lung cancer risk among atomic bomb survivors.
Radiat Res. 2005;
163:694
-695

[38] pirard ph,
hubert ph. Le radon en Bretagne : évaluation de l’exposition et du risque associé.
Institut de Radioprotection et de Sûreté Nucléaire. Note technique DPHD/SEGR/00-79 – indice 1. 2001;

[39] preston dl,
kusumi s,
tomonaga m,
izumi s,
ron e, et coll.. Cancer incidence in atomic bomb survivors. Part III. Leukemia, lymphoma and multiple myeloma, 1950-1987.
Radiat Res. 1994;
137:S68
-S97

[40] preston dl,
shimizu y,
pierce da,
suyama a,
mabuchi k. Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950-1997.
Radiat Res. 2003;
160:381
-407

[41] preston dl,
pierce da,
shimizu y,
cullings hm,
fujita s, et coll.. Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates.
Radiat Res. 2004;
162:377
-389

[42] starr tb. Significant shortcomings of the US Environmental Protection Agency’s latest draft risk characterization for dioxin-like compounds.
Toxicol Sci. 2001;
64:7
-13

[43] starr tb. Significant issues raised by meta-analyses of cancer mortality and dioxin exposure.
Environ Health Perspect. 2003;
111:1443
-1447

[44] stayner l,
steenland k,
dosemeci m,
hertz-picciotto i. Attenuation of exposure-response curves in occupational cohort studies at high exposure levels.
Scand J Work Environ Health. 2003;
29:317
-324

[45] steenland k,
deddens j. Dioxin: exposure-response analyses and risk assessment.
Ind Health. 2003;
41:175
-180

[46] steenland k,
deddens j,
piacitelli l. Risk assessment for 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) based on an epidemiologic study.
Am J Epidemiol. 2001;
154:451
-458

[47] tirmarche m,
laurier d,
bergot d,
billon s,
brueske-hohlfeld i, et coll.. Quantification of lung cancer risk after low radon exposure and low exposure rate : synthesis from epidemiological and experimental data.
Final scientific report, February 2000-July 2003. Contract FIGH-CT1999-00013, European Commission DG XII. Brussels: Belgium.
October 2003;

[48] tubiana m,
aurengo a,
averbeck d,
bonnin d,
leguen b, et coll.. Dose effect relationship and the estimation of the carcinogenic effects of low doses of ionising radiation.
Académie Nationale de Médecine, Institut de France-Académie des Sciences. Joint Report n° 2. Edition Nucléon;
Paris:2005;

[49] tubiana m,
aurengo a,
averbeck d,
masse r. Recent reports on the effects of low doses of ionising radiation and its dose-effect relationship.
Rad Environ Biophys. 2006;
44:245
-251

[50]united nations scientific committee on the effects of atomic radiation (unscear). Sources and effects of ionizing radiation - Volume II, Effects.
United Nations.
New York:2000;

[51]united states environmental protection agency (us-epa). Exposure and Human Health Reassessment of 2,3,7,8-Tetrachlorodibenzo-p-Dioxin (TCDD) and Related Compounds. Part III : Integrated Summary and Risk Characterization for 2,3,7,8-Tetrachlorodibenzo-p-Dioxin (TCDD) and Related Compounds.
NAS Review Draft. National Center for Environmental Assessment, Research and Development. Washington, DC:2003;

[52] van den berg m. What happens nowadays with the dose-effect relationship beyond the scientific community?.
Dioxin 2005-ISPAC 20. Toronto: Canada.
2005;

[53] van den berg m,
birnbaum l,
bosveld atc,
brunstrom b,
cook p, et coll.. Toxic Equivalency Factors (TEFs) for PCBs, PCDDs, PCDFs for humans and wildlife.
Environ Health Perspect. 1998;
106:775
-792

[54] van den berg m,
birnbaum ls,
denison m,
de vito m,
farland w, et coll.. The 2005 World Health Organization reevaluation of human and mammalian toxic equivalency factors for dioxins and dioxin-like compounds.
Toxicol Sci. 2006;
93:223
-241

[55] van leeuwen fx,
feeley m,
schrenk d,
larsen jc,
farland w, et coll.. Dioxins: WHO’s tolerable daily intake (TDI) revisited.
Chemosphere. 2000;
40:1095
-1101

[56] vidy a,
bard d. Influence de la valeur des Facteurs d’Équivalence de Toxicité (TEF) sur les estimations d’exposition de la population générale et impact décisionnel.
Environnement Risques Santé. 2003;
2:159
-167

[57] wakeford r,
little mp. Risk coefficients for childhood cancer after intrauterine irradiation : a review.
Int J Radiat Biol. 2003;
79:293
-309

[58] walker nj,
crockett pw,
nyska a,
brix ae,
jokinen mp, et coll.. Dose-additive carcinogenicity of a defined mixture of dioxin-like compounds.
Environ Health Perspect. 2005;
113:43
-48

[59] warner m,
eskenazi b,
mocarelli p,
gerthoux pm,
samuels s, et coll.. Serum dioxin concentrations and breast cancer risk in the Seveso Women’s Health Study.
Environ Health Perspect. 2002;
110:625
-628

→ Aller vers le SOMMAIRE de l'ouvrage
 ) ou le Comité BEIR (Biological Effects of Ionising Radiations) (NRC, 2005
) ou le Comité BEIR (Biological Effects of Ionising Radiations) (NRC, 2005 ). Certaines de ces études, disposant de données d’exposition et sanitaires fiables, ont permis de mettre en évidence l’existence de relations exposition-réponse ou dose-réponse. Néanmoins, des questions persistent sur la validité de ces relations en deçà du domaine où les effets sont observés (extrapolation) (Brenner et coll., 2003
). Certaines de ces études, disposant de données d’exposition et sanitaires fiables, ont permis de mettre en évidence l’existence de relations exposition-réponse ou dose-réponse. Néanmoins, des questions persistent sur la validité de ces relations en deçà du domaine où les effets sont observés (extrapolation) (Brenner et coll., 2003 ) et sur l’applicabilité de ces relations pour des populations différentes de celle dans laquelle elles ont été établies (transposition) (Hubert, 2003
) et sur l’applicabilité de ces relations pour des populations différentes de celle dans laquelle elles ont été établies (transposition) (Hubert, 2003 ).
). ). Des indicateurs synthétiques ont été élaborés dans un but de gestion en radioprotection. Ces indicateurs (détriment sanitaire, risque vie entière) reposent sur de nombreuses hypothèses, en particulier sur l’extrapolation des fortes doses aux faibles doses, sur l’analogie d’expositions ponctuelles à des expositions prolongées, et sur la transposition entre différentes populations. Ces hypothèses sont plus ou moins explicites (IPSN, 2002
). Des indicateurs synthétiques ont été élaborés dans un but de gestion en radioprotection. Ces indicateurs (détriment sanitaire, risque vie entière) reposent sur de nombreuses hypothèses, en particulier sur l’extrapolation des fortes doses aux faibles doses, sur l’analogie d’expositions ponctuelles à des expositions prolongées, et sur la transposition entre différentes populations. Ces hypothèses sont plus ou moins explicites (IPSN, 2002 ), l’objectif étant d’obtenir des indicateurs applicables à toute population, intégrant les différents effets (mortalité par cancer, qualité de vie, effets héréditaires potentiels) et les différents types d’exposition. On peut souligner les points suivants :
), l’objectif étant d’obtenir des indicateurs applicables à toute population, intégrant les différents effets (mortalité par cancer, qualité de vie, effets héréditaires potentiels) et les différents types d’exposition. On peut souligner les points suivants : ) ;
) ; ) ;
) ; ; Alpha-Risk, 2006
; Alpha-Risk, 2006 ).
). ). En dessous de ce niveau, les effets des rayonnements ionisants ne sont pas démontrés, mais les risques associés représentent un enjeu majeur de santé publique dans la mesure où la population générale est soumise, en grande majorité, à de faibles doses. Notons que l’extrapolation à partir des résultats observables (plus de 100 mSv) vers les faibles doses se fait sur une distance relativement courte, inférieure à deux ordres de grandeur au maximum.
). En dessous de ce niveau, les effets des rayonnements ionisants ne sont pas démontrés, mais les risques associés représentent un enjeu majeur de santé publique dans la mesure où la population générale est soumise, en grande majorité, à de faibles doses. Notons que l’extrapolation à partir des résultats observables (plus de 100 mSv) vers les faibles doses se fait sur une distance relativement courte, inférieure à deux ordres de grandeur au maximum. ). Comme les risques associés à ces niveaux de dose sont faibles, les variations des taux de base de cancer et l’existence de facteurs confondants peuvent rendre ces risques indétectables. Ainsi, peu d’études ont montré des risques significatifs pour des doses inférieures à 100 mSv (Brenner et coll., 2003
). Comme les risques associés à ces niveaux de dose sont faibles, les variations des taux de base de cancer et l’existence de facteurs confondants peuvent rendre ces risques indétectables. Ainsi, peu d’études ont montré des risques significatifs pour des doses inférieures à 100 mSv (Brenner et coll., 2003 ). Un cas particulier est l’exposition in utero, pour laquelle une étude anglaise de grande taille (regroupant plus de 80 % de l’information disponible) a montré une augmentation du risque de cancer de l’enfant associé aux expositions médicales in utero à partir de 10 mSv (Wakeford et Little, 2003
). Un cas particulier est l’exposition in utero, pour laquelle une étude anglaise de grande taille (regroupant plus de 80 % de l’information disponible) a montré une augmentation du risque de cancer de l’enfant associé aux expositions médicales in utero à partir de 10 mSv (Wakeford et Little, 2003 ). La cohorte des survivants des bombardements de Hiroshima et Nagasaki a permis une analyse de la relation dose-réponse sur des intervalles de dose restreints (tableau 58.I
). La cohorte des survivants des bombardements de Hiroshima et Nagasaki a permis une analyse de la relation dose-réponse sur des intervalles de dose restreints (tableau 58.I ). Pour des doses inférieures à 110 mSv, la relation n’est plus significative pour l’ensemble des cancers solides, mais le risque relatif par unité de dose reste très similaire et l’analyse ne suggère pas de diminution de la relation dose-réponse aux faibles doses (Preston et coll., 2003
). Pour des doses inférieures à 110 mSv, la relation n’est plus significative pour l’ensemble des cancers solides, mais le risque relatif par unité de dose reste très similaire et l’analyse ne suggère pas de diminution de la relation dose-réponse aux faibles doses (Preston et coll., 2003 ). Une relation similaire est observée sur des données d’incidence (figure 58.1
). Une relation similaire est observée sur des données d’incidence (figure 58.1 ).
). et 2004
et 2004 ).
). )
) ). D’autres études conjointes récemment publiées confirment l’existence d’une association entre l’exposition au radon dans les habitations et le risque de cancer du poumon (Darby et coll., 2005
). D’autres études conjointes récemment publiées confirment l’existence d’une association entre l’exposition au radon dans les habitations et le risque de cancer du poumon (Darby et coll., 2005 ; Krewski et coll., 2005
; Krewski et coll., 2005 ). Ces dernières études fournissent des résultats significatifs directement sur les populations concernées, à des niveaux d’exposition faibles.
). Ces dernières études fournissent des résultats significatifs directement sur les populations concernées, à des niveaux d’exposition faibles. ; Brenner et Sachs, 2006
; Brenner et Sachs, 2006 ).
). ) et aux États-Unis (NRC, 2005
) et aux États-Unis (NRC, 2005 ), qui aboutissent à des positions opposées quant à l’extrapolation des risques aux faibles doses (Tubiana et coll., 2006
), qui aboutissent à des positions opposées quant à l’extrapolation des risques aux faibles doses (Tubiana et coll., 2006 ; Bren-ner et Sachs, 2006
; Bren-ner et Sachs, 2006 ). Le rapport des Académies de médecine et des sciences françaises souligne la faiblesse des résultats épidémiologiques aux faibles doses et l’existence de nombreux phénomènes biologiques dont l’impact aux faibles doses n’est pas quantifiable actuellement. Pour ses auteurs, les connaissances scientifiques ne permettent pas de justifier le modèle d’extrapolation linéaire aux faibles doses et les incertitudes actuelles ne permettent pas d’évaluer les risques aux faibles doses de manière fiable (Tubiana et coll., 2005
). Le rapport des Académies de médecine et des sciences françaises souligne la faiblesse des résultats épidémiologiques aux faibles doses et l’existence de nombreux phénomènes biologiques dont l’impact aux faibles doses n’est pas quantifiable actuellement. Pour ses auteurs, les connaissances scientifiques ne permettent pas de justifier le modèle d’extrapolation linéaire aux faibles doses et les incertitudes actuelles ne permettent pas d’évaluer les risques aux faibles doses de manière fiable (Tubiana et coll., 2005 ). Le rapport de l’Académie des Sciences américaine, quant à lui, s’appuie principalement sur l’analyse des résultats épidémiologiques. Il conclut qu’en l’état des connaissances actuelles, le modèle d’extrapolation linéaire aux faibles doses apparaît comme l’hypothèse la plus raisonnable et que les connaissances disponibles sur les effets d’autres phénomènes biologiques aux faibles doses ne permettent pas de remettre en cause cette conclusion (NRC, 2005
). Le rapport de l’Académie des Sciences américaine, quant à lui, s’appuie principalement sur l’analyse des résultats épidémiologiques. Il conclut qu’en l’état des connaissances actuelles, le modèle d’extrapolation linéaire aux faibles doses apparaît comme l’hypothèse la plus raisonnable et que les connaissances disponibles sur les effets d’autres phénomènes biologiques aux faibles doses ne permettent pas de remettre en cause cette conclusion (NRC, 2005 ).
). ; ICRP, 1999
; ICRP, 1999 ).
). ). C’est pourquoi des études ont récemment été lancées également en population générale (Laurier et coll., 2001
). C’est pourquoi des études ont récemment été lancées également en population générale (Laurier et coll., 2001 ; Darby et coll., 2005
; Darby et coll., 2005 ; Alpha-Risk, 2006
; Alpha-Risk, 2006 ).
). ). Par exemple, la population japonaise présente des taux de cancer du sein ou du poumon nettement plus faibles que ceux de la population européenne ou américaine. La question de la transposition des coefficients de risque issus de l’étude des survivants de Hiroshima et Nagasaki s’est donc posée (Hubert, 2003
). Par exemple, la population japonaise présente des taux de cancer du sein ou du poumon nettement plus faibles que ceux de la population européenne ou américaine. La question de la transposition des coefficients de risque issus de l’étude des survivants de Hiroshima et Nagasaki s’est donc posée (Hubert, 2003 ). Selon que l’on considère un modèle d’excès de risque relatif (l’excès de risque associé à l’exposition est proportionnel au taux de base) ou un modèle d’excès de risque absolu (l’excès de risque associé à l’exposition s’ajoute au taux de base dans la population considérée), les résultats pourront être très différents pour ce qui est de la projection du risque sur la vie entière et en ce qui concerne le transfert entre des populations présentant des taux de base différents. Les synthèses des connaissances effectuées par l’Unscear présentent systématiquement les deux estimateurs. L’Unscear considère aujourd’hui que l’excès de risque est relatif pour les cancers solides et absolu pour les leucémies (Unscear, 2000
). Selon que l’on considère un modèle d’excès de risque relatif (l’excès de risque associé à l’exposition est proportionnel au taux de base) ou un modèle d’excès de risque absolu (l’excès de risque associé à l’exposition s’ajoute au taux de base dans la population considérée), les résultats pourront être très différents pour ce qui est de la projection du risque sur la vie entière et en ce qui concerne le transfert entre des populations présentant des taux de base différents. Les synthèses des connaissances effectuées par l’Unscear présentent systématiquement les deux estimateurs. L’Unscear considère aujourd’hui que l’excès de risque est relatif pour les cancers solides et absolu pour les leucémies (Unscear, 2000 ). Néanmoins, des exceptions pourraient exister pour certains cancers spécifiques, par exemple le cancer du poumon (Pierce et coll., 2005
). Néanmoins, des exceptions pourraient exister pour certains cancers spécifiques, par exemple le cancer du poumon (Pierce et coll., 2005 ).
). ). Dans le but d’établir des indicateurs synthétiques des effets des rayonnements ionisants utilisables en radioprotection, des facteurs de pondération des différents types de rayonnements ont été estimés. Ainsi, pour une même dose absorbée, l’efficacité biologique d’une exposition alpha est ainsi considérée 20 fois supérieure à celle d’une exposition gamma. L’utilisation des facteurs de pondération permet de considérer la dose délivrée à un organe donné exposé à différentes sources d’irradiation. Néanmoins, de nombreuses incertitudes existent sur l’efficacité biologique relative des différents types de rayonnements ionisants. Par exemple, les recherches actuelles sur les effets des expositions au radon suggèrent des facteurs de pondération très inférieurs à 20 (Marsh et coll., 2002
). Dans le but d’établir des indicateurs synthétiques des effets des rayonnements ionisants utilisables en radioprotection, des facteurs de pondération des différents types de rayonnements ont été estimés. Ainsi, pour une même dose absorbée, l’efficacité biologique d’une exposition alpha est ainsi considérée 20 fois supérieure à celle d’une exposition gamma. L’utilisation des facteurs de pondération permet de considérer la dose délivrée à un organe donné exposé à différentes sources d’irradiation. Néanmoins, de nombreuses incertitudes existent sur l’efficacité biologique relative des différents types de rayonnements ionisants. Par exemple, les recherches actuelles sur les effets des expositions au radon suggèrent des facteurs de pondération très inférieurs à 20 (Marsh et coll., 2002 ) ainsi que des variations importantes selon l’organe considéré. L’évaluation quantitative des risques devrait donc, lorsque cela est possible, s’appuyer sur une relation dose-réponse ad hoc (même type d’exposition et dose à l’organe pertinent pour le cancer considéré).
) ainsi que des variations importantes selon l’organe considéré. L’évaluation quantitative des risques devrait donc, lorsque cela est possible, s’appuyer sur une relation dose-réponse ad hoc (même type d’exposition et dose à l’organe pertinent pour le cancer considéré). ). Néanmoins, les études effectuées récemment au sein de populations exposées de façon chronique (cohorte des riverains de la rivière Tetcha en Oural (Krestinina et coll., 2005
). Néanmoins, les études effectuées récemment au sein de populations exposées de façon chronique (cohorte des riverains de la rivière Tetcha en Oural (Krestinina et coll., 2005 ), étude conjointe internationale des travailleurs de l’industrie nucléaire de 15 pays (Cardis et coll., 2005
), étude conjointe internationale des travailleurs de l’industrie nucléaire de 15 pays (Cardis et coll., 2005 ), indiquent l’existence d’une relation dose-réponse, avec des excès de risque relatif par unité de dose cohérents avec ceux obtenus chez les survivants des bombardements de Hiroshima et Nagasaki. L’Académie des Sciences américaine a récemment proposé une valeur de 1,5 au lieu de 2 pour ce coefficient de réduction des effets aux faibles doses et débits de dose (NRC, 2005
), indiquent l’existence d’une relation dose-réponse, avec des excès de risque relatif par unité de dose cohérents avec ceux obtenus chez les survivants des bombardements de Hiroshima et Nagasaki. L’Académie des Sciences américaine a récemment proposé une valeur de 1,5 au lieu de 2 pour ce coefficient de réduction des effets aux faibles doses et débits de dose (NRC, 2005 ).
). ) (figure 58.2
) (figure 58.2 ).
). ) ou chez les enfants traités par radiothérapie (de Vathaire et coll., 1995
) ou chez les enfants traités par radiothérapie (de Vathaire et coll., 1995 ). Une forte diminution du risque de cancer du poumon avec le délai depuis l’exposition apparaît également chez les mineurs d’uranium (NRC, 1999
). Une forte diminution du risque de cancer du poumon avec le délai depuis l’exposition apparaît également chez les mineurs d’uranium (NRC, 1999 ; Tirmarche et coll., 2003
; Tirmarche et coll., 2003 ).
). ). Ceci devient encore plus pertinent lorsqu’une partie de l’exposition est d’origine naturelle. Il est alors important pour faciliter l’interprétation des résultats de segmenter les expositions et d’identifier la part du risque attribuable aux expositions qu’il est possible de réduire. Ceci est par exemple le cas dans l’évaluation du risque de cancer du poumon attribuable à l’exposition domestique au radon (Pirard et Hubert, 2001
). Ceci devient encore plus pertinent lorsqu’une partie de l’exposition est d’origine naturelle. Il est alors important pour faciliter l’interprétation des résultats de segmenter les expositions et d’identifier la part du risque attribuable aux expositions qu’il est possible de réduire. Ceci est par exemple le cas dans l’évaluation du risque de cancer du poumon attribuable à l’exposition domestique au radon (Pirard et Hubert, 2001 ; Catelinois et coll., 2006
; Catelinois et coll., 2006 ).
). ). Dans la mesure où il n’y a pas eu de développement significatif depuis cette publication, le lecteur est invité à s’y reporter.
). Dans la mesure où il n’y a pas eu de développement significatif depuis cette publication, le lecteur est invité à s’y reporter. ). Des dosages sanguins ont toutefois été faits entre 1996 et 1998 sur des échantillons recueillis en 1976 chez les 981 femmes étudiées dans la cohorte « Seveso Women Health Study » (SWHS) (Warner et coll., 2002
). Des dosages sanguins ont toutefois été faits entre 1996 et 1998 sur des échantillons recueillis en 1976 chez les 981 femmes étudiées dans la cohorte « Seveso Women Health Study » (SWHS) (Warner et coll., 2002 ) mais les résultats disponibles portent uniquement sur le cancer du sein et la modélisation de la relation dose-réponse est à ce stade préliminaire. Quoi qu’il en soit, l’exposition pondérée moyenne dans les deux zones les plus exposées à Seveso est 25 fois moindre que dans les cohortes américaines et allemandes de la méta-analyse de Starr (2001
) mais les résultats disponibles portent uniquement sur le cancer du sein et la modélisation de la relation dose-réponse est à ce stade préliminaire. Quoi qu’il en soit, l’exposition pondérée moyenne dans les deux zones les plus exposées à Seveso est 25 fois moindre que dans les cohortes américaines et allemandes de la méta-analyse de Starr (2001 ) (voir paragraphe « Approche sans seuil : résultats »).
) (voir paragraphe « Approche sans seuil : résultats »). ).
). ).
). ) ainsi que dans les méta-analyses de Starr (Starr, 2001
) ainsi que dans les méta-analyses de Starr (Starr, 2001 ) et de Crump et collaborateurs (Crump et coll., 2003
) et de Crump et collaborateurs (Crump et coll., 2003 ), les données du domaine observable sont modélisées. Après test d’adéquation du modèle, les estimations centrales et des intervalles de confiance à 95 % sont extrapolées jusqu’à un niveau de dose correspondant à un excès de risque spécifié (voir figure 58.3
), les données du domaine observable sont modélisées. Après test d’adéquation du modèle, les estimations centrales et des intervalles de confiance à 95 % sont extrapolées jusqu’à un niveau de dose correspondant à un excès de risque spécifié (voir figure 58.3 ). Ce dernier, appelé point de départ (PDD ici ; Point of departure ou POD) doit se situer près de la limite du domaine observable et dépend donc de la puissance de l’étude. Celle-ci peut autoriser par exemple un PDD à 1 % (Dose effective 1 % ou DE01), 5 % (Dose effective 5 % ou DE05) ou autre. On peut partir de l’estimation centrale ou de la limite supérieure de l’intervalle de confiance à 95 % pour le risque et dans ce cas retenir la limite inférieure de l’intervalle de confiance à 95 % pour la dose effective (LIDExx), qui est en général le PDD retenu. Des tests statistiques peuvent être conduits sur le comportement du ratio (DExx/LIDExx) entre estimation centrale et limite inférieure de l’intervalle de confiance à 95 % pour la dose effective afin d’évaluer jusqu’à quel point les données disponibles justifient les estimations du modèle pour un niveau de réponse donné.
). Ce dernier, appelé point de départ (PDD ici ; Point of departure ou POD) doit se situer près de la limite du domaine observable et dépend donc de la puissance de l’étude. Celle-ci peut autoriser par exemple un PDD à 1 % (Dose effective 1 % ou DE01), 5 % (Dose effective 5 % ou DE05) ou autre. On peut partir de l’estimation centrale ou de la limite supérieure de l’intervalle de confiance à 95 % pour le risque et dans ce cas retenir la limite inférieure de l’intervalle de confiance à 95 % pour la dose effective (LIDExx), qui est en général le PDD retenu. Des tests statistiques peuvent être conduits sur le comportement du ratio (DExx/LIDExx) entre estimation centrale et limite inférieure de l’intervalle de confiance à 95 % pour la dose effective afin d’évaluer jusqu’à quel point les données disponibles justifient les estimations du modèle pour un niveau de réponse donné.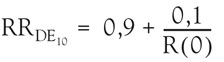
 ). À l’équilibre (steady-state conditions), on peut calculer la charge corporelle à partir de l’exposition et vice-versa en utilisant l’équation :
). À l’équilibre (steady-state conditions), on peut calculer la charge corporelle à partir de l’exposition et vice-versa en utilisant l’équation :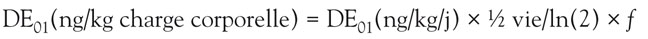
 ) a été effectuée sur trois cohortes de travailleurs de l’industrie chimique, deux en Allemagne, une aux États-Unis, en se basant sur les données de l’étude originelle de cette dernière (Fingerhut et coll., 1991
) a été effectuée sur trois cohortes de travailleurs de l’industrie chimique, deux en Allemagne, une aux États-Unis, en se basant sur les données de l’étude originelle de cette dernière (Fingerhut et coll., 1991 ). La dosimétrie utilisée était la charge corporelle moyenne en concentration dans les lipides. À travers une estimation du taux standardisé de mortalité (SMR), il conclut que les données de ces trois études groupées montrent un risque accru de décès par cancer pour une exposition au niveau du bruit de fond. Ces données sont compatibles, sur la base d’un test d’adéquation, avec une absence d’effet cancérogène de l’exposition à la TCDD dans ces cohortes.
). La dosimétrie utilisée était la charge corporelle moyenne en concentration dans les lipides. À travers une estimation du taux standardisé de mortalité (SMR), il conclut que les données de ces trois études groupées montrent un risque accru de décès par cancer pour une exposition au niveau du bruit de fond. Ces données sont compatibles, sur la base d’un test d’adéquation, avec une absence d’effet cancérogène de l’exposition à la TCDD dans ces cohortes. ) ont conduit une méta-analyse des données des trois cohortes déjà citées. Les données utilisées sont présentées au tableau 58.II
) ont conduit une méta-analyse des données des trois cohortes déjà citées. Les données utilisées sont présentées au tableau 58.II . Il est important de noter que les données de la cohorte NIOSH (National Institute for Occupational Safety and Health) ne sont pas, contrairement à l’analyse de Starr, celles dont fait état la publication originelle (Fingerhut et coll., 1991
. Il est important de noter que les données de la cohorte NIOSH (National Institute for Occupational Safety and Health) ne sont pas, contrairement à l’analyse de Starr, celles dont fait état la publication originelle (Fingerhut et coll., 1991 ) mais comportent des données d’exposition plus élaborées et un suivi allongé de six ans, apportant donc a priori une puissance améliorée (Starr, 2001
) mais comportent des données d’exposition plus élaborées et un suivi allongé de six ans, apportant donc a priori une puissance améliorée (Starr, 2001 ; Steenland et coll., 2001
; Steenland et coll., 2001 ; Steenland et Deddens, 2003
; Steenland et Deddens, 2003 ). La modélisation de la relation dose-réponse repose sur l’hypothèse que le SMR est fonction linéaire de la concentration lipidique sérique cumulative (CSLC) (unité : ppt/an), ajustée sur le bruit de fond (en TEQ). Des tests de non-linéarité potentielle de la relation dose-réponse ont été conduits, qui ne remettent pas en question l’hypothèse de linéarité. Les doses effectives 10, 05, 01 ont été calculées sur la base d’une dose quotidienne moyenne sur la vie entière. Pour ce faire, le temps de latence a été fixé à 15 ans, la ½ vie à 7,6 ans, la biodisponibilité à 50 % et les auteurs considèrent que les lipides représentent 25 % de la masse corporelle.
). La modélisation de la relation dose-réponse repose sur l’hypothèse que le SMR est fonction linéaire de la concentration lipidique sérique cumulative (CSLC) (unité : ppt/an), ajustée sur le bruit de fond (en TEQ). Des tests de non-linéarité potentielle de la relation dose-réponse ont été conduits, qui ne remettent pas en question l’hypothèse de linéarité. Les doses effectives 10, 05, 01 ont été calculées sur la base d’une dose quotidienne moyenne sur la vie entière. Pour ce faire, le temps de latence a été fixé à 15 ans, la ½ vie à 7,6 ans, la biodisponibilité à 50 % et les auteurs considèrent que les lipides représentent 25 % de la masse corporelle. )
) .
. .
. )
) ), les données des mêmes cohortes ont fait l’objet d’une modélisation du risque de cancer vie entière limitée à 75 ans pour une exposition correspondant à une élévation de 1 pg de la charge corporelle par rapport à celle résultant de l’exposition au bruit de fond.
), les données des mêmes cohortes ont fait l’objet d’une modélisation du risque de cancer vie entière limitée à 75 ans pour une exposition correspondant à une élévation de 1 pg de la charge corporelle par rapport à celle résultant de l’exposition au bruit de fond. .
. ) ; les hypothèses de calcul sont similaires : masse grasse corporelle 25 % ; 80 % de la dose de TCDD est absorbée à partir de l’alimentation humaine « standard » ; la ½ vie de la TCDD chez l’homme est posée à 7,1 ans.
) ; les hypothèses de calcul sont similaires : masse grasse corporelle 25 % ; 80 % de la dose de TCDD est absorbée à partir de l’alimentation humaine « standard » ; la ½ vie de la TCDD chez l’homme est posée à 7,1 ans. ), comparables à celle de la méta-analyse de Crump et coll. (2003
), comparables à celle de la méta-analyse de Crump et coll. (2003 ), estimée à 0,37 × 10–3 (avec un SMR variable).
), estimée à 0,37 × 10–3 (avec un SMR variable). )
) ) ne sont pas présentés ici car les risques attribués par ce modèle aux niveaux du bruit de fond dans la population sont déraisonnablement élevés.
) ne sont pas présentés ici car les risques attribués par ce modèle aux niveaux du bruit de fond dans la population sont déraisonnablement élevés. ).
). ). Cet organisme conclut in fine que « la valeur de 1 × 10–3 par pg TEQ/kg de poids corporel par jour apparaît comme un estimateur de la limite supérieure de la pente de la relation dose-réponse pour le risque de cancer tous sites, à la fois pour l’exposition au niveau de bruit de fond et pour celles survenant au-delà » (US-EPA, 2003
). Cet organisme conclut in fine que « la valeur de 1 × 10–3 par pg TEQ/kg de poids corporel par jour apparaît comme un estimateur de la limite supérieure de la pente de la relation dose-réponse pour le risque de cancer tous sites, à la fois pour l’exposition au niveau de bruit de fond et pour celles survenant au-delà » (US-EPA, 2003 ). Il considère en outre que la TCDD est un cancérogène pour l’Homme et que les autres congénères sont vraisemblablement cancérogènes, individuellement et en mélange.
). Il considère en outre que la TCDD est un cancérogène pour l’Homme et que les autres congénères sont vraisemblablement cancérogènes, individuellement et en mélange. ; Michalek et coll., 2002
; Michalek et coll., 2002 ; Aylward et coll., 2005
; Aylward et coll., 2005 ) montrent que l’usage du modèle d’élimination de premier ordre de la TCDD, c’est-à-dire une ½ vie constante (par exemple de 7 ou de 9 ans) quelle que soit la dose ou la charge corporelle sous-estime largement la dose reçue par des individus très exposés, avec une ½ vie effective inférieure à 3 ans lorsque les niveaux sériques lipidiques sont supérieurs à 1 000 ppt. En d’autres termes, les niveaux d’exposition reconstruits chez les sujets les plus exposés des cohortes sont largement sous-estimés dans les études de cohortes de travailleurs de l’industrie chimique. De plus, Aylward et coll. (2005
) montrent que l’usage du modèle d’élimination de premier ordre de la TCDD, c’est-à-dire une ½ vie constante (par exemple de 7 ou de 9 ans) quelle que soit la dose ou la charge corporelle sous-estime largement la dose reçue par des individus très exposés, avec une ½ vie effective inférieure à 3 ans lorsque les niveaux sériques lipidiques sont supérieurs à 1 000 ppt. En d’autres termes, les niveaux d’exposition reconstruits chez les sujets les plus exposés des cohortes sont largement sous-estimés dans les études de cohortes de travailleurs de l’industrie chimique. De plus, Aylward et coll. (2005 ) ont montré, à la suite de dosages répétés chez des sujets de Seveso, que la vitesse d’élimination décroissait avec l’âge, ce qui contribue aussi à une sous-estimation des doses reçues. Une telle sous-estimation implique que les estimations de risque correspondantes sont surestimées.
) ont montré, à la suite de dosages répétés chez des sujets de Seveso, que la vitesse d’élimination décroissait avec l’âge, ce qui contribue aussi à une sous-estimation des doses reçues. Une telle sous-estimation implique que les estimations de risque correspondantes sont surestimées. ) ont reproduit les analyses de Steenland et collaborateurs (Fingerhut et coll., 1991
) ont reproduit les analyses de Steenland et collaborateurs (Fingerhut et coll., 1991 ; Steenland et coll., 2001
; Steenland et coll., 2001 ; Steenland et Deddens, 2003
; Steenland et Deddens, 2003 ) avec des résultats très proches de ceux produits par ces derniers. Ils ont ensuite appliqué un nouveau modèle dosimétrique (modèle CADM pour modèle d’élimination concentration- et âge-dépendant) tenant compte de ces résultats à l’analyse des données individuelles de la cohorte du NIOSH (Fingerhut et coll., 1991
) avec des résultats très proches de ceux produits par ces derniers. Ils ont ensuite appliqué un nouveau modèle dosimétrique (modèle CADM pour modèle d’élimination concentration- et âge-dépendant) tenant compte de ces résultats à l’analyse des données individuelles de la cohorte du NIOSH (Fingerhut et coll., 1991 ; Steenland et coll., 2001
; Steenland et coll., 2001 ; Steenland et Deddens, 2003
; Steenland et Deddens, 2003 ). Ce modèle dosimétrique a une meilleure adéquation avec les données observées. Les auteurs ont calculé les SMR et appliqué à ces données des temps de latence variables (0, 10 et 15 ans) dans des modèles de Cox dont l’un se basait sur des fonctions splines pénalisées des résultats dosimétriques CADM. Ils ont privilégié les valeurs des doses les moins élevées en excluant dans des analyses de sensibilité les valeurs extrêmes, considérées comme plus sujettes aux erreurs de classement, s’appuyant sur la publication de Stayner et coll. (2003
). Ce modèle dosimétrique a une meilleure adéquation avec les données observées. Les auteurs ont calculé les SMR et appliqué à ces données des temps de latence variables (0, 10 et 15 ans) dans des modèles de Cox dont l’un se basait sur des fonctions splines pénalisées des résultats dosimétriques CADM. Ils ont privilégié les valeurs des doses les moins élevées en excluant dans des analyses de sensibilité les valeurs extrêmes, considérées comme plus sujettes aux erreurs de classement, s’appuyant sur la publication de Stayner et coll. (2003 ). Les estimations de doses issues de la dosimétrie CADM sont plus élevées que celles de Steenland et coll. (Steenland et coll., 2001
). Les estimations de doses issues de la dosimétrie CADM sont plus élevées que celles de Steenland et coll. (Steenland et coll., 2001 ; Steenland et Deddens, 2003
; Steenland et Deddens, 2003 ). L’association entre l’exposition à la TCDD et la mortalité par cancer tous sites était absente ou faible en l’absence de prise en compte d’un temps de latence ou sur des données non transformées ou sur l’ensemble des données disponibles. L’usage du CADM aboutit à des estimations de risque inférieures d’un facteur 6 à un facteur 10 à celles de l’US-EPA (2003
). L’association entre l’exposition à la TCDD et la mortalité par cancer tous sites était absente ou faible en l’absence de prise en compte d’un temps de latence ou sur des données non transformées ou sur l’ensemble des données disponibles. L’usage du CADM aboutit à des estimations de risque inférieures d’un facteur 6 à un facteur 10 à celles de l’US-EPA (2003 ) et le risque de décès par cancer tous sites pour une exposition vie entière au niveau du bruit de fond est dans ces conditions inférieur à 10–4. Malgré cette réévaluation à la baisse qui répond à celle des doses (à la hausse), les estimations de risque varient sur plus de deux ordres de grandeur, en fonction des modèles utilisés et des différents éléments de calcul.
) et le risque de décès par cancer tous sites pour une exposition vie entière au niveau du bruit de fond est dans ces conditions inférieur à 10–4. Malgré cette réévaluation à la baisse qui répond à celle des doses (à la hausse), les estimations de risque varient sur plus de deux ordres de grandeur, en fonction des modèles utilisés et des différents éléments de calcul. ). Les résultats ne montrent pas de tendance significative pour l’excès de mortalité par cancer tous sites ou pour des sites spécifiques lorsque la dose cumulée estimée est calculée en TEQ : les SMR étaient, pour des concentrations cumulées croissantes en TEQ dans les lipides de 107, 164, 133, et 164 (p = 0,48). Le fait que les toxicités relatives des congénères ne soient pas nécessairement les mêmes en termes systémiques et pour les effets des expositions peut pour une part expliquer ces résultats.
). Les résultats ne montrent pas de tendance significative pour l’excès de mortalité par cancer tous sites ou pour des sites spécifiques lorsque la dose cumulée estimée est calculée en TEQ : les SMR étaient, pour des concentrations cumulées croissantes en TEQ dans les lipides de 107, 164, 133, et 164 (p = 0,48). Le fait que les toxicités relatives des congénères ne soient pas nécessairement les mêmes en termes systémiques et pour les effets des expositions peut pour une part expliquer ces résultats. ). Pour résumer, ils sont essentiellement estimés à partir de données expérimentales à court terme, et l’inclusion des PCB « dioxin-like » pour ce risque reste problématique dans la mesure où il existe peu de données de cancérogenèse expérimentale pour ces composés. Une récente étude de cancérogenèse in vivo a cependant montré que les TEF d’un mélange de TCDD, de 2,3,4,7,8-PeCDF et de PCB 126 prédisaient de façon adéquate l’incidence accrue de tumeurs hépatiques induite par le mélange, apportant par là également un certain soutien en faveur de l’additivité des effets des différents congénères (Walker et coll., 2005
). Pour résumer, ils sont essentiellement estimés à partir de données expérimentales à court terme, et l’inclusion des PCB « dioxin-like » pour ce risque reste problématique dans la mesure où il existe peu de données de cancérogenèse expérimentale pour ces composés. Une récente étude de cancérogenèse in vivo a cependant montré que les TEF d’un mélange de TCDD, de 2,3,4,7,8-PeCDF et de PCB 126 prédisaient de façon adéquate l’incidence accrue de tumeurs hépatiques induite par le mélange, apportant par là également un certain soutien en faveur de l’additivité des effets des différents congénères (Walker et coll., 2005 ).
). ) ont évolué en 2005 (Van den Berg et coll., 2006
) ont évolué en 2005 (Van den Berg et coll., 2006 ; voir la partie « Exposition » du présent ouvrage). Leur usage semble conduire à une diminution aux alentours de 30 % des doses estimées. Il en résulte que le risque à dose donnée exprimée en TEQ est accru par rapport aux estimations précédentes.
; voir la partie « Exposition » du présent ouvrage). Leur usage semble conduire à une diminution aux alentours de 30 % des doses estimées. Il en résulte que le risque à dose donnée exprimée en TEQ est accru par rapport aux estimations précédentes. ; Van den Berg, 2005
; Van den Berg, 2005 ) repose sur l’indiscutable caractère promoteur de la cancérogenèse de la dioxine, et sur son absence de mutagénicité démontrée (Inserm, 2000
) repose sur l’indiscutable caractère promoteur de la cancérogenèse de la dioxine, et sur son absence de mutagénicité démontrée (Inserm, 2000 ). Les experts de l’OMS considèrent en conséquence qu’il convient de raisonner selon le modèle de cancérogenèse généralement admis, c’est-à-dire qu’un promoteur est un agent à seuil (Voir la partie « Mécanismes de toxicité » du présent ouvrage et l’expertise préalable Inserm, 2005
). Les experts de l’OMS considèrent en conséquence qu’il convient de raisonner selon le modèle de cancérogenèse généralement admis, c’est-à-dire qu’un promoteur est un agent à seuil (Voir la partie « Mécanismes de toxicité » du présent ouvrage et l’expertise préalable Inserm, 2005 ). Dans ce cas, « les niveaux d’exposition du public en Europe sont tels que le risque de développer un cancer du fait de l’exposition à la dioxine est nul » au regard de la valeur de référence, dérivée du seuil observé chez l’animal et assorti d’une marge de sécurité. La logique du raisonnement est ainsi de considérer que le modèle de cancérogenèse rend parfaitement compte de la réalité des faits.
). Dans ce cas, « les niveaux d’exposition du public en Europe sont tels que le risque de développer un cancer du fait de l’exposition à la dioxine est nul » au regard de la valeur de référence, dérivée du seuil observé chez l’animal et assorti d’une marge de sécurité. La logique du raisonnement est ainsi de considérer que le modèle de cancérogenèse rend parfaitement compte de la réalité des faits.