Les cellules eucaryotes sont compartimentées en organites distincts associés à des fonctions spécialisées. La littérature récente montre que ces organites ne flottent pas indépendamment dans le cytoplasme, mais forment un réseau interdépendant au sein duquel ils collaborent. La formation de sites de contact membranaire (SCM) confère un support physique à l’échange de matériel, au positionnement et à la fission d’organites, et à la communication entre organites. Ces zones de contact sont caractérisées par un rapprochement étroit (< 30 nm) des membranes de deux organites distincts [1]. Dans ce réseau, le réticulum endoplasmique (RE), composé de tubes et de feuillets, se distingue par sa morphologie ramifiée couvrant l’intégralité du cytoplasme et par sa capacité à établir des contacts avec la plupart des autres organites. De ce fait, le RE joue un rôle central dans la coopération entre les organites [2].
Au niveau moléculaire, la formation des SCM nécessite des interactions protéiques et/ou protéo-membranaires à l’interface des organites impliqués [3]. L’identification des complexes contribuant à la formation des SCM est essentielle pour comprendre la fonction de ces micro-domaines. Deux acteurs majeurs de la formation des ponts moléculaires entre le RE et les autres organites sont connus [4] ; ces protéines, nommées VAP-A et VAP-B (VAMP-associated protein) chez l’homme, résident sur le RE et contiennent un domaine MSP (major sperm protein) faisant face au cytoplasme. Ce domaine agit comme un harpon moléculaire, en interagissant avec de petits motifs linéaires appelés FFAT (two phenylalanines in an acidic tract) présents chez une grande variété de protéines soit cytoplasmiques, soit présentes à la surface d’un organite tel que l’appareil de Golgi, les mitochondries, les endosomes, les peroxysomes et la membrane plasmique [4]. Diverses fonctions biologiques ont récemment été associées aux SCM bâtis par les VAP, comme l’homéostasie calcique, le transport des lipides, le positionnement des endosomes et l’autophagie [5-7]
Étonnamment, il a été montré que la perte d’expression conjointe de VAP-A et VAP-B ne provoque qu’une perte partielle des contacts entre le RE et les autres organites cellulaires [8, 9]. Ces données suggéraient fortement que l’absence des protéines VAP dans la cellule pouvait être compensée, probablement par une autre protéine cellulaire ayant également la capacité d’interagir avec les motifs FFAT. Comme aucun mécanisme capable de supplanter l’action des VAP n’avait été décrit, nous avons exploré cette possibilité. Pour trouver l’ensemble des protéines capables d’interagir avec les motifs FFAT, nous avons réalisé une expérience de purification en utilisant comme appât un peptide portant un motif FFAT consensus, celui de la protéine ORP1L (oxysterol-binding protein-related protein 1). L’identité de l’ensemble des protéines retenues spécifiquement par cet appât a ensuite été révélée par spectrométrie de masse. Par cette approche protéomique non biaisée, nous avons identifié avec un grand score de confiance une nouvelle protéine nommée MOSPD2 (motile sperm protein domain-containing 2) [10].
Au niveau structural, MOSPD2, à l’instar des protéines VAP, possède un domaine MSP central. Une analyse in silico a permis de montrer que, malgré une faible homologie de séquences primaires, les domaines MSP de MOSPD2 et des VAP possèdent une structure tridimensionnelle conservée, ce qui est compatible avec un mode de reconnaissance similaire des motifs FFAT. Cette idée a été renforcée par des expériences de structure-fonction in vitro. Finalement, nous avons montré que le domaine MSP de MOSPD2 est capable d’interagir directement avec les motifs FFAT et qu’il possède une affinité pour ces motifs similaire à celle des domaines MSP des protéines VAP.
Par la suite, nous avons étendu l’étude in cellulo en déterminant que les protéines VAP et MOSPD2 partageaient les mêmes partenaires protéiques, en particulier cinq protéines à motif FFAT, STARD3 (StAR-related lipid transfer protein 3), STARD3NL (STARD3 N-terminal) et ORP1L toutes trois associées aux endosomes, la protéine mitochondriale PTPIP51 (protein tyrosine phosphatase-interacting protein 51) et STARD11 (StAR-related lipid transfer protein 11), une protéine associée à l’appareil de Golgi [11] (→).
(→) Voir la Synthèse de F. Alpy et al., m/s n° 2, février 2009, page 181
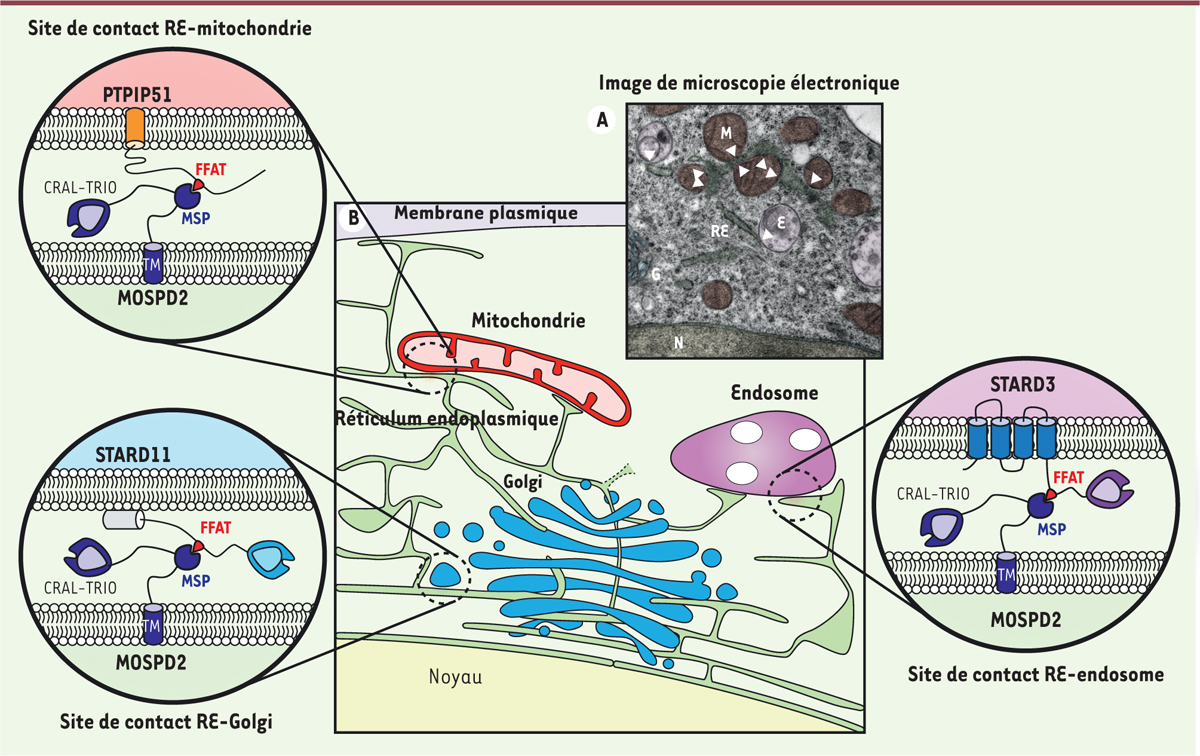
Nous nous sommes interrogés sur le périmètre d’activité de MOSPD2 au sein de la cellule. Des expériences d’imagerie ont montré que MOSPD2 est présente au niveau du RE, auquel elle s’ancre grâce à un domaine transmembranaire (TM) situé à son extrémité carboxy-terminale. Ainsi, MOSPD2 est présente à la surface du RE et permet la formation de SCM impliquant le RE et d’autres organites arborant les protéines à motif FFAT, comme par exemple les endosomes grâce aux protéines endosomales (STARD3, STARD3NL et ORP1L) ou les mitochondries via PTPIP51, et l’appareil de Golgi par STARD11 [10].
Cette étude a montré que le RE possède trois protéines homologues VAP-A, VAP-B et MOSPD2 impliquées dans la formation de sites de contact avec d’autres organites. MOSPD2 partage des caractéristiques structurelles et fonctionnelles avec les VAP, notamment, un domaine MSP capable de reconnaître des motifs FFAT et de lier des protéines contenant des FFAT ; un domaine transmembranaire C-terminal responsable de l’ancrage de la protéine dans la membrane de RE ; et la capacité de construire des SCM (Figure 1). De plus, à l’échelle de la résolution de la microscopie optique (~ 200 nm), nous avons observé que les protéines VAP et MOSPD2 sont localisées dans les mêmes sous-domaines du RE en contact avec un organite. Nous pouvons spéculer que VAP-A, VAP-B et MOSPD2 agissent comme des récepteurs du RE pour les protéines contenant un motif FFAT et génèrent une plate-forme de liaison pour l’amarrage des organites. Cependant, le mode de formation et la régulation de ce type de plate-forme restent inconnus.
| Figure 1. MOSPD2, un bâtisseur de sites de contact membranaire impliquant le réticulum endoplasmique. A. Image de microscopie électronique montrant des contacts (localisés par les têtes de flèches) entre le réticulum endoplasmique (RE) et les mitochondries (M), et le RE et les endosomes (E). Des fausses couleurs ont été attribuées au RE (vert), aux mitochondries (rouge), aux endosomes (magenta), à l’appareil de Golgi (G ; bleu) et au noyau (N ; jaune). B..MOSPD2 est une protéine composée de trois domaines fonctionnels : un domaine CRAL-TRIO (cellular retinaldehyde-binding protein et triple functional domain protein), un domaine MSP (major sperm protein) ainsi qu’un domaine transmembranaire (TM). Elle est ancrée à la membrane du réticulum endoplasmique (représenté en vert) grâce à son domaine TM. MOSPD2 est capable de bâtir des sites de contact membranaire entre le RE et les endosomes (magenta), les mitochondries (rouge) et l’appareil de Golgi (bleu) en interagissant respectivement avec STARD3 (StAR-related lipid transfer protein 3), PTPIP51 (protein tyrosine phosphatase-interacting protein 51) et STARD11. Au niveau moléculaire, ces rapprochements membranaires sont générés par l’interaction du domaine MSP de MOSPD2 et des motifs FFAT (two phenylalanines in an acidic tract) de STARD3, PTPIP51 et STARD11. |
Enfin, une approche de perte de fonction a été utilisée afin de déterminer le rôle physiologique de MOSPD2 sur la formation de contacts inter-organites. Nous avons observé une réduction significative des contacts RE-endosome dans des cellules déficientes en MOSPD2, et une augmentation concomitante des contacts endosome-endosome. Ce phénotype fait écho à une étude précédente ayant montré que les contacts RE-endosome sont impliqués dans la dynamique et la maturation du système endosomal [12]. Ces résultats étayent l’idée que, malgré des fonctions d’attache similaires, les rôles physiologiques des protéines VAP et MOSPD2 sur les contacts inter-organites sont distincts et / ou partiellement redondants. De fait, MOSPD2 se distingue des protéines VAP par la présence d’un domaine protéique supplémentaire appelé CRAL-TRIO (cellular retinaldehyde-binding protein [CRALBP] et triple functional domain protein [TRIO]) situé à son extrémité amino-terminale. De plus, en termes d’évolution, MOSPD2 est apparue plus tardivement que les protéines VAP ; les VAP sont présentes chez les animaux, les mycètes et les plantes, tandis que MOSPD2 est seulement présente chez les animaux. Le domaine CRAL-TRIO est retrouvé dans de nombreuses protéines impliquées dans le transport des lipides et dans plusieurs règnes du vivant, dont les mycètes. La protéine de levure Sec14 (phosphatidylcholine- and (or) phosphatidylinositol-binding protein), est la protéine à domaine CRAL-TRIO la mieux caractérisée. Elle est capable d’échanger deux types de lipides, le phosphatidylinositol (PI) et la phosphatidylcholine (PC) entre des membranes [13]. Ainsi, la présence de ce domaine, vraisemblablement impliqué dans le transport de lipides, fait de MOSPD2 un récepteur unique à la surface du RE. À titre d’exemple, MOSPD2 est capable d’interagir avec des protéines à motif FFAT contenant leur propre domaine de transport lipidique comme STARD3. Cela implique qu’un complexe protéique unique (complexe MOSPD2/STARD3 par exemple) pourrait intégrer deux activités distinctes de transfert de lipides au niveau des contacts entre le RE et d’autres organites. Nos études ultérieures clarifieront l’implication du domaine CRAL-TRIO dans la fonction de MOSPD2.
L’identification de MOSPD2 comme nouvel harpon moléculaire du RE, capable d’interagir avec des protéines à motif FFAT, apporte une nouvelle dimension aux études impliquant les protéines VAP. La découverte que MOSPD2 partage des partenaires protéiques avec VAP-A et VAP-B modifie le paysage moléculaire des sites de contacts. Comment la balance entre la formation des contacts impliquant VAP et / ou MOSPD2 est modulée reste cependant à élucider.