On associe souvent le terme de cellules souches pluripotentes humaines à celui de thérapie cellulaire. C’est oublier qu’aujourd’hui, la majorité des études à but thérapeutique qui s’appuient sur ces cellules les utilisent comme modèles in vitro de maladies, essentiellement monogéniques, dont elles répliquent les bases moléculaires [1, 2] (→).
(→) Voir la Synthèse de D. Laustriat et al., m/s n° 5, mai 2009, page 32
L’intérêt de ces modèles cellulaires pour la pharmacologie a donné lieu à des dizaines de travaux expérimentaux permettant d’identifier des composés à potentiel thérapeutique pour des maladies aussi diverses que la progeria1,, la neurofibromatose de type 12,, des formes génétiques de la maladie de Parkinson ou de la sclérose latérale amyotrophique3,, des troubles du spectre autistique et bien d’autres. Toutefois, la démonstration chez l’homme, validée par un essai clinique standardisé, de l’efficacité d’un composé identifié in vitro par cette approche n’avait pas encore été obtenue. Les résultats d’une récente étude de phase II randomisée en double-aveugle testant la metformine contre un placebo chez des patients atteints de dystrophie myotonique de type 1 (DM1, ou maladie de Steinert)4 en apporte une preuve de concept [3].
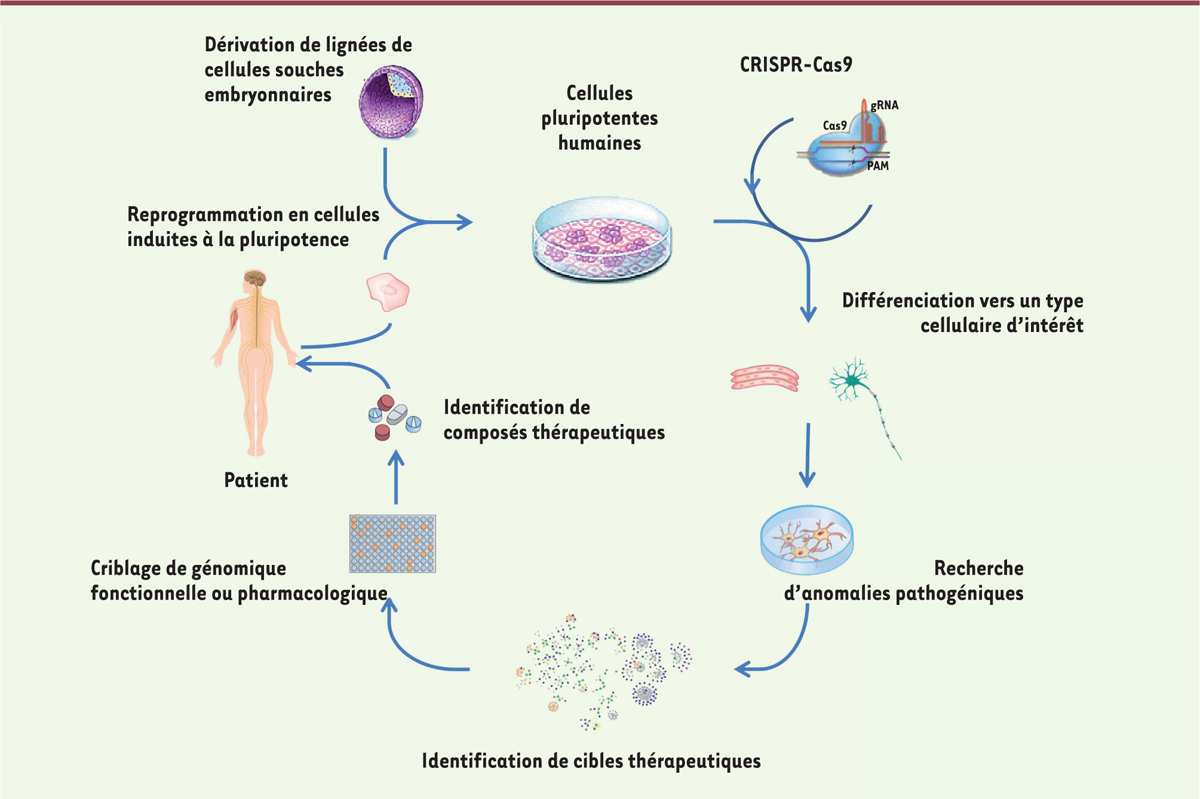
Le paradigme expérimental qui conduit jusqu’au stade d’identification de composé à potentiel thérapeutique a été progressivement validé par de nombreuses équipes (Figure 1). Il débute par l’obtention de lignées de cellules souches pluripotentes humaines, soit à partir du bourgeon embryonnaire au stade blastocyste [4], soit, depuis quelques années, par reprogrammation de cellules somatiques humaines en cellules induites à la pluripotence [5, 6]. Grâce à leurs potentiels uniques d’auto-renouvellement illimité et de pluripotence, ces lignées permettent aux chercheurs de disposer de lots homogènes de cellules de tout volume souhaité, différenciées à la demande dans les phénotypes d’intérêt [7] (→).
(→) Voir l’Éditorial de M. Peschanski, m/s n° 4, avril 2008, page 335
| Figure 1. Paradigme de l’utilisation des cellules souches pluripotentes humaines pour des approches de criblages thérapeutiques. Les cellules souches pluripotentes humaines permettent de modéliser les défauts cellulaires associés à des maladies génétiques. Celles-ci peuvent être dérivées à partir d’embryons dans le cas de maladies autorisées au diagnostic pré-implantatoire ou induites à la pluripotence à partir de cellules somatiques de patients (induced pluripotent stem cells, iPS). Il est également possible de créer ces modèles cellulaires par édition du génome à partir d’iPS saines. Grâce à leur potentiel d’auto-renouvellement et leur pluripotence, ces cellules permettent la production de lots homogènes de cellules différenciées vers un type cellulaire d’intérêt, utilisés pour de la modélisation pathologique et des approches de criblage de génomique fonctionnelle ou pharmacologique pour l’identification de composés thérapeutiques. |
Rapidement après l’ouverture de l’Institut I-Stem5 en 2005, nous avons obtenu plusieurs lignées importées de Suède et de Belgique, réputées normales et issues d’embryons surnuméraires de fécondation in vitro, ou porteuses d’une mutation responsable de la DM1 (à la suite d’un diagnostic pré-implantatoire (DPI) [8] (→).
(→) Voir l’article de B. Baertschi (Le diagnostic préimplantatoire [DPI] à l’ère de la médecine prédictive), page 72 de ce numéro
Depuis, ces ressources ont été complétées par des lignées iPS (Induced pluripotent stem cells) de cellules de patients DM1 reprogrammées. La première étape d’analyse a visé à vérifier l’adéquation du modèle cellulaire avec ce qui était connu des phénotypes pathologiques qui lui sont rattachés in vitro. Nous avons ainsi retrouvé les inclusions intranucléaires associées à la forme mutée du transcrit du gène DMPK (dystrophie myotonine protéine kinase) et les anomalies d’épissage qui en découlent [9]. Cette première étape a par ailleurs permis d’identifier des altérations moléculaires et cellulaires associées à la maladie jusque-là passées inaperçues [10, 11]. Nous nous sommes alors engagés dans la recherche de composés pharmacologiques possédant une action correctrice de ces anomalies, afin d’identifier des candidats-médicaments. Plusieurs techniques de criblage ont été utilisées, en particulier un crible de génomique fonctionnelle par ARN interférence ciblant un panel de facteurs d’épissage connus. Cette approche nous a permis d’identifier une protéine de fixation à l’ARN, ELAVL1 ([embryonic lethal, abnormal vision, Drosophila]-like 1 ou HuR), dont la perte d’expression induit une correction de plusieurs défauts d’épissage dérégulé dans la DM1 (sans qu’il existe une quelconque spécificité d’ELAVL1, également active dans des cellules non mutées). Sur la base de la littérature qui faisait de cette protéine une cible de l’AMPK (protéine kinase activée par l’AMP), nous avons alors réussi à mimer l’effet correcteur de l’ARN interférent ciblant le gène ELAVL1 sur l’épissage de plusieurs gènes affectés à l’aide d’activateurs de la kinase. Deux composés ont été identifiés : l’AICAR (5-aminoimidazole-4-carboxamide ribonucléotide), un agoniste direct puissant, mais inutilisable en clinique ; et la metformine, activateur indirect moins puissant, mais disposant d’une autorisation de mise sur le marché (dans le traitement du diabète de type II). L’effet bénéfique de ces molécules a été validé in vitro dans des myoblastes issus de patients [12]. L’effet biologique de la metformine sur la correction de certains épissages a été vérifié in vivo, d’abord chez la souris modèle DMSXL6, puis lors d’un essai clinique observationnel qui impliquait des patients diabétiques traités au long cours par ce médicament.
L’ensemble de ces résultats a conduit à la mise en place d’un essai clinique afin d’évaluer l’impact thérapeutique de la molécule ainsi « repositionnée7 » [13] (→) chez des patients atteints de DM1. L’essai clinique de phase II Myomet, randomisé, en double aveugle, a impliqué plusieurs équipes du CHU Henri-Mondor de Créteil. Il a mobilisé quarante patients adultes ambulatoires répartis en deux groupes égaux qui ont reçu soit la metformine (3 g/j), soit un placebo. L’effet de la metformine chez les patients DM1 a été évalué par le test de marche de six minutes schématisé dans la Figure 2, durant lequel le patient est appelé à marcher aussi vite qu’il le peut pendant 6 minutes en aller-retour sur un trajet de 25 mètres. Les patients étaient par ailleurs appareillés durant ce test avec un système Locometryx développé par l’équipe de Jean-Yves Hogrel (Institut de myologie, Paris) qui permettait, outre une grande précision sur les distances parcourues, une appréciation fine de la posture et de la puissance lors de la marche. Les résultats de cette étude ont révélé une amélioration significative de la mobilité des patients DM1 traités par la metformine par rapport au groupe contrôle [3]. Ce bénéfice est apparu dès la première évaluation intermédiaire, réalisée après 16 semaines de traitement, et a perduré au moins jusqu’au terme de l’étude (d’une durée d’un an). Les mécanismes moléculaires par lesquels la metformine améliore les capacités motrices des patients ne sont pas aisément identifiables en l’absence, notamment, de prélèvements tissulaires considérés comme trop invasifs. Sur le plan clinique, le seul paramètre pertinent dont l’amélioration intervenait en parallèle de celle de la marche était la posture, sans amélioration enregistrée ni sur la myotonie ni sur la force musculaire, ce qui suggère que l’augmentation du périmètre de marche était probablement plus liée à un changement qualitatif qu’à une modification quantitative.
(→) Voir l’Éditorial de C. Martinat et M. Peschanski, m/s n° 12, décembre 2018, page 1019
| Figure 2. Évolution de la distance parcourue au test de marche de 6 minutes des patients atteints de dystrophie myotonique de type 1 au cours des différentes visites de suivi de l’essai Myomet. A..Le test de marche des six minutes (six minutes walk test, 6MWT) est un test de terrain couramment utilisé pour évaluer la capacité fonctionnelle des patients. Le but de ce test est de définir le périmètre de marche maximal parcouru par le patient en 6 minutes. Ce test exige un parcours de 25 mètres, au calme, en intérieur, plat, idéalement dans un couloir rectangulaire rectiligne. Les instructions sont lues au patient en début de test. Durant l’effort, le patient peut ralentir, s’arrêter ou se reposer en s’appuyant contre un mur si nécessaire avant de reprendre la marche dès qu’il le peut. Les valeurs obtenues sont comprises entre 0 mètre pour une personne non ambulatoire et 800-900 mètres chez un sujet en bonne santé. B. Évolution moyenne (trait bleu) et variabilité (« boîtes à moustaches ») de la distance parcourue depuis l’inclusion à partir des résultats individuels (points) au jour 0 puis à 16, 28 et 52 semaines de traitement. |
Cette étude clinique monocentrique de phase II présente bien évidemment des limites caractéristiques des essais de phase précoce s’appuyant sur des échantillons de taille limitée, et ses résultats nécessitent confirmation, au mieux par un essai clinique multi-centrique de phase III doté d’une puissance statistique supérieure. Ces résultats sont cependant encourageants à double titre. D’une part en tant que première démonstration d’un effet pharmacologique significatif sur la mobilité de malades atteints de dystrophie myotonique. De l’autre, comme première validation chez l’homme, au travers d’un essai clinique standardisé, d’une hypothèse thérapeutique issue de la modélisation d’une pathologie génétique in vitro, grâce à des lignées de cellules souches pluripotentes. Au vu des multiples travaux de modélisation pathologique des maladies génétiques à l’aide de ces lignées, réalisés ou en cours, il n’y a que peu de doute que cette étude sera bientôt suivie de beaucoup d’autres.