| |
| Med Sci (Paris). 35(3): 201–203. doi: 10.1051/medsci/2019042.Production d’œstradiol par l’ovaire lors de la
mini-puberté Importance du dialogue entre les hormones FSH et
AMH Marie M. Devillers,1 Florence Petit,1 Victoria Cluzet,1 Charlotte M. François,1 Frank Giton,2 Ghislaine Garrel,1 Joëlle Cohen-Tannoudji,1 and Céline J. Guigon1* 1Sorbonne Paris Cité, Université Paris-Diderot, CNRS, Inserm,
Biologie fonctionnelle et adaptative UMR 8251, Physiologie de l’axe
gonadotrope U1133, 4, rue
M.A. Lagroua Weill-Hallé, 75013Paris,
France 2APHP CIB GHU sud Henri Mondor, Inserm IMRB U955, Eq.07, Faculté de
médecine, 51, avenue du
Maréchal de Lattre de Tassigny, 94010Créteil,
France MeSH keywords: Animaux, Hormone antimullérienne, Oestradiol, Femelle, Hormone folliculostimulante, Humains, Mammifères, Souris, Ovaire, Interactions entre récepteurs, Maturation sexuelle, Transduction du signal, métabolisme, physiologie |
Chez les mammifères, bien avant la puberté, juste après la naissance, lors de l’élévation
des niveaux des hormones gonadotropes hypophysaires LH (luteinizing
hormone) et FSH (follicle-stimulating hormone), l’ovaire
produit des quantités importantes d’œstradiol (abrégé par la suite en E2). Ces deux
hormones, LH et FSH, jouent un rôle essentiel à l’âge adulte dans le contrôle de
l’ovulation à chaque cycle sexuel. La FSH stimule la croissance terminale des follicules
ovariens et la production d’E2 par les follicules à partir du stade antral1,. La décharge ovulante de LH permet, au moment de
l’ovulation, l’expulsion de l’ovocyte hors du follicule. L’élévation marquée des
hormones gonadotropes et de l’E2 après la naissance a conduit à nommer cette période «
mini-puberté de l’enfance ». Cette production d’E2 paraît jouer un rôle déterminant dans
la programmation2 de la fertilité, en particulier
pour le déclenchement de la puberté. Malgré l’importance pour la fertilité de
l’activation physiologique de l’ovaire lors de la mini-puberté, les mécanismes
sous-jacents ne sont pas bien connus. Par des études menées récemment in
vivo chez la souris et en culture organotypique d’ovaires, nous avons
montré le rôle essentiel de LH et de FSH dans ce processus [1]. En particulier, l’élévation importante de la
FSH, dont les concentrations deviennent à ce moment cinq fois supérieures à celles
trouvées chez la femelle adulte, permet l’expression de l’aromatase3, (dont le gène est nommé Cyp19a1) par les
follicules en croissance les plus matures situés au centre de l’ovaire. Dans ce
contexte, avec ces niveaux de FSH élevés, il n’y a pas d’induction de l’expression de la
cycline D2, un facteur clé stimulant la prolifération des cellules de la granulosa4. Ainsi les concentrations élevées de FSH stimulent
la synthèse d’E2 par l’ovaire durant cette période sans toutefois entraîner un
développement exacerbé des follicules ovariens. Ces données laissent supposer que
l’activation précoce de l’axe gonadotrope pourrait jouer un rôle dans la programmation
de la fertilité sans entraîner d’ovulation prématurée. |
Quel est le rôle de l’hormone anti-müllerienne dans l’ovaire au cours de la
mini-puberté ? Dans cette étude, nous avons évalué le rôle de l’hormone anti-müllerienne (AMH) dans
l’activité stéroïdogène de l’ovaire lors de la mini-puberté. Cette glycoprotéine de
la famille du TGF-β (transforming growth factor-β) a d’abord été
identifiée pour son rôle dans la différenciation sexuelle mâle car elle participe à
la régression des canaux de Müller [2, 3]
(→).
(→) Voir la Nouvelle de G. Garrel et al.,
m/s n° 12, décembre 2016, page 1076
Plus récemment, il a été montré que l’AMH était également produite par les cellules
de la granulosa dès l’entrée en croissance des follicules. Son expression atteint un
pic au stade préantral, puis décroît dans les follicules antraux. L’AMH inhibe le
recrutement des follicules primordiaux, régulant ainsi l’initiation de la croissance
folliculaire [4]. De plus,
elle diminue la sensibilité à la FSH des follicules préantraux, ce qui empêche leur
croissance prématurée et l’expression de l’aromatase [4]. Nos travaux ont montré que l’AMH était exprimée dans l’ovaire de souris avant la
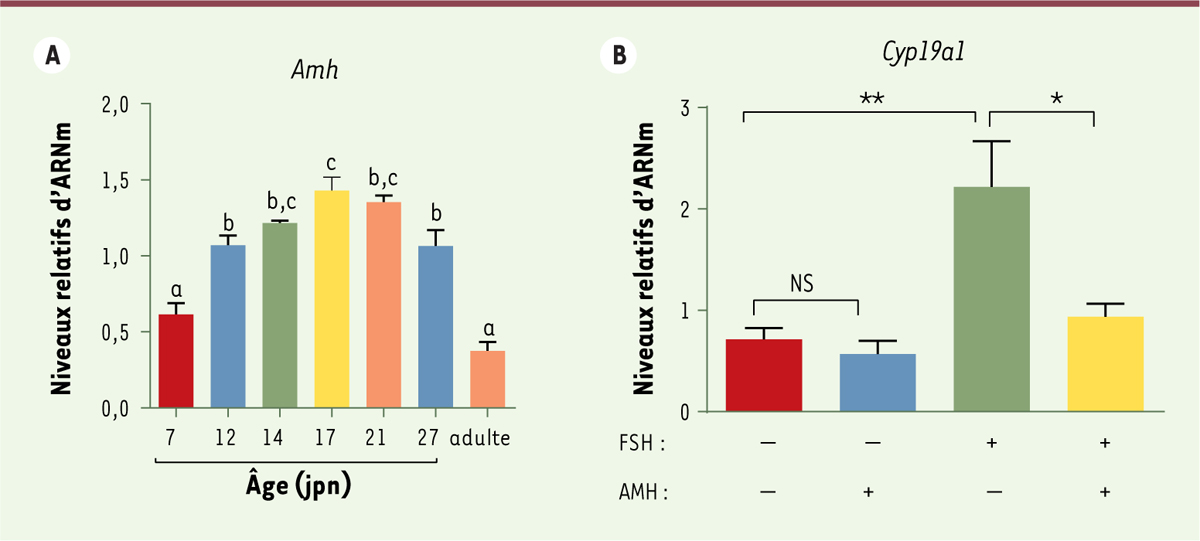
puberté (Figure 1A), comme
chez l’humain et chez d’autres espèces de mammifères [1, 5]. Pour
étudier l’action de l’AMH lors de cette période, nous avons effectué des cultures
organotypiques d’ovaires de souris au stade mini-puberté (12-14 jours postnatals
[jpn]) [6]. Les ovaires ont
été traités par l’AMH en présence de fortes concentrations de FSH mimant ses niveaux
circulants in vivo. Nos résultats ont permis de montrer que l’AMH
freinait considérablement l’induction de l’aromatase par la FSH (Figure 1B). Ainsi, au cours de cette
période, l’AMH présente le même effet inhibiteur sur l’aromatase que dans l’ovaire
adulte.
 | Figure 1. L’AMH est synthétisée par l’ovaire avant la puberté et
inhibe ex vivo l’expression de l’aromatase
(Cyp19a1) induite par la FSH. A. Les ovaires de
souris femelles ont été collectés aux 7e, 12e,
14e, 17e, 21e et 27e
jours postnatals (jpn) et à l’âge adulte. L’abondance relative des
transcrits de l’Amh (hormone anti-müllerienne) a été
mesurée par PCR (polymerase chain reaction)
quantitative en temps réel et rapportée à celle des transcrits d’un gène
de ménage (Hprt, hypoxanthine
phosphoribosyltransferase). Chaque valeur représente la moyenne
± SEM (erreur standard moyenne) de 6 à 7 ovaires par âge. Des lettres
distinctes montrent des différences significatives obtenues par le test
non paramétrique de Kruskal-Wallis. B. Des
ovaires de souris femelles ont été collectés à 12 jours postnatal et mis
en culture sur des inserts avant d’être traités ou non par de la FSH
(follicle-stimulating hormone) à une concentration
mimant celle de la mini-puberté (500 ng/ml) et/ou de l’AMH (400 ng/ml).
L’abondance relative des transcrits de l’aromatase
(Cyp19a1) a été obtenue par RT-PCR (reverse
transcriptase - polymerase chain reaction) quantitative en
temps réel après normalisation par rapport aux transcrits d’un gène de
ménage (Hprt). Chaque valeur représente la moyenne ±
SEM (erreur standard moyenne) de 4 à 14 ovaires provenant de souris
différentes par groupe de traitement. Données analysées par le test
paramétrique « one-way ANOVA » avec *,
P < 0,05 ; **, P < 0,01. NS,
non significatif. |
|
Les niveaux élevés de FSH répriment l’expression de l’AMH au cours de la
mini-puberté Comment, dès lors, réconcilier le fait que, dans cette période, l’ovaire produit de
fortes quantités d’E2 malgré la présence d’AMH ? Nos travaux ont montré que
l’expression de l’AMH et de l’aromatase s’excluent mutuellement dans les follicules
en croissance : l’AMH est en effet exprimée très faiblement dans les follicules qui
expriment l’aromatase et qui sont réceptifs à l’action de la FSH [1]. La FSH régule l’expression de l’AMH dans
l’ovaire adulte [7]. Nous
avons donc cherché à comprendre si, pendant la mini-puberté, la FSH pouvait être
responsable de cette perte d’expression de l’AMH. Pour cela, nous avons fait varier,
à la fois in vivo et en culture organotypique, l’exposition des
ovaires à la FSH [6]. Des souris de 12-14 jpn
ont été traitées par le ganirelix, un antagoniste du récepteur de la GnRH
(gonadotropin-releasing hormone), afin de diminuer les
concentrations circulantes des gonadotropines (d’environ 80 % pour la FSH circulante
et de 95 % pour la LH [1]). L’analyse des
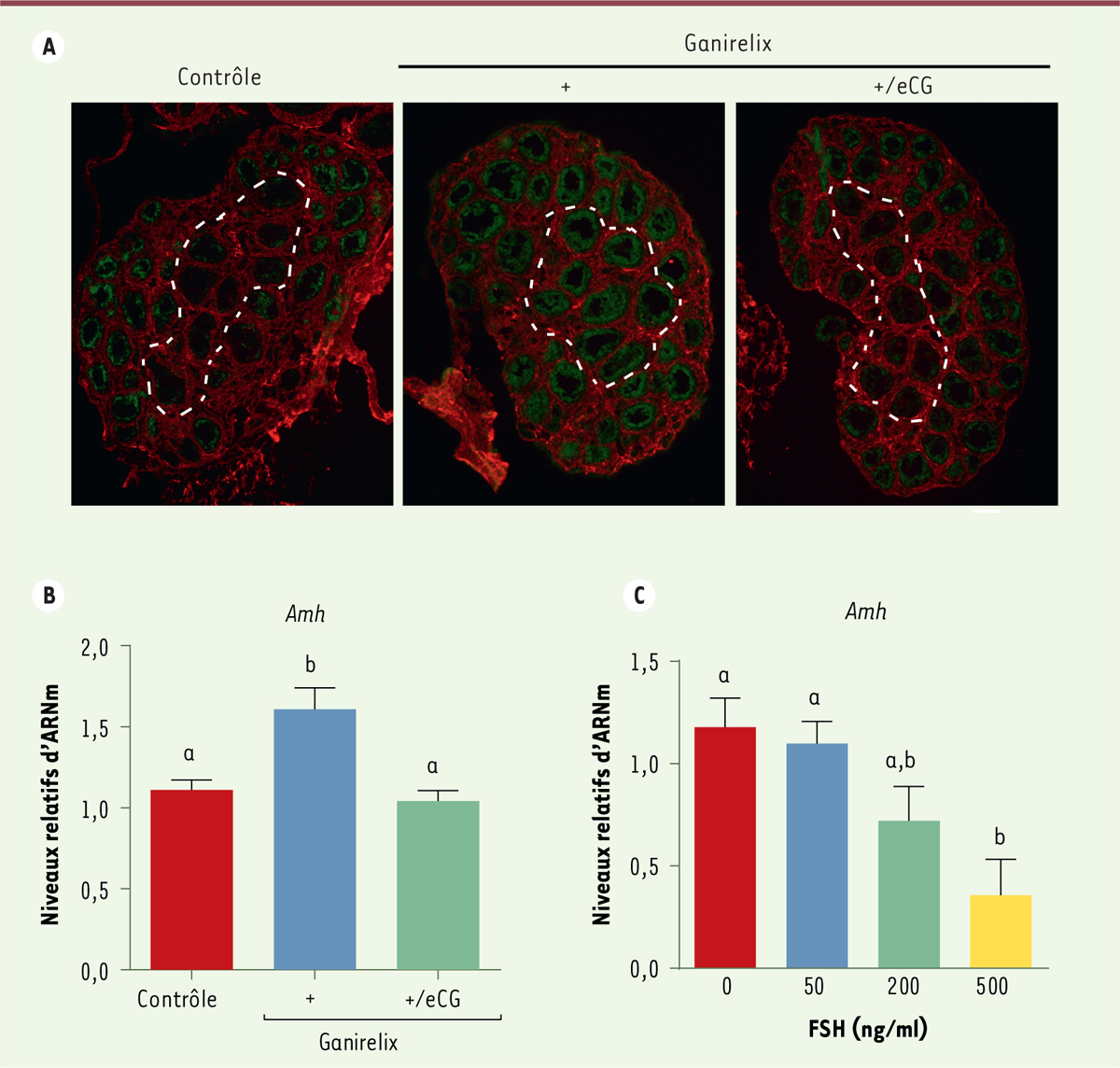
transcrits de l’AMH a montré que ce traitement augmente leur expression dans les
follicules les plus matures situés au centre de l’ovaire (Figure 2A et B). La supplémentation de ces souris avec de la
gonadotropine chorionique équine (eCG), qui reproduit l’action de la FSH chez les
rongeurs, empêche l’expression de l’AMH dans ces follicules (Figure 2A et B). Les études menées sur des ovaires cultivés en présence
de FSH à une concentration faible, moyenne ou mimant celle de la mini-puberté
montrent un effet inhibiteur dose-dépendant de la FSH sur l’expression des
transcrits de l’AMH (Figure
2C).
 | Figure 2. Les concentrations élevées de FSH de la minipuberté
diminuent le niveau d’expression de l’AMH dans
l’ovaire. A. Distribution des transcrits de
l’Amh (hormone anti-müllerienne) dans des ovaires
de femelles contrôles ou traitées par un antagoniste de la GnRH
(gonadotropin- releasing hormone), le ganirelix (10
μg), à 12 et 13 jpn (jours postnatals) et supplémentées ou non en
gonadotropine chorionique équine (eCG, 5 UI) à 13 jpn. Détection des
transcrits par hybridation in situ avec une sonde dirigée contre
l’Amh (coloration violette convertie digitalement
en vert) et délimitation des follicules par immunodétection de la
fibronectine (fluorescence rouge). Les zones délimitées par des
pointillés indiquent l’emplacement des follicules les plus matures.
Barre d’échelle : 100 μm. B. Abondance relative des transcrits de l’Amh
dans les ovaires de femelles contrôles ou traitées par le ganirelix et
supplémentées ou non en eCG, obtenue par RT-PCR (reverse
transcriptase - polymerase chain reaction) quantitative en
temps réel après normalisation par rapport aux transcrits d’un gène de
ménage (Hprt, hypoxanthine phosphoribosyltransferase).
Chaque valeur représente la moyenne ± SEM de 7 à 9 ovaires par groupe de
traitement. Des lettres distinctes montrent des différences
significatives obtenues par le test paramétrique « one-way
ANOVA ». C. Des ovaires de souris ont été collectés à 12
jours postnatals et mis en culture sur des inserts avant d’être traités
par des concentrations croissantes de FSH (follicle-stimulating
hormone) purifiée (50 à 500 ng/ml). L’abondance relative
des transcrits de l’Amh a été obtenue par RT-PCR
quantitative en temps réel après normalisation par rapport aux
transcrits d’un gène de ménage (Hprt). Chaque valeur
représente la moyenne ± SEM de 7 à 12 ovaires par groupe de traitement.
Des lettres distinctes montrent des différences significatives obtenues
par le test paramétrique « one-way ANOVA ». |
|
Cette étude révèle que les hauts niveaux de FSH de la mini-puberté répriment
l’expression de l’AMH dans les follicules les plus matures, levant ainsi le frein
inhibiteur de l’AMH sur la stéroïdogenèse [6].
Il est intéressant de mettre en perspective cette étude avec des résultats récents
montrant que l’AMH stimule, d’une part, la sécrétion hypophysaire de FSH chez la
femelle lors de la mini-puberté [8] et, d’autre part, la production de LH par l’hypophyse, en agissant
sur les neurones à GnRH hypothalamiques [9, 10]
(→).
(→) Voir la Nouvelle de S. Catteau-Jonard et al,
m/s n° 5, mai 2016, page 441
L’AMH, en ciblant chacun des composants de l’axe gonadotrope lors de la mini-puberté,
serait ainsi un acteur central de la programmation de la vie reproductive. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. François
CM,
Petit
F,
Giton
F, et al.
A novel action of follicle-stimulating hormone in the ovary
promotes estradiol production without inducing excessive follicular growth
before puberty . Sci Rep.
2017; ; 7 : :46222.. 2. Josso
N,
Picard
JY,
Rey
R, et al.
Testicular anti-Müllerian hormone: history, genetics, regulation
and clinical applications . Pediatr Endocrinol
Rev.
2006; ; 3 :
:347.–358. 3. Garrel
G,
Racine
C,
L’Hôte
D, et al.
L’hormone anti-müllérienne : un nouveau régulateur des cellules
gonadotropes hypophysaires. Implication dans le dimorphisme sexuel de
l’activité gonadotrope avant la puberté . Med Sci
(Paris).
2016; ; 32 :
:1076.–1078. 4. Durlinger
ALL,
Visser
JA,
Themmen
APN. Regulation of
ovarian function: the role of anti-Müllerian hormone .
Reproduction.
2002; ; 124 :
:601.–609. 5. Kuiri-Hänninen
T,
Sankilampi
U,
Dunkel
L. Activation of the
hypothalamic-pituitary-gonadal axis in infancy: minipuberty .
Horm Res Paediatr.
2014; ; 82 :
:73.–80. 6. Devillers
MM,
Petit
F,
Cluzet
V, et al.
FSH inhibits AMH to support ovarian estradiol synthesis in
infantile mice . J. Endocrinol.
2019; ; 240 :
:1.–14. 7. Dewailly
D,
Robin
G,
Peigne
M, et al.
Interactions between androgens, FSH, anti-Müllerian hormone and
estradiol during folliculogenesis in the human normal and polycystic
ovary . Hum Reprod. Update.
2016; ; 22 :
:709.–724. 8. Garrel
G,
Racine
C,
L’Hôte
D, et al.
Anti-Müllerian hormone: a new actor of sexual dimorphism in
pituitary gonadotrope activity before puberty . Sci
Rep.
2016; ; 6 : :23790.. 9. Cimino
I,
Casoni
F,
Liu
X, et al.
Novel role for anti-Müllerian hormone in the regulation of GnRH
neuron excitability and hormone secretion . Nat
Commun.
2016; ; 7 : :10055.. 10. Catteau-Jonard
S,
Dewailly
D,
Prévot
V, et al.
L’hormone anti-müllerienne - Une hormone ovarienne exerçant une
rétroaction hypothalamique ? . Med Sci
(Paris).
2016; ; 32 :
:441.–444. |