La fonction première du système immunitaire est de protéger l’organisme des agents infectieux et de détecter les tumeurs, mais il n’est pas infaillible et peut être diverti, prenant pour cible des cellules saines et conduisant au développement de maladies auto-immunes. De telles réponses auto-immunes peuvent affecter quasiment tous les tissus. Dans le système nerveux central, des réactions auto-immunes pathogènes, ciblant spécifiquement diverses molécules, ont été décrites ces dernières années. Ces découvertes ont dynamisé le domaine de la neuro-immunologie [1]. L’origine de la narcolepsie, une pathologie chronique du sommeil, est un mystère médical de longue date. Dans un article publié tout récemment dans Nature, Sallusto et ses collaborateurs [2] démontrent que les patients atteints de narcolepsie présentent dans leur sang une proportion anormalement élevée, d’un type de cellules immunitaires, les lymphocytes T CD4+ capables de reconnaître des protéines neuronales appelées auto-antigènes.
La narcolepsie est une neuropathologie relativement rare (sa prévalence est d’environ 1/2 000), mais elle est probablement sous-diagnostiquée. Les premiers signes de la maladie apparaissent généralement à l’adolescence ou chez le jeune adulte et persistent toute la vie. Les symptômes classiques sont des épisodes irrésistibles de sommeil en journée (narcolepsie) associés à des pertes soudaines et brèves du tonus musculaire pendant l’éveil pouvant entraîner des chutes (cataplexies). Un premier progrès dans la recherche sur la narcolepsie fut la démonstration qu’une petite population de neurones localisée dans l’hypothalamus produit deux peptides appelés hypocrétine (ou oréxine) qui agissent comme neurotransmetteurs contrôlant les cycles veille-sommeil. En effet, des défauts génétiques affectant la production d’hypocrétine, ou la réponse à ces peptides, conduisent à un phénotype proche de la narcolepsie dans des modèles animaux. Les cerveaux de patients atteints de narcolepsie présentent une perte sélective et marquée en neurones hypocrétinergiques [3]. Un test diagnostique spécifique pour la narcolepsie de type 1 (narcolepsie avec cataplexie et production abaissée ou absente d’hypocrétine) a ainsi été développé sur la base du dosage de la concentration d’hypocrétine dans le liquide céphalo-rachidien (LCR) [4]. La narcolepsie peut donc être considérée comme une maladie neuro-dégénérative focalisée.
La seconde avancée dans la recherche sur la narcolepsie fut l’identification d’un lien entre le développement de cette pathologie et le système immunitaire. En effet, des études génétiques ont révélé une association extrêmement forte entre le développement de cette pathologie et l’expression de certains allèles du complexe majeur d’histocompatibilité (CMH ou chez l’homme, HLA [human leukocyte antigen]). Les gènes codant les molécules HLA sont portés par une région du chromosome 6. Celles-ci sont constituées de molécules de classe II et de classe I qui interviennent, respectivement, dans l’activation de lymphocytes T auxiliaires (CD4) ou cytotoxiques (CD8). À la surface des cellules présentatrices d’antigènes, les molécules du CMH sont associées aux peptides antigéniques qui seront reconnus par des lymphocytes T spécifiques de l’antigène. Leur polymorphisme, fonction de l’individu, a un impact sur l’amplitude et la qualité de la réponse immunitaire vis-à-vis de tel ou tel peptide antigénique. Plus de 98 % des patients atteints de narcolepsie de type 1 sont porteurs de l’allèle HLA-DQB1*06:02, contre 15 à 30 % (selon l’origine ethnique) dans la population générale, ce qui a conduit à proposer que cet allèle favorisait la présentation d’auto-antigène(s) impliqué(s) dans l’activation de lymphocytes T CD4+ auto-réactifs pathogènes dans la narcolepsie de type 1. Il est à noter que la plupart des maladies auto-immunes présentent une telle association avec des allèles HLA [5]. Des études d’association couvrant tout le génome ont révélé d’autres gènes, également impliqués dans la fonction du système immunitaire, qui sont significativement associés à la susceptibilité à la narcolepsie de type 1. Parmi ceux-ci, citons les gènes codant des molécules HLA de classe I, essentielles pour la présentation de l’antigène aux lymphocytes T CD8+ cytotoxiques, ou codant le récepteur des lymphocytes T (TCR) permettant la reconnaissance de l’antigène par ces cellules. L’hypothèse d’un rôle majeur du système immunitaire dans la physiopathologie de la narcolepsie de type 1 est renforcée par des études épidémiologiques convergentes révélant un risque accru de développer une narcolepsie à la suite d’une vaccination (par le Pandemrix) contre le virus influenza H1N1 pandémique de 2009 [6] (→).
(→) Voir la Synthèse de L. Jacob et Y. Dauvilliers, m/s n° 12, décembre 2014, page 1136
La narcolepsie de type 1 est ainsi considérée actuellement comme une pathologie neuro-dégénérative focale due à une réponse immunitaire inappropriée. Mais comment le système immunitaire contribue à la disparition des neurones hypocrétinergiques dans la narcolepsie reste un mystère non résolu malgré des études suggérant la présence d’auto-anticorps sériques [7]. Dans leur étude, Sallusto et al. proposent de répondre à cette question en utilisant des techniques de pointe permettant d’identifier des populations rares de lymphocytes T spécifiques d’antigènes [2]. Les auteurs ont dans un premier temps évalué si des lymphocytes T reconnaissant la protéine précurseur de l’hypocrétine pouvaient être détectés dans le sang de 19 patients narcoleptiques et de 13 sujets témoins exprimant l’allèle HLA-DQB1*06:02 mais exempts de narcolepsie. Après avoir montré que les lymphocytes T CD4+ des patients narcoleptiques, et non ceux des témoins, reconnaissaient des peptides issus de l’hypocrétine, les auteurs ont utilisé une méthode très sensible pour déterminer la fréquence de ces lymphocytes T spécifiques d’auto-antigène et l’amplitude de leurs réponses. La fréquence des lymphocytes T CD4+ spécifiques de l’hypocrétine est 10 à 20 fois supérieure chez les patients narcoleptiques comparativement à des sujets témoins. Cette réactivité accrue du système immunitaire, décrite dans cette étude et également dans une étude indépendante [8], vis-à-vis d’un auto-antigène très exprimé par les neurones cibles suggère fortement l’origine auto-immune de la narcolepsie. Les auteurs ont finement étudié ces lymphocytes T CD4+ auto-réactifs, ce qui a conduit à l’identification des peptides de l’hypocrétine reconnus, le séquençage des chaînes b du TCR qui assure cette reconnaissance, à l’identification des molécules HLA impliquées dans la présentation des peptides et à l’analyse des propriétés fonctionnelles de ces lymphocytes T CD4+ auto-réactifs, qui produisent de l’interféron-g et du GM-CSF (granulocyte-macrophage colony-stimulating factor).
Cette étude met en évidence un certain nombre d’observations intrigantes. En effet, malgré le lien génétique établi entre pathologie et présence de l’allèle HLA-DQB1*06:02, la plupart des clones de lymphocytes T CD4+ des patients ne reconnaissent pas les peptides de l’hypocrétine en association avec la molécule HLA-DQ6 (codée par le gène HLA-DQB1*06:02), mais plutôt lorsqu’ils sont associés avec les molécules HLA-DR codées par les gènes du locus HLA-DQB1 situé à proximité. Plusieurs explications peuvent être proposées : (1) l’allèle HLA-DQB1*06:02 participerait à la sélection d’un répertoire de lymphocytes T CD4+ restreints par les molécules HLA-DR au cours du développement thymique [9] ; (2) la réponse des lymphocytes T CD4+ à l’origine de l’affection serait initialement générée par la reconnaissance des peptides en association avec les molécules HLA-DQ6 (ce que l’on qualifie de restriction HLA-DQ6), alors que la réponse auto-réactive ultérieure serait restreinte par les molécules HLA-DR. La fréquence accrue de lymphocytes T CD4+ spécifiques de peptides de l’hypocrétine présentés par HLA-DQ6 chez les patients en début de maladie, rapportée dans une étude indépendante, est ainsi compatible avec ce scénario [8] ; (3) les lymphocytes T circulants présenteraient une restriction par des molécules HLA différentes des lymphocytes tissulaires.
Une autre découverte inattendue est qu’une large majorité des lymphocytes T CD4+ auto-réactifs prolifèrent en réponse aux différents peptides dérivés de l’hypocrétine. Ceci suggère que l’hypocrétine nécessite d’être clivée, soit dans le milieu extracellulaire soit dans les neurones, afin d’être présentée sous forme de peptides par les cellules présentatrices d’antigènes. Cet apprêtement particulier caractérise une classe d’auto-antigènes pour lesquels la tolérance immune naturelle pourrait être imparfaite. Des modifications post-transcriptionnelles des peptides issus de l’hypocrétine seraient également essentielles à leur reconnaissance par les lymphocytes T CD4+ auto-réactifs [8]. La réponse à l’hypocrétine pourrait, alternativement, être induite par mimétisme moléculaire du fait de la large réaction croisée qui caractérise la reconnaissance antigénique par le récepteur des lymphocytes T [10]. Des études ultérieures, utilisant des multimères HLA : peptide pour identifier et isoler les lymphocytes T CD4+ auto-réactifs et analyser leurs profils moléculaires, permettront de résoudre cette question.
Une autre donnée intéressante concerne l’absence de réaction croisée des lymphocytes T CD4+ auto-réactifs vis-à-vis des antigènes du vaccin contre la grippe. La question du lien biologique entre vaccination et développement, rare mais frappant, de narcolepsie après vaccination H1N1 de 2009, reste donc sans réponse [6]. D’autres populations de lymphocytes T pourraient être responsables des cas post-vaccinaux observés. Pour répondre à cette question, des études dédiées à ce sous-groupe de patients seront nécessaires.
Le travail de Federica Sallusto et de ses collègues apporte une analyse approfondie de la réponse des lymphocytes T contre certains auto-antigènes candidats dans la narcolepsie [2]. Néanmoins, plusieurs questions clés persistent : les lymphocytes T CD4+ auto-réactifs circulants sont-ils impliqués dans la physiopathologie de la narcolepsie ? Y a-t-il d’autres auto-antigènes que l’hypocrétine reconnus par les lymphocytes T dans la narcolepsie ? Les auto-anticorps et les lymphocytes T CD8+ auto-réactifs participent-ils aux mécanismes lésionnels ? Y a-t-il un défaut quantitatif ou qualitatif de lymphocytes T régulateurs (Treg) dans cette affection, cette population de lymphocytes T ayant pour rôle d’empêcher l’activation de lymphocytes T auto-réactifs pathogènes ?
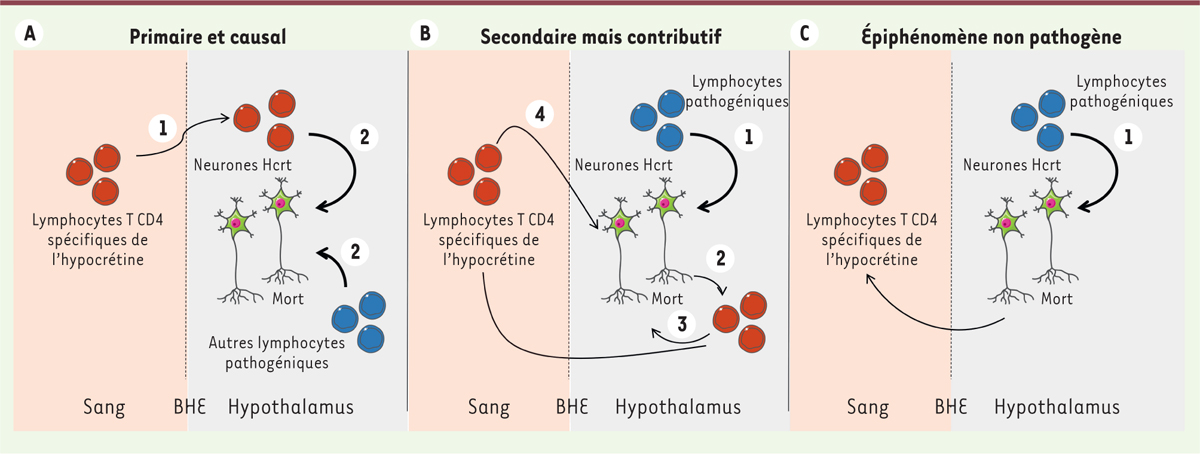
L’établissement d’une relation de causalité entre les lymphocytes T auto-réactifs identifiés dans cette étude et la pathologie reste une question clé car il identifierait de nouvelles cibles thérapeutiques. Trois hypothèses quant au rôle de ces lymphocytes T auto-réactifs reconnaissant l’hypocrétine (soit primaire et causal, soit secondaire mais contributif, soit enfin épiphénomène non pathogène) sont décrites dans la Figure 1. L’absence d’information sur la nature du processus inflammatoire dans l’hypothalamus lors de l’apparition ou au pic de la maladie participe au mystère. Federica Sallusto et ses collègues fournissent un premier élément de réponse par l’identification de lymphocytes T CD8+ spécifiques de l’hypocrétine dans le LCR d’un patient, mais des études complémentaires analysant leur enrichissement local par rapport au sang seraient utiles [2]. La détection de lymphocytes T spécifiques de l’hyprocrétine chez au moins deux patients négatifs pour l’allèle HLA-DQB1*06:02 et atteints de narcolepsie de type 2, et chez lesquels aucune diminution de sécrétion d’hypocrétine n’est observée, remet en question l’implication directe de ces cellules dans la destruction neuronale. Des études longitudinales, initiées idéalement dès le début de la maladie, devraient apporter des données complémentaires quant à l’association temporelle entre l’apparition de lymphocytes T auto-réactifs et le développement de la pathologie. Bien que l’observation mérite d’être reproduite et étendue, des lymphocytes T CD8+ spécifiques de l’hypocrétine ont été détectés à une fréquence relativement élevée dans le sang d’un patient chez lequel la destruction des neurones hypocrétinergiques paraissait évolutive [2]. Ces données résonnent avec celles obtenues dans un modèle animal révélant le potentiel destructeur direct de lymphocytes T CD8+ auto-réactifs vis-à-vis des neurones hypocrétinergiques [11]. Le transfert de lymphocytes T auto-réactifs isolés de patients chez la souris, ou l’utilisation d’un modèle de souris humanisées exprimant un TCR humain spécifique, aiderait à la compréhension de leur potentiel rôle pathogène [5, 12].
| Figure 1. Trois niveaux d’implication possible dans la pathogénèse de la
narcolepsie. A. Les lymphocytes T CD4+
auto-réactifs (cellules rouges) détectés dans le sang des patients atteints
de narcolepsie sont les principales cellules impliquées dans la mort
neuronale, directement ou indirectement. D’autres cellules pathogènes du
système immunitaire, telles que les lymphocytes T CD8+
cytotoxiques et les lymphocytes B producteurs d’anticorps (cellules bleues),
pourraient aussi contribuer à la physiopathologie [3]. BHE : barrière hémato-encéphalique ; Hcrt :
hypocrétinergique. B. La présence de
lymphocytes T CD4+ auto-réactifs dans le sang des patients
atteints de narcolepsie est secondaire à la destruction neuronale ;
néanmoins, ces cellules contribuent à la physiopathologie de la narcolepsie.
La mort des neurones hypocrétinergiques serait due à d’autres cellules
immunitaires pathogènes. La libération d’auto-antigènes par les neurones
mourants permettrait alors le recrutement d’une nouvelle vague de
lymphocytes T auto-réactifs maintenant ainsi la pathologie, un phénomène
appelé diversification épitopique (epitope spreading).
C. Les lymphocytes T CD4+
auto-réactifs sont secondaires à la pathologie et non pathogènes. Ils
peuvent également être sans relation avec la pathologie, par exemple, la
conséquence d’une insuffisance chronique en hypocrétine sur le système
immunitaire ou d’une perturbation sévère de l’horloge biologique. |
Si le lien causal entre la réactivité augmentée des lymphocytes T à l’hypocrétine et les dommages neuronaux est confirmé, l’étude de l’équipe de Federica Sallusto représenterait une avancée dans la compréhension de la narcolepsie, incitant à mettre au point des immunothérapies ciblées pour les patients en début ou au pic de la pathologie, dans la ligne des immunothérapies actuellement développées pour les patients atteints d’autres affections auto-immunes spécifiques d’organe.