| |
| Med Sci (Paris). 35(3): 207–209. doi: 10.1051/medsci/2019043.L’élimination des macrophages tumoraux Une voie pour améliorer l’efficacité de l’immunothérapie
anticancéreuse Elisa Peranzoni1,2,3,4 and Emmanuel Donnadieu1,2,3* 1Inserm, U1016, Institut Cochin, 22, rue Méchain, 75014Paris,
France 2CNRS, UMR8104, Paris, France 3Université Paris Descartes, Sorbonne Paris
Cité, Paris, France 4Institut de Recherches Servier, 125, Chemin de Ronde, 78290Croissy-sur-Seine,
France MeSH keywords: Antinéoplasiques immunologiques, Vaccins anticancéreux, Association thérapeutique, Humains, Immunothérapie, Facteur de stimulation des colonies de macrophages, Macrophages, Thérapie moléculaire ciblée, Tumeurs, Résultat thérapeutique, administration et posologie, méthodes, antagonistes et inhibiteurs, immunologie, effets des médicaments et substances chimiques, anatomopathologie, physiologie, thérapie |
Les immunothérapies sont une véritable révolution thérapeutique en cancérologie comme
l’atteste l’attribution du prix de Nobel de physiologie ou médecine 2018 à James Allison
et Tasuku Honjo. L’objectif de cette stratégie est d’activer, de façon efficace et
ciblée, le système immunitaire du patient chargé de détruire les cellules tumorales,
notamment les lymphocytes T cytotoxiques. Cela peut se faire, par exemple, par
administration d’anticorps monoclonaux, tels que les anti-PD1 (programmed cell
death 1). Dans plusieurs cancers, comme le mélanome, les résultats
cliniques sont extrêmement prometteurs et parfois mêmes très spectaculaires, avec des
guérisons de malades comme nous ne l’avions jamais observé auparavant. Mais ces
stratégies ne bénéficient pas à tous les patients : une proportion de patients
(inférieure à 30 %) atteints de mélanome, de cancers du poumon et de cancers du rein,
répond aux anticorps anti-PD-1, mais d’autres cancers et notamment ceux de la prostate
et du pancréas sont pour le moment réfractaires à ces traitements. Les recherches
actuelles se concentrent donc sur l’identification des différents obstacles à l’action
anti-tumorale des lymphocytes T cytotoxiques afin de les contourner et de proposer des
voies de traitement contre le cancer plus performantes et plus générales [1]. |
Les lymphocytes T sont rarement capables d’atteindre les cellules
cancéreuses Pour que le lymphocyte T cytotoxique accomplisse sa fonction, il doit reconnaître et
répondre correctement à des antigènes tumoraux qui sont exprimés à la surface de la
cellule cancéreuse. Certaines tumeurs accumulent peu de mutations ; elles ne sont
donc pas ou peu reconnues par les lymphocytes T. Les tumeurs constituent également
un environnement particulièrement hostile à l’action anti-tumorale des lymphocytes
T. Outre PD-1, d’autres molécules sont susceptibles d’empêcher les lymphocytes T
d’attaquer la tumeur. Par ailleurs, une activité destructrice des lymphocytes T
envers la tumeur n’est pas suffisante. Comme le montre la
Figure 1, la capacité des
lymphocytes T à former un contact avec la cellule maligne dépend en effet de
plusieurs étapes durant lesquelles ces cellules se déplacent activement [2]. Comme pour toute réponse
immunitaire, la première étape se déroule dans le ganglion le plus proche de la
tumeur, le ganglion drainant. Dans cet organe, des lymphocytes T CD8 naïfs qui
reconnaissent un antigène tumoral présenté à la surface d’une cellule dendritique
vont subir un changement d’état leur permettant d’acquérir leurs fonctions
cytotoxiques, mais également des capacités à migrer très spécifiquement vers la
tumeur. Ces lymphocytes vont ensuite pénétrer dans les tumeurs en traversant les
vaisseaux sanguins puis successivement naviguer dans le stroma tumoral, entrer en
contact avec des cellules et des composants du stroma, et finalement, interagir avec
la cellule cancéreuse afin de la détruire. Chez certains patients atteints de
cancers, il est désormais admis qu’une, voire plusieurs de ces étapes, ne
s’effectuent pas normalement [3]. Premièrement, l’entrée des lymphocytes T dans les tumeurs est
souvent défectueuse, liée à des anomalies des vaisseaux sanguins des tumeurs et à
l’expression altérée de certaines molécules d’adhérence. Cependant, même lorsque les
lymphocytes T parviennent à infiltrer les tumeurs, ils sont rarement en contact avec
les cellules tumorales, mais s’accumulent dans le stroma (Figure 2) [4, 5] (→).
(→) Voir la Nouvelle de H. Salmon et E. Donnadieu, m/s n° 10,
octobre 2012, page 824
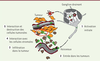 | Figure 1. Migration des lymphocytes T au cours d’une réponse
antitumorale. Pour atteindre la cellule
cancéreuse, les lymphocytes T doivent franchir différentes étapes durant
lesquelles ils se déplacent activement. Dans un premier temps, ils
migrent du ganglion drainant vers la tumeur
(1). Puis, ils vont traverser les
vaisseaux sanguins de cette dernière (2)
et se déplacer dans le stroma (3-4).
Enfin, ils pourront éventuellement entrer en contact avec la cellule
cancéreuse avant de la détruire (5). |
 | Figure 2. Distribution des lymphocytes T, des macrophages et des
cellules tumorales dans une tumeur pulmonaire
humaine. Les cellules tumorales (bleu) s’organisent
en îlots compacts entourés de lymphocytes T (vert) et de macrophages
(rouge) (échelle : 100 μm). |
Ce défaut d’interaction entre lymphocytes et cellules malignes pourrait contribuer à
expliquer pourquoi certaines immunothérapies anticancéreuses ne donnent pas toujours
les résultats attendus. D’ailleurs, des essais cliniques indiquent que chez les
patients qui répondent bien aux anticorps anti-PD-1, les tumeurs, avant le
traitement, sont enrichies en lymphocytes T CD8 en contact avec des cellules
tumorales. À l’inverse, chez certains patients réfractaires à ces stratégies, les
tumeurs contiennent bien des lymphocytes T CD8, mais ces derniers sont localisés en
dehors des amas tumoraux [6]. L’enjeu des recherches actuelles vise à identifier les mécanismes à l’origine de
l’incapacité des lymphocytes T à infiltrer l’épithélium tumoral. Pour aborder ce point, nous avons mis au point et utilisé une approche expérimentale
d’explants tumoraux maintenus en survie, qui, à l’aide de techniques d’imagerie de
fluorescence, nous ont permis d’analyser la migration de lymphocytes T au sein d’un
microenvironnement préservé [7, 8]. Nos
travaux précédents ont montré que la matrice extracellulaire, particulièrement dense
dans les tumeurs solides en progression, contrôle de façon négative les déplacements
des lymphocytes T et leur capacité à entrer en contact avec les cellules tumorales
[7, 8]. |
Les macrophages des tumeurs : un obstacle au contact entre lymphocytes T et
cellules tumorales Les tumeurs solides sont aussi enrichies en macrophages qui ont été décrits comme
étant associés à un mauvais pronostic dans de nombreux cancers [9]. Plusieurs mécanismes peuvent rendre
compte de l’action pro-tumorale des macrophages, y compris une suppression des
fonctions lymphocytaires T. Cependant, les bases moléculaires et cellulaires de
cette action négative des macrophages sur les lymphocytes T restent incomprises. En utilisant la microscopie par imagerie dynamique sur des tranches de tumeurs
fraîches isolées de patients atteints d’un cancer du poumon, nous avons remarqué
que, dans le stroma, les macrophages forment des interactions de longue durée avec
les lymphocytes T, les rendant relativement statiques [9]. Les lymphocytes T qui ne sont pas en contact avec les
macrophages sont en revanche plus mobiles et plus susceptibles de migrer vers les
cellules tumorales. Ces résultats suggèrent que les macrophages séquestrent les
lymphocytes T loin des cellules tumorales, les empêchant de remplir leur rôle
destructeur de cellules cancéreuses. Nous avons testé cette hypothèse dans deux
modèles murins de cancer du sein. Les macrophages ont été éliminés à l’aide du
pexidartinib, un antagoniste du récepteur du CSF 1 (colony-stimulating
factor 1), une cytokine responsable de la survie et du recrutement de
ces cellules dans les tissus. Nos résultats indiquent que ce traitement, en
éliminant les macrophages, relance la migration des lymphocytes T CD8 et rend
possible leur infiltration dans les îlots tumoraux. Nous avons également montré que
si le traitement ne diminuait pas drastiquement le développement des tumeurs, sa
combinaison avec une immunothérapie anti PD-1 était, en revanche, très efficace.
Précisément, cette double approche augmente considérablement la proportion de
lymphocytes T en contact stable avec les cellules tumorales et conduit à des tumeurs
plus petites que celles observées chez des souris traitées avec l’un ou l’autre des
traitements seuls. L’ensemble de ces résultats montre que l’élimination des
macrophages libère les lymphocytes T qui peuvent alors migrer et infiltrer les îlots
de cellules cancéreuses et répondre efficacement aux anticorps d’immunothérapie
[9]. Ces données fournissent une
explication mécanistique aux essais cliniques en cours qui combinent le pexidartinib
et les anticorps anti PD-1 dans le but de lever la résistance à l’immunothérapie
anticancéreuse chez un grand nombre de patients (essais NCT02452424 et NCT02713529).
Elles permettent également d’envisager de nouvelles approches thérapeutiques qui
empêcheraient la formation de contacts entre les lymphocytes T et les macrophages
tumoraux. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Anderson
KG,
Stromnes
IM,
Greenberg
PD. Obstacles posed
by the tumor microenvironment to T cell activity: A case for synergistic
therapies . Cancer Cell.
2017; ; 31 :
:311.–325. 2. Chen
DS,
Mellman
I. Elements of
cancer immunity and the cancer-immune set point .
Nature.
2017; ; 541 :
:321.–330. 3. Debets
R,
Donnadieu
E,
Chouaib
S,
Coukos
G. TCR-engineered T
cells to treat tumors: Seeing but not touching? .
Semin Immunol.
2016; ; 28 :
:10.–21. 3. Joyce
JA,
Fearon
DT. T cell
exclusion, immune privilege, and the tumor microenvironment .
Science.
2015; ; 348 :
:74.–80. 5. Herbst
RS,
Soria
JC,
Kowanetz
M, et al.
Predictive correlates of response to the anti-PD-L1 antibody
MPDL3280A in cancer patients . Nature.
2014; ; 515 :
:563.–567. 6. Salmon
H,
Donnadieu
E. La matrice
extracellulaire : un obstacle au contact entre les lymphocytes T et les
cellules tumorales . Med Sci (Paris).
2012; ; 28 :
:824.–826. 7. Salmon
H,
Franciszkiewicz
K,
Damotte
D, et al.
Matrix architecture defines the preferential localization and
migration of T cells into the stroma of human lung tumors .
J Clin Invest.
2012; ; 122 :
:899.–910. 8. Bougherara
H,
Mansuet-Lupo
A,
Alifano
M, et al.
Real-time imaging of resident T cells in human lung and ovarian
carcinomas reveals how different tumor microenvironments control T
lymphocyte migration . Front Iimmunol.
2015; ; 6 : :500.. 9. Mantovani
A,
Marchesi
F,
Malesci
A, et al.
Tumour-associated macrophages as treatment targets in
oncology . Nat Rev Clin Oncol.
2017; ; 14 :
:399.–416. 10. Peranzoni
E,
Lemoine
J,
Vimeux
L, et al.
Macrophages impede CD8 T cells from reaching tumor cells and
limit the efficacy of anti-PD-1 treatment . Proc Natl
Acad Sci USA.
2018; ; 115 :
:E4041.–E4050. |



