| |
| Med Sci (Paris). 35(3): 213–215. doi: 10.1051/medsci/2019040.Tryptophane et dérégulations métaboliques, un nouvel
enjeu pour la santé Allison Agus1 and Harry Sokol1,2* 1Institut Micalis, INRA, AgroParisTech, Université Paris-Saclay,
Domaine de Vilvert, 78352Jouy-en-Josas,
France. 2Sorbonne Université, Inserm, Centre de Recherche Saint-Antoine,
CRSA, AP-HP, Hôpital Saint-Antoine, Service de
Gastroentérologie, F-75012Paris,
France. MeSH keywords: Animaux, Facteurs de transcription à motif basique hélice-boucle-hélice, Perméabilité des membranes cellulaires, Modèles animaux de maladie humaine, Microbiome gastro-intestinal, Humains, Inflammation, Muqueuse intestinale, Voies et réseaux métaboliques, Syndrome métabolique X, Souris, Récepteurs à hydrocarbure aromatique, Tryptophane, physiologie, métabolisme, microbiologie, étiologie |
Le microbiote intestinal, une nouvelle piste pour son implication dans le
syndrome métabolique Le syndrome métabolique désigne la coexistence de plusieurs anomalies qui se
traduisent généralement par une obésité, une résistance à l’insuline, une
intolérance au glucose et une hyperlipidémie augmentant considérablement le risque
de pathologies cardiovasculaires. Le rôle causal du microbiote intestinal dans le
développement du syndrome métabolique est d’ores et dèja reconnu. En effet, au même
titre que d’autres pathologies comme les maladies inflammatoires chroniques de
l’intestin, le syndrome métabolique est caractérisé par un déséquilibre du
microbiote intestinal appelé dysbiose, correspondant à un appauvrissement de la
biodiversité et à l’accroissement de certaines espèces bactériennes aux dépens
d’autres [1-3]. Notre tube digestif abrite pas moins
de 1013 à 1014 micro-organismes qui constituent notre
microbiote intestinal, impliqué dans un grand nombre de fonctions physiologiques
essentielles pour l’organisme à la fois digestives, métaboliques, immunitaires et
neurologiques [4, 5] (→).
(→) Voir la Synthèse de V. Gaboriau-Routhiau et N. Cerf-Bensussan,
m/s n° 11, novembre 2016, page 961
La majorité des métabolites fermentaires produits par le microbiote intestinal sont
utilisés par l’hôte et même si une grande partie de ces métabolites sont bénéfiques
pour sa santé, certains peuvent être délétères [6]. Toute rupture d’équilibre de l’écosystème
digestif peut donc engendrer des conséquences pouvant conduire à un état
pathologique [7]
(→).
(→) Voir le numéro thématique Le microbiote,
m/s n° 11, novembre 2016
Les différents travaux de notre équipe ont permis de montrer qu’un grand nombre de
métabolites participe au dialogue complexe existant entre microbiote intestinal et
désordre métabolique avec, notamment, un rôle clé du métabolisme du tryptophane
[8]. Cet acide aminé
essentiel, précurseur de nombreux métabolites, est un acteur crucial impliqué dans
diverses voies de signalisation dans l’organisme allant de l’intestin jusqu’au
cerveau [9]. |
Le métabolisme du tryptophane : 3 voies essentielles liées au microbiote
intestinal La voie AhR (aryl hydrocarbon receptor) Le tryptophane est transformé par certaines bactéries du microbiote en dérivés
indoles qui sont capables d’activer le récepteur des hydrocarbures aromatiques
AhR, un récepteur présent sur des cellules immunitaires et sur des cellules
épithéliales intestinales. Son activation entraîne une production par les
cellules immunitaires d’interleukine-22 (IL-22) qui a une action
anti-inflammatoire et un rôle de protection de la muqueuse [ 10]. La voie de la sérotonine Ce neurotransmetteur est produit à partir du tryptophane et a des effets sur
l’ensemble de l’organisme. Il intervient dans différents processus biologiques
et dans de nombreuses pathologies. Plus de 80 % de la sérotonine de notre
organisme est fabriquée dans l’intestin par des cellules spécialisées et sous
l’influence du microbiote [ 11]. La voie IDO (indoléamine 2,3-dioxygénase) À partir du tryptophane, la voie IDO conduit notamment à la production de la
kynurénine, mais aussi de nombreux autres métabolites qui sont impliqués dans
des processus immunitaires, métaboliques et même neurologiques [ 12]. Le décryptage de l’équilibre complexe qui existe entre les différentes voies du
métabolisme du tryptophane devrait donc permettre de mieux comprendre la
survenue de certaines pathologies intestinales, mais aussi extra-intestinales.
La connexion entre microbiote et santé laisse entrevoir le développement de
nouvelles stratégies thérapeutiques, notamment dans le traitement du syndrome
métabolique. Ainsi, comment le microbiote intestinal est-il capable de moduler la réponse
immunitaire de l’hôte ? Et plus spécifiquement, quel est le rôle du tryptophane
dans le dialogue entre l’hôte et son microbiote ? Quel est le lien entre
microbiote intestinal, métabolisme du tryptophane et syndrome métabolique ? Pour
répondre à ces questions, nous avons dressé un état des lieux des dernières
avancées scientifiques sur le rôle du tryptophane et de ses métabolites dans le
dialogue avec le microbiote intestinal [9]. Deux aspects principaux ont été abordés : (1) les effets des dérivés
du tryptophane produits directement par les bactéries du microbiote, et (2) le
contrôle indirect sur le métabolisme du tryptophane de l’hôte par le microbiote
intestinal. Dans notre étude, nous nous sommes tout particulièrement intéressés
à la voie mettant en jeu AhR, le récepteur des hydrocarbures aromatiques. |
Altération du métabolisme du tryptophane et de la réponse immunitaire chez les
souris atteintes d’un syndrome métabolique : rôle du microbiote intestinal ? Afin de déterminer si un lien causal existait entre microbiote intestinal,
tryptophane et syndrome métabolique, nous avons tout d’abord utilisé une
alimentation riche en matières grasses (HFD, high-fat diet) afin
d’induire, dans un modèle murin, un syndrome métabolique. Une diminution de
l’activité de AhR associée à une plus faible production de ses ligands par le
microbiote intestinal a été identifiée chez les souris HFD atteintes d’un syndrome
métabolique. Chez ces mêmes souris, l’analyse transcriptomique du côlon et de
l’iléon a également montré une diminution d’expression
d’IL-22, de Reg3γ
(regenerating islet-derived protein 3-gamma) et de
Reg3b (regenerating islet-derived protein
3-beta), des gènes cibles de AhR [13,14]. La réparation tissulaire intestinale est induite en partie
par l’IL-22 [15]. Cette
cytokine participe aussi à la réponse immunitaire contre les infections bactériennes
et fongiques via l’induction de la production des peptides
antimicrobiens Reg3γ et Reg3b par les cellules
épithéliales intestinales. Ces données mettent ainsi en évidence une réponse
immunitaire intestinale anormale des souris souffrant d’un syndrome métabolique. Afin de montrer l’importance du microbiote intestinal dans la mise en place du
syndrome métabolique, nous avons colonisé des souris axéniques1 (Ax) sauvages (WT, wild type) avec le
microbiote de souris sauvages nourries avec un régime conventionnel
(MWT-CONV ➞ Ax) ou de souris sauvages nourries avec un régime HFD
(MWT-HFD ➞ Ax). Le transfert de microbiote d’une souris WT-HFD chez
une souris Ax-WT s’est révélé suffisant pour reproduire le phénotype observé chez
les souris WT-HFD. En effet, nous avons retrouvé une activation notablement plus
faible de AhR dans les fèces des souris (MWT-HFD ➞ Ax) par rapport aux
souris (MWT-CONV ➞ Ax). L’ensemble de ces résultats montre ainsi un
défaut du métabolisme du tryptophane par le microbiote intestinal des souris HFD qui
induit une diminution de l’activité AhR et de la production d’IL-22. |
Diminution de l’activité AhR et des métabolites du tryptophane chez les patients
atteints d’un syndrome métabolique Afin de déterminer la pertinence de nos résultats chez l’homme, nous avons analysé
l’activité AhR de fèces issues de volontaires sains et de patients atteints du
syndrome métabolique. Une diminution de l’activité AhR associée à une réduction des
concentrations en agonistes AhR, tels que l’indole ou encore l’acide
indole-3-acétique, a été observée chez des patients atteints du syndrome
métabolique. Ces résultats montrent que le métabolisme du tryptophane par le
microbiote intestinal des patients atteints de syndrome métabolique est altéré et
conduit à un défaut d’activation de AhR. |
Les agonistes AhR comme nouvelle perspective thérapeutique Afin de déterminer si les altérations de production d’agonistes AhR par le microbiote
jouaient un rôle dans la sévérité du syndrome métabolique, nous avons corrigé ce
défaut de production en supplémentant l’alimentation des souris avec des agonistes
AhR ou des souches probiotiques de nouvelle génération (de type
Lactobacilles) produisant naturellement des ligands de AhR.
Cette stratégie a permis d’améliorer très nettement le syndrome métabolique. Une
amélioration de la tolérance au glucose et de la stéatose hépatique ont été
observées, s’expliquant par une meilleure fonction de la barrière intestinale et une
plus grande sécrétion de l’hormone glucoincrétine GLP-1
(glucagon-like-peptide-1)2. De manière plus générale, notre étude a permis de mettre en évidence un lien fort
entre microbiote intestinal et syndrome métabolique (Figure 1). En effet, la capacité réduite du
microbiote à produire des ligands de AhR conduit à un défaut de barrière intestinale
et à une diminution de la production de GLP-1, facilitant ainsi le développement
d’un syndrome métabolique. Il est important de noter que ces résultats sont
pertinents chez l’homme où la diminution de production d’agonistes AhR est aussi
observée chez les patients atteints du syndrome métabolique. En plus de fournir des
preuves essentielles sur le rôle du microbiote intestinal dans le maintien de
l’homéostasie métabolique chez l’hôte, ces travaux démontrent l’efficacité
pharmacologique de molécules ou de bactéries probiotiques sélectionnées sur leur
capacité fonctionnelle à corriger le déficit en ligands de AhR. En conclusion, cette
étude ouvre la voie à de nouveaux traitements préventifs ou curatifs du syndrome
métabolique.
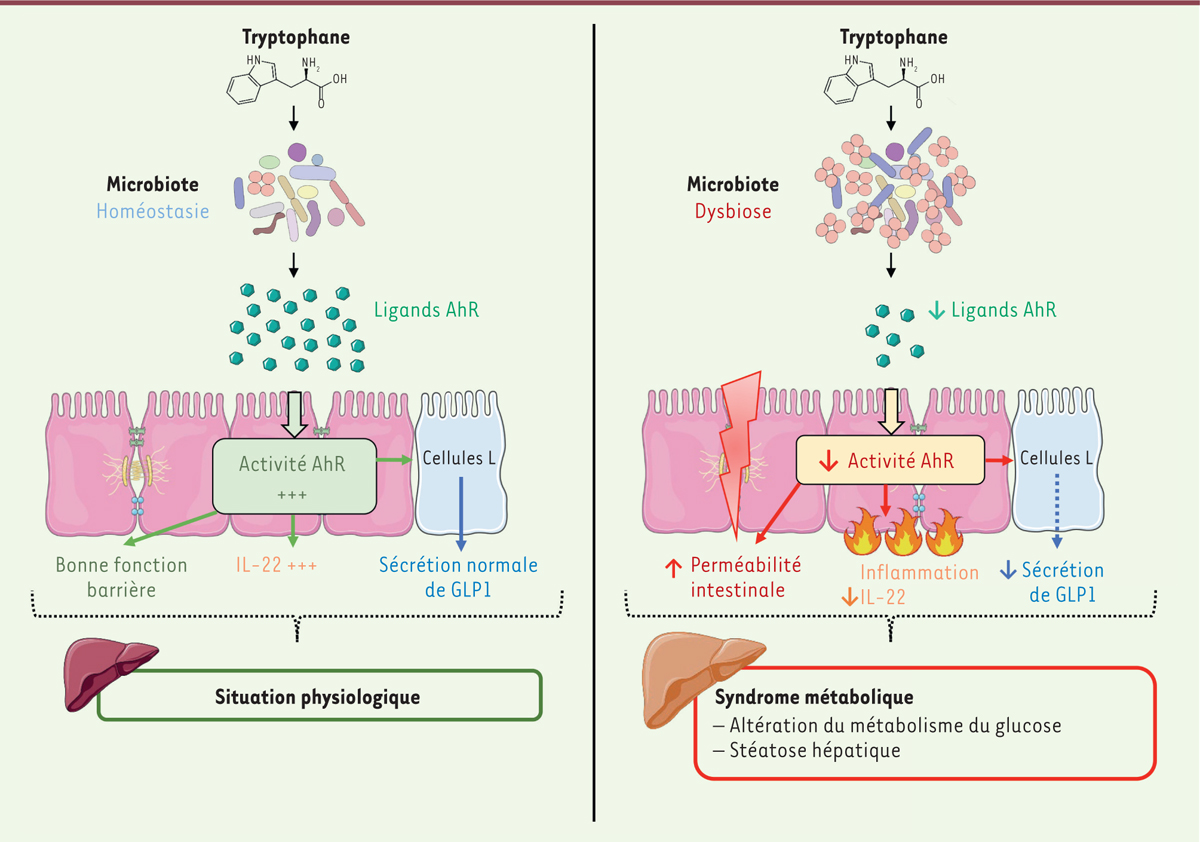
 | Figure 1. Modèle démontrant le lien fort entre microbiote intestinal,
métabolisme du tryptophane et syndrome
métabolique. Dans un contexte de syndrome
métabolique, le microbiote intestinal dit « dysbiotique » est incapable,
à partir du tryptophane, de produire autant d’agonistes AhR
(aryl hydrocarbon receptor) que dans une situation
physiologique. Ce défaut d’activation de AhR induit une diminution de
production d’interleukine-22 (IL-22), une augmentation de perméabilité
intestinale associée à une diminution de sécrétion de l’hormone
glucoincrétine GLP-1 (glucagon-like-peptide-1). Ces
multiples altérations facilitent le développement d’un syndrome
métabolique qui se caractérise par un dysfonctionnement du métabolisme
du glucose et une stéatose hépatique. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Everard
A,
Cani
PD. Diabetes,
obesity and gut microbiota . Best Pract Res Clin
Gastroenterol.
2013; ; 27 :
:73.–83. 2. Ley
RE,
Bäckhed
F,
Turnbaugh
P, et al.
Obesity alters gut microbial ecology .
Proc Natl Acad Sci USA.
2005; ; 102 :
:11070.–11075. 3. Ley
RE,
Turnbaugh
PJ
Klein
S, et al.
Microbial ecology: human gut microbes associated with
obesity . Nature.
2006; ; 444 :
:1022.–1023. 4. Gaboriau-Routhiau
V,
Cerf-Bensussan
N. Microbiote
intestinal et développement du système immunitaire .
Med Sci (Paris).
2016; ; 32 :
:961.–967. 5. Le microbiote : cet
inconnu qui réside en nous (numéro thématique) . Med
Sci(Paris).
2016;; 32 :
:919.–1037. 6. Blacher
E,
Levy
M,
Tatirovsky
E, et al.
Microbiome-modulated metabolites at the interface of host
immunity . J Immunol.
2017; ; 198 :
:572.–580. 7. Schirmer
M,
Smeekens
SP,
Vlamakis
H, et al.
Linking the human gut microbiome to inflammatory cytokine
production capacity . Cell.
2016; ; 67 :
:1125.–1136. 8. Mallmann
NH,
Lima
ES,
Lalwani
P. Dysregulation of
tryptophan catabolism in metabolic syndrome . Metab
Syndr Relat Disord.
2018; ; 16 :
:135.–142. 9. Agus
A,
Planchais
J,
Sokol
H. Gut microbiota
regulation of tryptophan metabolism in health and disease .
Cell Host Microbe.
2018; ; 23 :
:716.–724. 10. Lamas
B,
Natividad
JM,
Sokol
H. Aryl hydrocarbon
receptor and intestinal immunity . Mucosal
Immunol.
2018; ; 11 :
:1024.–1038. 11. Gershon
MD.
5-Hydroxytryptamine (serotonin) in the gastrointestinal
tract . Curr Opin Endocrinol Diabetes Obes.
2013; ; 20 :
:14.–21. 12. Wu
H,
Gong
J,
Liu
Y. Indoleamine 2,
3-dioxygenase regulation of immune response . Mol Med
Rep.
2018; ; 17 :
:4867.–4873. 13. Sonnenberg
GF,
Fouser
LA,
Artis
D. Border patrol:
regulation of immunity, inflammation and tissue homeostasis at barrier
surfaces by IL-22 . Nat Immunol.
2011; ; 12 :
:383.–390. 14. Stelter
C,
Käppeli
R,
König
C, et al.
Salmonella-induced mucosal lectin RegIIIβ kills competing gut
microbiota . PLoS One.
2011; ; 6 : :e20749.. 15. Pickert
G, et al.
STAT3 links IL-22 signaling in intestinal epithelial cells to
mucosal wound healing . J Exp Med.
2009; ; 206 :
:1465.–1472. |