| |
| Med Sci (Paris). 35(3): 266–270. doi: 10.1051/medsci/2019034.Bébés CRISPR Anatomie d’une transgression Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS ; CoReBio PACA,
case 901, Parc scientifique de Luminy, 13288Marseille Cedex 09,
France MeSH keywords: Bioéthique, Systèmes CRISPR-Cas, Chine, Clonage d'organisme, Congrès comme sujet, Résistance à la maladie, Recherche sur l'embryon, Délétion de gène, Édition de gène, VIH (Virus de l'Immunodéficience Humaine), Infections à VIH, Humains, Nouveau-né, Inventions, Mutation, Récepteurs CCR5, Inconduite scientifique, tendances, génétique, éthique, méthodes |

Vignette (Photo © Inserm – Patrick Delapierre). L’annonce de la naissance de deux enfants dont l’ADN a été modifié par la technique
CRISPR [1] a déjà fait couler
beaucoup d’encre. Nous y revenons dans ce numéro de médecine/sciences
pour, d’une part, faire le point sur ce qui a été fait, et dans quelles conditions
(c’est l’objet de cet article) et, d’autre part [2] (→), préciser les conséquences sur le plan de
l’éthique et de la régulation de cet évènement assez prévisible – mais que l’on
n’attendait pas aussi tôt.
(→) Voir la Chronique bioéthique de H. Chneiweiss, page 263 de ce numéro
|
Question préalable : faut-il croire à cette annonce, ou s’agit-il d’une nouvelle «
bidon » ?, comme cela fut le cas pour le prétendu clonage humain par la secte des
Raëliens fin 2002 [3]
(→) ou pour les mirifiques résultats de clonage thérapeutique
publiés par le chercheur Coréen Hwang en 2005 [4] (→).
(→) Voir Perspective/Horizons de B. Jordan, m/s n° 2, février
2003, page 243
(→) Voir la Chronique bioéthique de H. Chneiweiss, m/s n° 2,
février 2006, page 218
Dans le cas présent, il est assez vraisemblable que les expériences présentées par
Jiankui He aient été effectivement réalisées. Cela semble cohérent avec l’intense
activité déployée dans ce domaine en Chine (d’où proviennent la plupart des travaux
appliquant la technique CRISPR à des embryons – non implantés jusqu’ici). De plus,
comme on le verra par la suite, les résultats obtenus par He sont en fait assez
mitigés et ne constituent pas un franc succès, ce qui incite à les croire
véridiques. Cela dit, la seule source d’informations un peu détaillée est constituée
par la présentation de He lors du colloque sur l’édition du génome (Human
genome editing summit) qui a eu lieu à Hong Kong du 27 au 29 novembre
2018 [5], pour laquelle on
peut consulter un diaporama accessible sur Internet [5]. Compte tenu du scandale qu’a suscité ce travail, il est peu probable
qu’une revue accepte de le publier, il semble que même le serveur de
preprints BioxRiv ait pris une position négative : il faudra
donc nous contenter de ces 58 diapositives qui ne remplacent pas une publication
mais apportent néanmoins bon nombre d’informations. Avant d’entamer l’analyse des
données, quelques précisions sur la trajectoire de Jiankui He : on l’a souvent
présenté comme un médecin, mais en réalité il a fait (en Chine) des études de
physique, puis a passé plusieurs années aux États-Unis au cours desquelles il s’est
intéressé à la génétique et aux techniques d’« édition » du génome, a obtenu un
doctorat (PhD) à l’université Rice à Houston et a effectué un stage post-doctoral à
l’université de Stanford (Californie). Considéré en Chine comme un élément très
prometteur, il a été recruté en 2012 par l’université de Shenzen et a bénéficié de
nombreux financements et prix au niveau local et national, tout en fondant plusieurs
entreprises dont Direct Genomics, une firme chinoise qui
commercialise des séquenceurs d’ADN fondés sur la technologie de feu
Helicos
1 [6] (→).
(→) Voir la Chronique génomique de B. Jordan, m/s n° 1,
janvier 2019, page 81
Bref, c’est (c’était…) un personnage en vue de la science chinoise, comblé d’honneurs
et bénéficiant de soutiens financiers et politiques conséquents. |
Le but annoncé par He était d’obtenir des enfants génétiquement modifiés chez
lesquels la protéine CCR5 (C-C chemokine receptor type 5,
normalement exprimée sur les lymphocytes T CD4+) est absente en raison de
l’inactivation du gène correspondant, ce qui doit induire la résistance à
l’infection par le virus VIH (virus de l’immunodéficience humaine) qui utilise cette
protéine comme co-récepteur pour entrer dans la cellule. Il existe en effet dans les
populations d’origine européenne 10 % environ de personnes qui portent une petite
délétion (appelée delta32) dans le gène CCR5 et qui sont, de ce
fait, résistantes à ce virus, tout en jouissant par ailleurs d’une santé
normale2. Nombre de commentateurs se sont
étonnés de ce choix, arguant que la correction d’une mutation délétère (liée par
exemple à l’hémophilie ou à la mucoviscidose) constituerait un objectif plus
défendable [7]. Mais ils
oublient, me semble-t-il, que dans presque tous les cas, le diagnostic
préimplantatoire apporte une solution bien plus sûre, puisqu’après une fécondation
in vitro, on va quasiment toujours trouver quelques embryons
non affectés, sauf situation très exceptionnelle (un parent homozygote pour une
mutation dominante, par exemple, cas ultra-rare). Le choix de He est donc assez
rationnel, d’autant plus qu’il n’est sans doute pas nécessaire d’effectuer une
modification très précise et que toute mutation inactivant le gène
CCR5 pourrait aboutir au résultat souhaité. Une telle
manipulation constitue en fait un premier cas d’amélioration déguisée en prévention,
et comme on peut penser que l’objectif réel des modifications germinales sur l’homme
est l’obtention d’enfants « améliorés » (enhanced), il va tout à
fait dans le sens de l’histoire… |
La présentation de Jiankui He : expériences préliminaires… Rappelons pour commencer que l’introduction de la délétion delta32 dans le gène
CCR5 a déjà été réalisée en 2016 par une équipe chinoise [8] utilisant des embryons
tripronucléaires3 et donc non viables
[9] (→).
Voir la Chronique génomique de B. Jordan, m/s n° 5, mai 2017,
page 549
L’analyse montrait que dans quelques embryons (cinq) la modification désirée avait
bien eu lieu, mais que dans la majorité des cas (une cinquantaine) il y avait eu
jonction aléatoire (NHEJ, non-homologous end joining) après la
coupure de l’ADN par la nucléase Cas9, avec addition ou délétion d’un nombre
variable de nucléotides. De plus, la plupart des embryons s’avéraient être des
mosaïques (mais cela pouvait être lié au fait qu’ils étaient triploïdes dès le
départ). En somme ce travail montrait qu’il était possible d’introduire dans le gène
CCR5 la mutation désirée, mais que l’on était encore loin de
maîtriser la technique et d’effectuer à coup sûr la modification voulue. La présentation de He [5] détaille un ensemble
d’expériences préliminaires. Elle montre d’abord l’édition d’embryons de souris dans
le but d’inactiver le gène Ccr5 murin, avec pour résultat
l’introduction de diverses délétions dans le gène dont une seule correspond à
delta32 à l’état hétérozygote. À partir de cette souris, il a pu obtenir par
croisements une souris portant cette mutation à l’état homozygote et vérifié
l’absence d’anomalies évidentes au niveau tissulaire ou comportemental4. Il est ensuite passé aux cellules humaines (la
lignée HEK293T, lignée dérivée de rein embryonnaire et souvent utilisée pour la
production de vecteurs rétroviraux) et a testé l’efficacité de différents ARN guide
(sgRNA, ARN dirigeant la nucléase Cas9 vers l’endroit ciblé dans l’ADN) et a choisi
le plus efficace, appelé sg4RNA, qui correspond au début de la délétion delta32 dans
le gène CCR5. Profitant de la quasi-identité de la séquence d’ADN
dans cette région entre l’homme et le singe cynomolgus (appelé aussi macaque
crabier), il a alors effectué diverses mises au point sur des embryons de ce singe
et a montré que la meilleure efficacité d’édition (80 %) était obtenue en injectant
Cas9 et l’ARN guide au moment de la fécondation par ICSI (intra-cytoplasmic
sperm injection) de l’ovule, et que cette injection précoce réduisait
la proportion de blastocystes mosaïques. La mise au point a été poursuivie sur des
embryons humains non viables (tripronucléaires), montrant notamment qu’il est
préférable d’injecter la protéine Cas9 plutôt que son ARN. L’établissement de
lignées de cellules souches embryonnaires à partir d’embryons « édités » a permis de
vérifier qu’après induction, celles-ci expriment les marqueurs de différenciation
attendus. La recherche d’éventuelles modifications parasites
(off-target) a été menée de manière assez approfondie,
impliquant notamment le séquençage de l’ADN des parents (pour détecter tous les
sites potentiels) ainsi qu’une approche informatique spécifique permettant de
détecter d’éventuelles délétions. |
On en arrive alors, après une bonne quarantaine de diapositives, à la modification
d’embryons en vue de leur réimplantation (Figure 1). L’ADN des deux parents est séquencé (afin de
permettre une prédiction personnalisée des sites potentiels de modification
parasite) ; la protéine Cas9 et l’ARN guide (sg4RNA) sont injectés dans l’ovule en
même temps qu’un spermatozoïde. Après développement jusqu’au stade blastocyste,
quelques cellules (3 à 5) sont prélevées pour être séquencées : séquençage « génome
entier » avec confirmation par la technique de Sanger pour examiner l’édition de
CCR5 et d’éventuels effets off-target. À ce
stade, quatre blastocystes viables avaient été obtenus ; deux s’avèrent non
modifiés, un présente une délétion de 15 paires de bases (dans le gène
CCR5) sur un chromosome, l’autre étant non modifié ; le
quatrième blastocyste, enfin, porte une insertion d’une paire de bases sur un
chromosome et une délétion de quatre sur l’autre (toujours dans le gène
CCR5). La mutation désirée (delta32) n’est donc pas présente,
et seul l’embryon portant deux modifications est susceptible de ne pas exprimer la
protéine CCR5 (mais cela reste à démontrer). De plus, cet embryon semble présenter
une mutation parasite dans une région inter génique. Malgré ces résultats en
demi-teinte, la décision fut prise (par les parents, indique He) de procéder à
l’implantation de ces deux embryons, qui devaient donner naissance à deux filles,
Nana (double mutante) et Lulu (mutante hétérozygote). Un suivi en cours de
grossesse, effectué par séquençage de l’ADN fœtal isolé du sang maternel avait
confirmé l’édition, totale ou partielle, du gène CCR5 et, en
parallèle, vérifié l’absence de mutations dans un jeu de 600 gènes liés au cancer. À
la naissance, le séquençage à haute redondance du sang de cordon et de l’ADN de
placenta confirmait encore l’édition du gène CCR5 ; en revanche, la
mutation parasite avait disparu. Une nouvelle recherche de mutations parasites et de
délétions ne détecte rien. La présentation se termine en esquissant les futures
étapes : essai d’infection de lymphocytes CD4 par le VIH, recherches plus
approfondies d’effets off-target et d’un éventuel mosaïcisme… en
terminant par un programme de suivi médical des jumelles jusqu’à leur majorité.
Compte tenu de la situation de Jiankui He, qui est actuellement assigné à résidence,
tout cela reste assez hypothétique.
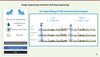 | Figure 1.Reproduction partielle d’une diapositive présentée par
Jiankui He à Hong Kong [ 6], montrant la confirmation par séquençage Sanger
des modifications introduites au début du gène CCR5 des
deux enfants. Les mêmes changements sont retrouvés dans les trois tissus
étudiés (sang et tissu de cordon, placenta). Le document d’origine est
d’assez mauvaise qualité (photographie d’une projection et non fichier
de la présentation) ce qui explique le léger flou de cette image. |
|
Un résultat en demi-teinte, une véritable transgression En somme cette première manipulation génétique sur l’humain, visant à l’inactivation
du gène CCR5 pour conférer la résistance au virus VIH, aboutit à la
naissance d’un enfant chez lequel les deux exemplaires du gène sont mutés (mais sans
que l’on soit certain que cela assure son inactivation) et d’un deuxième enfant
portant un exemplaire muté et un autre normal, donc a priori non protégé. Le but
annoncé (reproduire la mutation naturelle delta32) n’est pas atteint, mais il est
possible que l’inactivation du gène CCR5 ait réussi. Cela dit, si
l’effet de la mutation delta32 est bien connu, celui des mutations introduites chez
ces deux enfants ne l’est pas et l’on peut toujours craindre de mauvaises surprises.
Par ailleurs des contrôles assez approfondis laissent espérer qu’il n’y a pas de
gros problème de modifications parasites ou de délétions, sans que l’on puisse être
totalement rassuré à ce niveau5. C’est en somme
un résultat que l’on pourrait considérer sur un plan purement technique comme plutôt
encourageant, indicatif d’une faisabilité à terme tout en montrant le chemin qui
reste à parcourir…… s’il ne s’agissait pas d’une modification irréversible de la
lignée germinale humaine. De fait, il constitue une transgression majeure, la
première véritable manipulation génétique sur l’humain affectant tant les sujets
concernés que leur descendance, dans des conditions de sécurité bien trop
approximatives (comme l’indiquent les résultats) et en violation flagrante des
conditions éthiques et sociétales énoncées à de multiples reprises [10] (→).
Voir la Chronique génomique de B. Jordan, m/s n° 2, février
2016, page 217
Il n’est donc pas étonnant que la révélation de cette tentative « sauvage » ait
suscité une réprobation générale et la disgrâce de Jiankui He ; reste à tirer les
conséquences de cette transgression pour l’encadrement de tels travaux et à montrer
que, en dépit de cet accroc, la communauté scientifique est capable de se réguler de
manière efficace. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Je remercie Hervé Chneiweiss pour ses remarques ayant permis d’améliorer cet
article.
|
Footnotes |
2. De
Chneiweiss H..
retour de Hong-Kong ou l’éthique à l’heure d’une génétique
d’augmentation de la personne humaine . Med Sci
(Paris).
2019; ; 35 :
:263.–265. 3. Jordan
B.. L’humanité est
au seuil du paradis . Med Sci (Paris).
2003; ; 19 :
:243.–245. 4. Chneiweiss
H.. Cloningate ? La
publication scientifique et le clonage thérapeutique face à la mystification
Hwang . Med Sci (Paris).
2006; ; 22 :
:218.–222. 6. Jordan
B.. Actualités du
séquençage d’ADN. Med Sci (Paris).
2019; ; 35 :
:81.–83. 7. The blind babymaker .
Editorial . Nat Biotechnol.
2019; ; 37 : :1.. 8. Kang
X,
He
W,
Huang
Y, et al.
Introducing precise genetic modifications into human 3PN embryos
by CRISPR/Cas-mediated genome editing . J Assist
Reprod Genet.
2016; ; 33 :
:581.–588. 9. Jordan
B.. CRISPR sur
embryons humains : une nouvelle étape . Med Sci
(Paris).
2017; ; 33 :
:549.–551. 10. Jordan
B.. Sommet de
Washington : feu orange pour la thérapie germinale ? .
Med Sci (Paris).
2016; ; 32 :
:217.–220. |



