| |
| Med Sci (Paris). 35(3): 275–278. doi: 10.1051/medsci/2019056.Contrôle de la localisation de la protéine kinase A,
une propriété des AKAP partagée par une protéine précoce des
adénovirus Mériem Imarazène,1* Ouidad Aouragh,1** and Karim Benihoud2*** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France 2Vectorologie et thérapeutiques anticancéreuses, UMR 8203, CNRS,
Université Paris-Sud, Institut Gustave Roussy, Université
Paris-Saclay, 94800Villejuif,
France MeSH keywords: Protéines d'ancrage aux protéines kinases A, Protéines E1A d'adénovirus, Adénovirus humains, Mimétisme biologique, Cyclic AMP-Dependent Protein Kinases, Interactions hôte-pathogène, Humains, Liaison aux protéines, Transport des protéines, Sérogroupe, métabolisme, physiologie, pathogénicité |
Processus d’activation de la PKA La protéine kinase A (PKA) est une protéine cytoplasmique organisée en tétramères
(holoenzyme), composée de deux sous-unités régulatrices et deux sous-unités
catalytiques. La liaison de l’adénosine monophosphate cyclique (AMPc) sur les
sous-unités régulatrices (RIα et RIIα) entraîne la libération des sous-unités
catalytiques (C) qui vont pouvoir exercer leur activité sur différents substrats. Le
modèle classique décrit donc une dissociation de l’holoenzyme dans le cytoplasme
après fixation de l’AMPc puis une phosphorylation, par les sous-unités catalytiques,
de différents substrats protéiques situés à la membrane plasmique, dans le cytosol
ou dans le noyau. Cependant, il a été montré plus récemment que l’activation de
l’holoenzyme pouvait également avoir lieu dans le noyau [1]. Les PKA sont impliquées dans de nombreuses
fonctions cellulaires et, en particulier, dans la régulation du métabolisme. Leur
activation dépend du taux d’AMPc qui, lui, est régulé par différentes adénylates
cyclases et phosphodiestérases. Cette activation dépend également de protéines
d’échafaudage (scaffold protein) appelées A-kinase
anchoring proteins (AKAP) qui compartimentalisent la PKA dans des
régions cellulaires précises. En interagissant avec les sous-unités régulatrices de
la PKA, les AKAP permettent de localiser les sous-unités catalytiques au voisinage
de leurs substrats [2]. Dans des travaux précédents, le groupe de J.S. Mymryrk avait montré que les
adénovirus (Ad) humains – une famille de virus à ADN – déclenchaient l’activation
des PKA. Les auteurs s’étaient intéressés à une protéine précoce du cycle viral, la
protéine E1A. Celle-ci était connue pour sa capacité à modifier les cellules
infectées par différents mécanismes moléculaires de façon à les rendre aptes à la
réplication virale. Les auteurs avaient révélé que cette protéine E1A possédait, au
niveau de sa partie aminoterminale, un motif de type AKAP qui cible le domaine de
dimérisation et d’ancrage (D/D pour docking and dimerization) des
sous-unités régulatrices de la PKA [3]. Ce motif permet aux protéines E1A de l’Ad5 de relocaliser les
sous-unités régulatrices RIα de la PKA du cytoplasme vers le noyau, conduisant à une
augmentation de la transcription des gènes viraux précoces et à une augmentation de
la production de virions. Plus récemment, King et al ont poursuivi
leurs travaux en s’intéressant aux protéines E1A de différents sérotypes adénoviraux
humains [4]. En particulier,
les auteurs ont cherché à mieux comprendre les bases moléculaires de l’interaction
entre les AKAP et les protéines E1A. |
Ciblage des sous-unités régulatrices de la protéine kinase A par les protéines
E1A de différents sérotypes d’adénovirus Les auteurs ont tout d’abord réalisé des transfections de cellules avec des vecteurs
codant les sous-unités régulatrices (RIα et RIIα) et catalytiques (Cα) de la PKA, et
des protéines E1A provenant de différents sérotypes d’Ad humains. Puis, par des
techniques de co-immunoprécipitation, ils ont montré que les protéines E1A issues
des sérotypes 3, 5, 9, 12 et 40 (mais pas des sérotypes 4 et 52) étaient capables
d’interagir avec les sous-unités RIα et RIIα. De plus, ils ont montré que, quand il
y avait interaction, celle-ci se faisait via la liaison d’un motif
d’une dizaine de résidus dans la partie amino-terminale des protéines E1A avec le
domaine D/D des sous-unités régulatrices RIα et RIIα. |
Relocalisation nucléaire des sous-unités régulatrices de la PKA par les protéines
E1A de certains sérotypes adénoviraux Pour étudier l’impact de l’interaction des protéines E1A sur la localisation
intracellulaire des sous-unités RIα et RIIα, les auteurs ont ensuite utilisé des
techniques d’immunofluorescence et d’imagerie cellulaire. L’analyse des cellules
HeLa exprimant différentes protéines E1A (à la suite de la transfection par des
plasmides ou l’infection par différents adénovirus) a permis de répartir les
protéines E1A en 3 groupes : des protéines E1A (Ad4, Ad40 et Ad52) incapables de
relocaliser les sous-unités régulatrices du cytoplasme vers le noyau, des protéines
E1A capables de relocaliser spécifiquement la sous-unité RIα (Ad5 et Ad9) ou la
sous-unité RIIα (Ad12 et Ad3). Dans le cas particulier de l’Ad5, les expériences ont
révélé que cette relocalisation nécessitait le site de localisation nucléaire
présent dans la région carboxy-terminale de la protéine E1A. Enfin, l’étude de
protéines E1A chimères entre la protéine E1A de l’Ad5, capable de fixer RIα mais pas
RIIα, et la protéine E1A de l’Ad4, incapable de fixer RIα mais fixant RIIα, a
démontré que le domaine amino-teminal des protéines E1A dictait la spécificité
d’interaction avec les sous-unités régulatrices et, par voie de conséquence, la
localisation de ces sous-unités. Il suffit de muter quelques résidus de cette région
amino-terminale des protéines E1A pour perdre l’interaction avec les sous-unités
régulatrices.
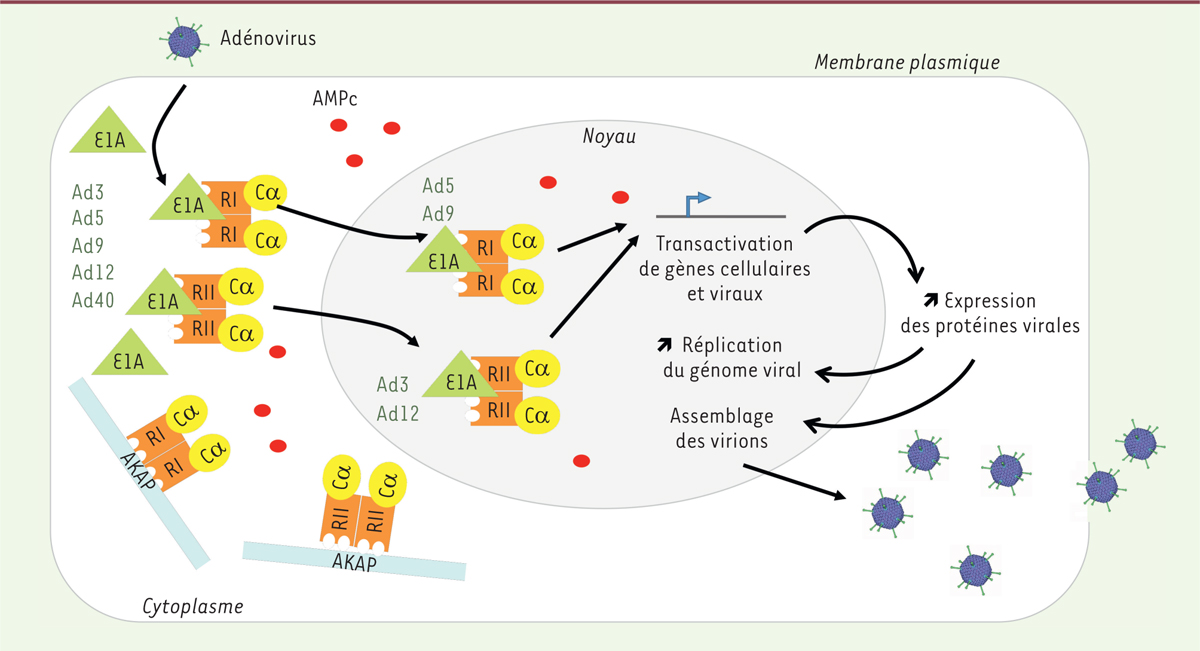
 | Figure 1. Mimétisme moléculaire par les protéines E1A des adénovirus
des protéines AKAP. Les protéines E1A sont les
premières protéines de l’adénovirus exprimées après l’infection des
cellules. Les protéines E1A de nombreux sérotypes viraux (sérotypes 3,
5, 9, 12 et 40) sont capables de mimer les fonctions d’une AKAP
cellulaire en interagissant avec les sous-unités régulatrices de la PKA.
Les protéines E1A des Ad5 et Ad9 interagissent avec la sous-unité
catalytique RI, tandis que les protéines E1A des sérotypes 3 et 12
interagissent préférentiellement avec les sous-unités catalytiques RII.
Il en résulte un import nucléaire de la PKA qui conduit à une
transactivation par cette protéine des gènes cellulaires et viraux, à
une augmentation de la synthèse des protéines virales et de la
réplication du génome viral permettant une meilleure production virale.
AMPc : adénosine monophosphate cyclique. Le pictogramme de l’Ad est issu
de https://pdb101.rcsb.org/motm/132 |
|
L’interaction des protéines E1A avec la PKA, une étape indispensable à la
production de différents sérotypes adénoviraux Les chercheurs ont ensuite voulu comprendre l’intérêt fonctionnel de l’interaction
entre les protéines E1A et les sous-unités régulatrices de la PKA. Ils ont tout
d’abord montré que l’expression d’un gène rapporteur sous le contrôle d’un promoteur
répondant à l’AMPc était induite dans des cellules exprimant les protéines E1A de
différents sérotypes, mais pas lorsqu’on exprimait des protéines E1A mutées pour le
domaine d’interaction avec les sous-unités régulatrices de la PKA. Ceci démontrait
l’importance de l’interaction entre E1A et les sous-unités régulatrices pour le
déclenchement de l’activité transactivatrice de la PKA sur les promoteurs qu’elle
contrôle. De plus, l’inhibition des sous-unités régulatrices ou/et catalytiques de
la PKA par interférence ARN dans les cellules infectées par différents sérotypes
adénoviraux conduit à une diminution de la réplication du génome viral et de la
production des virions. Ces résultats soulignent l’importance de l’activité PKA et
donc de l’interaction entre E1A et la sous-unité régulatrice dans le cycle
infectieux des adénovirus humains. Ils sont en accord avec l’étude précédente du
même groupe montrant, dans le cas de l’Ad5, que l’interaction E1A-PKA était
nécessaire à la transcription des gènes viraux précoces [3]. Il faut noter cependant que, dans la nouvelle étude,
l’inhibition des sous-unités catalytiques réduit la réplication virale de tous les
sérotypes adénoviraux testés, y compris l’Ad4 dont la protéine E1A n’interagit pas
avec les sous-unités régulatrices de la PKA. Ceci suggère qu’à côté d’une activité
PKA mobilisée de manière dépendante de la protéine E1A, il existe une activité PKA
mobilisée indépendamment des protéines E1A. Les données de cette étude [4], combinées aux
travaux précédents de la même équipe [3],
démontrent que l’interaction des protéines E1A de l’adénovirus avec la PKA est une
caractéristique commune à de nombreux sérotypes adénoviraux. Les résultats obtenus
ont révélé un mécanisme moléculaire original fondé sur l’interaction des protéines
E1A avec le domaine D/D des sous-unités régulatrices de la PKA via
un motif similaire à celui des AKAP cellulaires. Ainsi, ces travaux démontrent pour
la première fois l’existence d’AKAP virales et ajoutent une nouvelle fonction à
celles déjà identifiées pour les protéines E1A comme l’interaction avec la protéine
Rb (rétinoblastome) [5] ou la
modulation du programme épigénétique [6] de la cellule hôte. De manière plus générale, l’étude de la
façon dont les protéines virales s’intègrent dans les réseaux de signalisation des
cellules hôtes permet de mieux comprendre comment les virus prennent le contrôle de
ces cellules pour créer un environnement propice à leur réplication. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Sample
V,
DiPilato
LM,
Yang
JH, et al.
Regulation of nuclear PKA revealed by spatiotemporal manipulation
of cyclic AMP . Nat Chem Biol.
2012; ; 8 :
:375.–382. 2. Torres-Quesada
O,
Mayrhofer
JE,
Stefan
E. The many faces of
compartmentalized PKA signalosomes . Cell
Signal.
2017; ; 37 :
:1.–11. 3. King
CR,
Cohen
MJ,
Fonseca
GJ, et al.
Functional and structural mimicry of cellular protein kinase A
anchoring proteins by a viral oncoprotein . PLoS
Pathog.
2016; ; 12 :
:e1005621.. 4. King
CR,
Gameiro
SF,
Tessier
TM, et al.
Mimicry of cellular A kinase-anchoring proteins is a conserved
and critical function of E1A across various human adenovirus
species . J Virol.
2018; ; 92 :
:e01902.–e01917. 5. Whyte
P,
Buchkovich
KJ,
Horowitz
JM, et al.
Association between an oncogene and an anti-oncogene: the
adenovirus E1A proteins bind to the retinoblastoma gene
product . Nature.
1988; ; 334 :
:124.–129. 6. Horwitz
GA,
Zhang
K,
McBrian
MA, et al.
Adenovirus small e1a alters global patterns of histone
modification . Science.
2008; ; 321 :
:1084.–1085. |