| |
| Med Sci (Paris). 35(5): 405–407. doi: 10.1051/medsci/2019084.Rôle inattendu des IAP dans la régulation
transcriptionnelle Baptiste Dumétier,1 Valérie Glorian,1 Jennifer Allègre,1 and Laurence Dubrez1* 1Lipides, nutrition et cancer, UMR1231, Inserm,
21079Dijon,
France 2Université de Bourgogne Franche-Comté,
7, boulevard Jeanne
d’Arc, 21079Dijon,
France MeSH keywords: Mort cellulaire, Régulation de l'expression des gènes, Humains, Protéines IAP, Tumeurs, Transcription génétique, génétique, physiologie, anatomopathologie |
Les IAP (inhibitors of apoptosis), en particulier cIAP (cellular
IAP) 1, cIAP2 et XIAP (X-linked IAP) sont des régulateurs
incontournables de la réponse immunitaire et de l’inflammation [1, 2] (→).
(→) Voir la Synthèse de J. Cartier et al., m/s
n° 1, janvier 2012, page 69
Ils catalysent l’assemblage de complexes multiprotéiques de signalisation qui permettent
l’activation de voies de survie et de différenciation, telles que les voies NF-κB
(nuclear factor-kB) et MAPK
(mitogen-activated protein kinases). Ils inhibent également la mort
cellulaire en bloquant la formation des plateformes d’activation des caspases ou leur
activité enzymatique. Quelques études récentes ont montré qu’ils pouvaient également
exercer un rôle régulateur sur la machinerie transcriptionnelle. cIAP1, cIAP2 et XIAP sont des E3 ligases impliquées dans la réaction d’ubiquitinylation
des protéines. Ces IAP catalysent la conjugaison d’une molécule ou d’une chaîne
d’ubiquitines sur une protéine cible. En fonction de la nature et de la topologie des
chaînes d’ubiquitines, cette modification post-traductionnelle affecte la durée de vie,
l’activité, la localisation ou le réseau d’interaction des protéines ainsi modifiées.
Différents facteurs ou co-régulateurs de transcription s’avèrent être des cibles
d’ubiquitinylation des IAP. Deux études publiées en 2007 et 2012 avaient montré que cIAP1 et XIAP pouvait
indirectement stimuler l’activation des facteurs de transcription Myc/Max et TCF
(T-cell factor)/LEF (lymphoid enhancer factor-1)
en inhibant le recrutement de leur cofacteur répresseur respectif, Mad1
(Max-dimerization protein-1) et Groucho [3, 4]. En 2012, Qi et Xia montrèrent que cIAP1 pouvait également catalyser
l’ubiquitinylation dégradative du facteur de transcription CHOP (C/EBP
homologous protein), le médiateur essentiel de la mort cellulaire en
réponse à un stress réticulaire. cIAP1 protège ainsi les cellules β du pancréas contre
l’effet toxique des acides gras saturés [5]. Plus récemment, un rôle direct de cIAP2 ou de XIAP dans l’activation des
facteurs de transcription IRF1 (interferon regulatory factor 1) et
HIF1α (hypoxia inducible factor-1) a été décrit [5, 6]. Cette
activation consiste en la conjugaison sur les facteurs de transcription de chaînes
d’ubiquitines non-dégradatives de type K631,. Dans
une étude publiée en 2014 [6], Harikumar
et al. avaient montré que cIAP2 associé à la
sphingosine-1-phosphate était responsable de la conjugaison de chaînes d’ubiquitines de
type K63 sur IRF1 en réponse à une stimulation de cellules astrocytaires par
l’interleukine-1 (IL-1). Cette ubiquitinylation induit l’activation d’IRF1 et
l’expression des chimiokines CXCL10 (C-X-C motif chemokine 10) et CCL5
(chemokine [C-C motif] ligand 5), permettant le recrutement de
cellules mononucléées sur le site d’une infection. HIF1α appartient, quant à lui, à une
famille de facteurs de transcription permettant une adaptation des cellules à des
conditions de stress comme l’hypoxie. Son accumulation dans le noyau des cellules ainsi
que son recrutement sur le promoteur de gènes cibles sont contrôlés par une
ubiquitinylation de type K63 par XIAP [6]. Nos
travaux récents ont identifié un autre facteur de transcription, substrat des IAP, dont
l’activité est également contrôlée par une ubiquitinylation de type K63 [6-8]. |
E2F1 est le membre fondateur d’une famille de facteurs de transcription (E2F)
contrôlant la progression des cellules dans le cycle cellulaire : il permet la
transcription des gènes essentiels à la transition G1-S et à la réplication de
l’ADN. La protéine E2F1 s’accumule progressivement lors de la phase G1 pour
atteindre un pic à la fin de cette phase. Son taux diminue ensuite en phase S
jusqu’au prochain cycle de la cellule (Figure
1). En phase G0 et durant la phase G1, E2F1 est associé à la
forme hypophosphorylée de la protéine Rb (retinoblastoma). Cette
association stabilise d’une part le facteur de transcription, ce qui permet son
accumulation. Elle bloque d’autre part son activité transcriptionnelle. En fin de
phase G1, la liaison entre E2F1 et Rb est rompue par la phosphorylation de Rb qui
est réalisée par les complexes cycline D/CDCK4/6 (cyclic-dependent kinase 4
/6). E2F1, alors libéré, assure l’entrée en phase de réplication de
l’ADN (phase S du cycle). En fin de phase S, le complexe cycline A/CDK2 se lie à
E2F1 et le phosphoryle déclenchant sa dissociation de l’ADN et la diminution
progressive de son niveau d’expression. Cette régulation négative en fin de phase S
est critique pour l’entrée en phase G2. La régulation temporelle d’E2F1 est donc
essentielle pour maintenir la périodicité du cycle cellulaire. Paradoxalement, E2F1
contribue aussi à l’arrêt des cellules dans le cycle cellulaire et à l’apoptose en
réponse à un stress génotoxique. L’accumulation d’E2F1 est un évènement précoce de
réponse des cellules à un dommage à l’ADN. Il permet la transcription des gènes de
réparation de l’ADN et de l’apoptose.
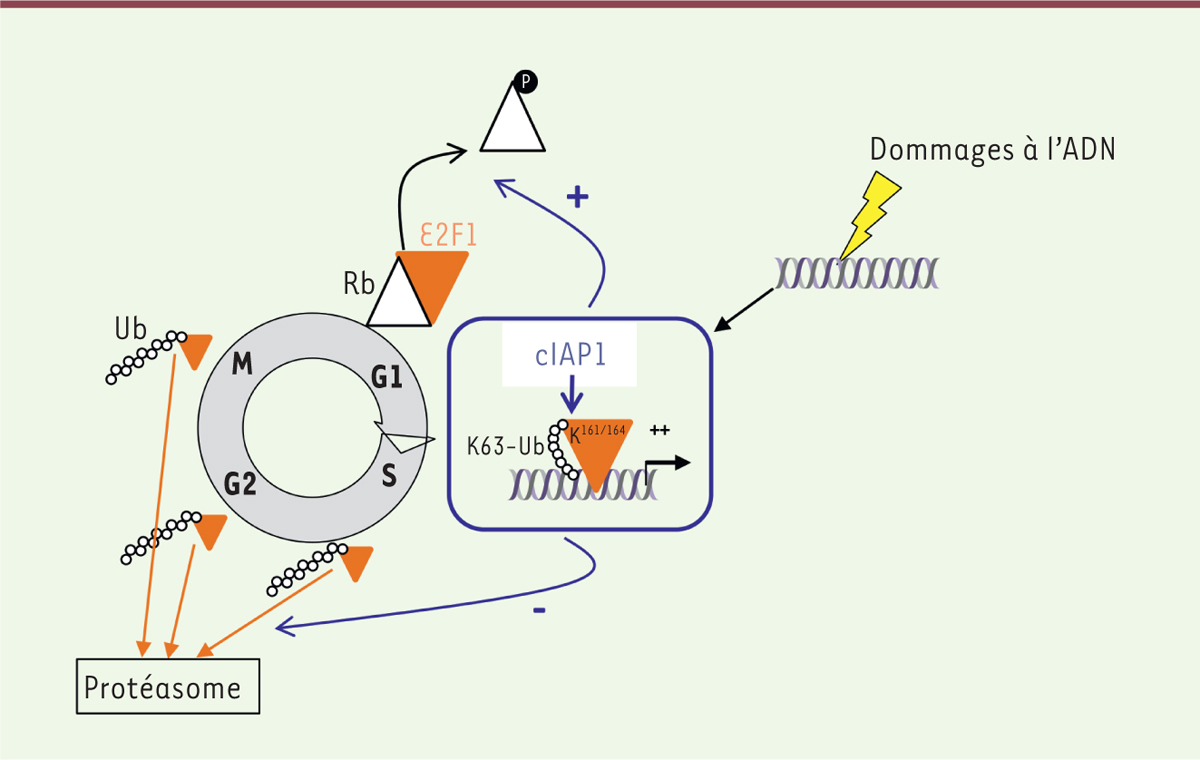
 | Figure 1.
Régulation du facteur de transcription E2F1 par
cIAP1. E2F-1 (représenté par un triangle orange) s’accumule
progressivement au cours de la phase G1 du cycle cellulaire. Son
activité est réprimée par son association avec la forme hypophosphorylée
de Rb (retinoblastoma). En fin de phase G1 ou suite à
un stress génétoxique, cIAP1 (cellular Inhibitor of apoptosis
1) catalyse la conjugaison de chaînes d’ubiquitines de type
K63 sur le facteur de transcription. Cette modification favorise la
dissociation E2F1-Rb et la liaison du facteur de transcription sur
l’ADN. En fin de phase S et durant les phases G2 et M du cycle
cellulaire, E2F1 est dégradé par le système ubiquitine-protéasome. |
L’expression et l’activité d’E2F1 sont finement contrôlées par des modifications
post-traductionnelles. Celles-ci sont rapidement effectives et permettent une
régulation quasi-instantanée. Des phosphorylations, des méthylations, des
NEDDylations2, des acétylations, des
sumoylations et des ubiquitinylations d’E2F1 ont ainsi été décrites. Le système
ubiquitine-protéasome contribue à la dégradation d’E2F1 en fin de phase S ; il
permet de maintenir un faible niveau d’expression d’E2F1 en phase G2 et M
(Figure 1). Nous avons mis en évidence une ubiquitinylation non dégradative de type K63 d’E2F1
lorsque l’activité du facteur de transcription est maximale, c’est-à-dire en fin de
phase G1 du cycle cellulaire, mais également à la suite d’un stress génotoxique
[8] (Figure 1). Les lysines 161 et 164, situées dans le domaine
de liaison à l’ADN d’E2F1, sont les résidus accepteurs de ces chaînes d’ubiquitines.
Une mutation de ces lysines empêche le recrutement du facteur de transcription sur
les promoteurs de ses gènes cibles et inhibe son activité transcriptionnelle, que ce
soit en fin de phase G1 ou après une exposition des cellules à un agent endommageant
l’ADN. Nous avons montré que cIAP1 promouvait cette modification : cIAP1 lie
directement E2F1 et est recrutée sur les promoteurs de ses gènes cibles uniquement
durant les phases d’activation du facteur de transcription. Un séquençage de la
chromatine immunoprécipitée (ChiP) a révélé qu’une délétion de cIAP1 par
interférence ARN inhibe drastiquement l’association d’E2F1 avec l’ADN [9]. cIAP1 favorise la
phosphorylation de Rb et la dissociation du complexe Rb-E2F1 nécessaire à l’activité
transcriptionnelle [8] (Figure 1). Inversement, une
inhibition de cIAP1 favorise la dégradation protéasomale d’E2F1 catalysée par les
complexes enzymatiques SCFskp2 (Skp2 [S phase kinase-binding
protein 2]-CDC53 [Cullin]-Fbox)
et APC/C (anaphase-promoting complex/cyclosome) actifs en fin de
phases S, G2 et M du cycle cellulaire [9]
(Figure 1). |
La fonction de régulateur transcriptionnel de cIAP1 nécessite son expression
nucléaire [10]. cIAP1 a été
détectée dans le noyau de cellules souches capables d’autorenouvellement, comme les
précurseurs hématopoïétiques de la moelle osseuse, les cellules de la couche basale
de l’épiderme et les cellules localisées au fond des cryptes coliques. Au cours de
la différenciation cellulaire, cIAP1 est exclue du noyau, ce qui coïncide avec
l’arrêt de prolifération associé à la différenciation [11]. cIAP1 est aussi détectée dans le noyau de
certaines cellules tumorales. Cette expression nucléaire a été corrélée avec un
mauvais pronostic. Ainsi, une ubiquitinylation de type K63 d’IRF1 [5], d’HIF1α [6] ou d’E2F1 [8, 9]
catalysée par un membre de la famille des IAP représente un signal important
d’activation qui induit leur recrutement sur leurs promoteurs-cibles respectifs.
Toutefois, les mécanismes moléculaires mis en jeu ne sont pas connus. Les chaînes
K63 d’ubiquitines pourraient être reconnues par des co-facteurs spécifiques porteurs
de domaines de liaison d’ubiquitines et présents sur la chromatine. Des propriétés oncogéniques ont été attribuées à cIAP1. L’expression de cette
protéine est altérée dans de nombreux échantillons tumoraux d’origine différente.
Les résultats récents montrant un rôle des IAP dans la régulation transcriptionnelle
renforcent l’importance des IAP dans le développement tumoral. En plus de leur
capacité de contrôler les réponses immunitaire et inflammatoire, les IAP sont aussi
capables de contrôler l’activité d’oncogènes puissants comme c-myc ou l’axe E2F1/Rb.
Différentes molécules antagonistes, appelées « mimétique de Smac (second
mitochondrial activator of caspases) », sont aujourd’hui en phase
d’évaluations pré-clinique et clinique. Ces composés pourraient, à l’avenir, trouver
leur place dans la pharmacopée anti-cancéreuse. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Kocab
AJ,
Duckett
CS. Inhibitor of
apoptosis proteins as intracellular signaling intermediates .
FEBS J . 2016; ; 283 :
:221.–231. 2. Cartier
J,
Marivin
A,
Berthelet
J,
Dubrez
L. Les IAP au cœur
de la signalisation NF-kappaB . Med Sci
(Paris) . 2012; ; 28 :
:69.–75. 3. Hanson
AJ,
Wallace
HA,
Freeman
TJ, et al.
XIAP monoubiquitylates Groucho/TLE to promote canonical Wnt
signaling . Mol Cell . 2012; ;
45 :
:619.–628. 4. Xu
L,
Zhu
J,
Hu
X, et al.
c-IAP1 cooperates with Myc by acting as a ubiquitin ligase for
Mad1 . Mol Cell . 2007; ;
28 :
:914.–922. 5. Qi
Y,
Xia
P. Cellular
inhibitor of apoptosis protein-1 (cIAP1) plays a critical role in beta-cell
survival under endoplasmic reticulum stress: promoting ubiquitination and
degradation of C/EBP homologous protein (CHOP) . J
Biol Chem . 2012; ; 287 :
:32236.–32245. 6. Harikumar
KB,
Yester
JW,
Surace
MJ, et al.
K63-linked polyubiquitination of transcription factor IRF1 is
essential for IL-1-induced production of chemokines CXCL10 and
CCL5 . Nat Immunol . 2014; ;
15 :
:231.–238. 7. Park
CV,
Ivanova
IG,
Kenneth
NS. XIAP upregulates
expression of HIF target genes by targeting HIF1α for Lys63-linked
polyubiquitination . Nucleic Acids Res .
2017; ; 45 :
:9336.–9347. 8. Glorian
V,
Allègre
J,
Berthelet
J, et al.
DNA damage and S phase-dependent E2F1 stabilization requires the
cIAP1 E3-ubiquitin ligase and is associated with K63-poly-ubiquitination on
lysine 161/164 residues . Cell Death Dis .
2017; ; 8 :
:e2816.. 9. Allègre
J,
Cartier
J,
Glorian
V, et al.
E2F1 binds to the peptide-binding groove within the BIR3 domain
of cIAP1 and requires cIAP1 for chromatin binding .
PLoS One . 2018; ; 13 :
:e0206253.. 10. Cartier
J,
Berthelet
J,
Marivin
A, et al.
Cellular Inhibitor of Apoptosis Protein-1 (cIAP1) Can Regulate
E2F1 Transcription Factor-mediated Control of Cyclin
Transcription . J Biol Chem .
2011; ; 286 :
:26406.–26417. 11. Dupoux
A,
Cartier
J,
Cathelin
S, et al.
cIAP1-dependent TRAF2 degradation regulates the differentiation
of monocytes into macrophages and their response to CD40
ligand . Blood . 2009; ;
113 :
:175.–185. |