| |
| Med Sci (Paris). 35(5): 452–461. doi: 10.1051/medsci/2019092.Polarité cellulaire : sens et
signification De la signification évolutive de l’innovation du cil
primaire/centrosome chez les métazoaires Michel Bornens1* 1Institut Curie, Université de recherche
Paris-Sciences-et-Lettres, CNRS - UMR 144, 26, rue d’Ulm, 75248Paris Cedex 05,
France |
Vignette (Photos © James Sillibourne, Manuel Théry et Michel Bornens). Ce texte est une version courte d’un texte paru en langue anglaise (Open
Biol 2018, 8 : 180052. http://dx.doi.org/10.1098/rsob.180052) [41]. On pourra s’y référer pour trouver les
références qui font défaut. Il contient également des passages en italiques. Un lecteur
pressé pourra se contenter de les lire en première intention. La polarité propre des cellules, caractérisée par une activité unidirectionnelle soutenue
par une organisation cellulaire asymétrique et maintenue par une signalisation
appropriée, est une propriété essentielle de la lignée animale. Une compréhension plus
complète de la signification de la brisure de symétrie permanente des cellules animales
est-elle possible dans une perspective évolutive ? Face à la richesse des phénomènes et
aux difficultés jumelles du changement d’échelle et de la complexité [1], obtenir une description unifiée pourrait
éclairer des domaines disjoints.
On montrera que la polarité propre des cellules joue un rôle pivot non seulement
à tous les niveaux de l’organisation animale, mais aussi dans l’évolution de
l’individualité.
|
Pourquoi les eucaryotes unicellulaires sont-ils polarisés ? Les lignages eucaryotes sont presque exclusivement constitués d’organismes
unicellulaires [2]. La
polarité propre des cellules animales est très largement héritée, renvoyant son
origine aux ancêtres unicellulaires [3]. La capacité de se déplacer est critique pour les unicellulaires qui
subissent des changements permanents de leur habitat. Le flagelle, la nage, la prise de nourriture et la division
cellulaire Le plus ancien ancêtre commun à tous les eucaryotes avait un cytosquelette formé
de microtubules (MT) très complexe. C’était probablement un phagotrophe 1 biflagellé avec un sillon nourricier
ventral, un corps basal postérieur assemblant un flagelle dont le battement dans
le sillon ventral facilitait la capture des proies [ 4], et un corps basal antérieur assemblant
un flagelle pour une locomotion par glissement. Le corps basal est un caractère
dérivé propre des eucaryotes. Il se reproduit habituellement grâce à un
mécanisme conservatif de duplication. La différence générationnelle entre
l’ancien et le nouveau corps basal a d’importantes implications pour la
reproduction de la morphologie cellulaire. S’il y a plus de deux flagelles, leur
transformation peut se produire sur plusieurs cycles de division avant d’arriver
à la maturation définitive du corps basal [ 5], ce qui définit une flèche du temps 2. L’appareil flagellaire polarisé est
souvent associé au noyau par une connexion structurée [ 6]. D’autres, tels le trypanosome (un
parasite), ont un corps basal qui n’est pas connecté au noyau, mais au
kinétoplaste 3 [ 7]. Chez les ciliés, une stratégie
complètement différente est utilisée. Le flagelle eucaryote est un compartiment
intracellulaire authentique, séparé du reste du cytoplasme par une barrière de
diffusion complexe. Sa structure générale est remarquablement conservée.
Présent dans tous les super-groupes eucaryotes, le cil/flagelle
manifeste un succès évolutif qui ne peut être surestimé. On ne sait rien de
la manière dont il est apparu.
Chez des algues biflagellées, comme Chlamydomonas, les flagelles
sont résorbés durant la division cellulaire, et l’asymétrie entre le vieux et le
jeune corps basal a un rôle critique dans la préservation de la chiralité
générale de la cellule [8]. Chez beaucoup d’unicellulaires eucaryotes, le même compromis est
observé : les cellules se déplacent ou se divisent. Ce comportement est
apparemment conservé chez les animaux. Chez tous les unicellulaires, le succès de la division dépend de la connexion
entre les pôles du fuseau mitotique et les corps basaux. Cette connexion peut
être indirecte, comme dans la pleuromitose4. Ainsi, les deux pôles mitotiques possèdent toujours une asymétrie
générationnelle, qui n’est pas limitée aux seuls corps basaux, mais peut
concerner aussi la membrane plasmique ou des membranes intracellulaires [9].
Quel que soit le scénario topologique de la division cellulaire, en même
temps que l’ADN est transmis symétriquement, les déterminants asymétriques
préassemblés de polarité propre sont transmis, condition pour que les deux
cellules post-mitotiques rétablissent rapidement une activité
unidirectionnelle tout en maintenant entre elles une continuité
générationnelle.
La migration cellulaire Bien que la grande majorité des unicellulaires eucaryotes soient flagellés [ 2], il existe des unicellulaires ancestraux
qui n’utilisent pas de flagelle pour se déplacer [ 10]. Le contenu génique de l’ancêtre
unicellulaire des métazoaires contient donc un répertoire très riche de gènes
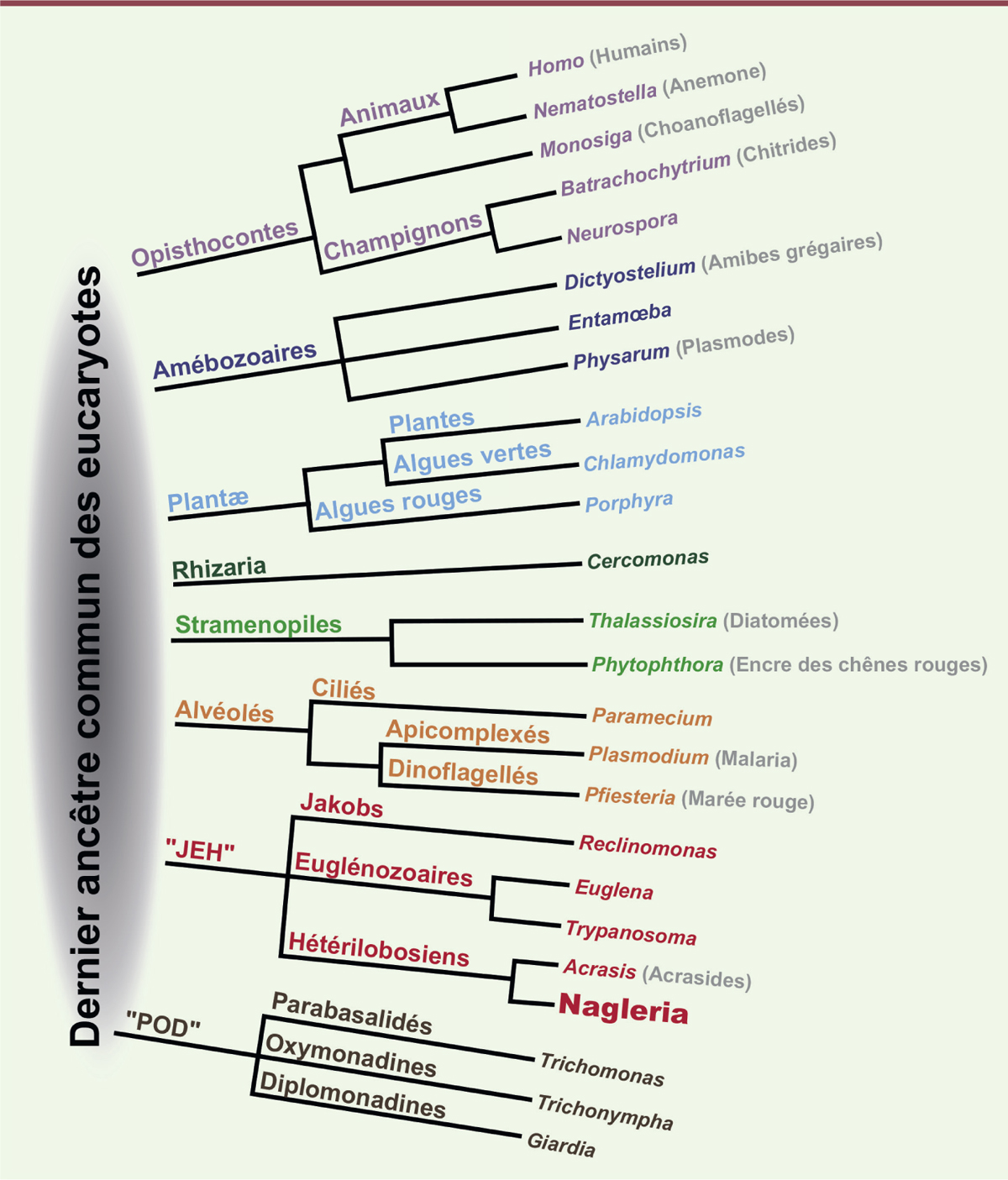
présents chez les animaux actuels [ 11, 12] (Figure
1). Le dernier ancêtre commun des eucaryotes était probablement
capable d’alterner entre nage et migration, en fonction de son cycle végétatif
ou de l’environnement. La transition entre les deux modes de locomotion peut
être rapide [ 12].
 | Figure 1.
Une vision de l’arbre des eucaryotes issue du séquençage
du génome de l’amiboflagellé Nægleria
gruberi. L’analyse de ce génome a révélé que, parmi les gènes
conservés dans chacun des lignages eucaryotes, plus de 4 000 étaient
présents chez l’ancêtre commun à tous les eucaryotes, témoignant que
ce dernier était probablement aussi complexe que les eucaryotes
unicellulaires actuels. Il était capable par exemple à la fois de
nage et de mouvement amiboïde (adapté de [ 12] et transcrit en français par Lara-Katharina
Kruger, UMR 144, Institut Curie). |
La migration cellulaire repose généralement sur un réseau d’actine qui possède
une plasticité considérable dans son organisation et sa composition. Il peut
produire une brisure de symétrie spontanée, maintenue par des boucles de
rétroaction positives. Une évolution du réseau de l’actine, impliquant ses
interactions avec les contacts de cellule à cellule et avec la matrice
extracellulaire, et du cytosquelette tout entier a accompagné le passage des
unicellulaires aux multicellulaires. Sensorimotricité cellulaire : un module fonctionnel évolutivement
contraint Bien que longtemps négligée, la capacité des cils/flagelles des unicellulaires
d’être des outils sensoriels est soutenue par de nombreuses données [ 13]. Sentir
l’environnement et s’y déplacer sont deux activités qui doivent être intégrées
au niveau de la cellule. Une locomotion aveugle, sans rétroaction sur l’activité
motrice en fonction des stimulus de l’environnement, serait probablement
inefficace. Tout gain évolutif dans la capacité de se déplacer serait
probablement défavorable s’il n’était accompagné par un gain dans la capacité de
sentir. Les unicellulaires migrant sur une surface assurent ainsi leur
sensorimotricité grâce à l’organisation du réseau de microfilaments d’actine.
Cela implique un réseau de signalisation hautement connecté entre les récepteurs
de surface et la plupart des compartiments intracellulaires, permettant à la
cellule amiboïde de résoudre des problèmes complexes. Un neutrophile poursuivant
une bactérie 5 adapte de toute évidence sa
migration aux mouvements de sa proie. La manière dont le réseau d’actine agit
sur les déterminants de polarité interne, tels que le système
centrosome-microtubules, n’est pas encore comprise de manière complète, mais les
interfaçages entre les deux réseaux sont très nombreux [ 14]. On peut soutenir l’affirmation provocatrice selon laquelle « a motile
cell is an ‘intelligent’ cell » ([15], p. 54), si l’on ajoute que
l’intégration de la motricité et de la sensorialité est fondamentalement
semblable à une action réflexe, qui se produit sans que le sujet ait à
penser, et que l’action réflexe est considérée depuis longtemps comme la
première étape dans l’apparition d’un mental identifiable [16]. Au niveau de
la cellule, la question est d’identifier l’équivalent des éléments logiques
d’une boucle réflexe. L’inépuisable plasticité des polymères polarisés dont l’assemblage consomme
de l’énergie Sans surprise, les polymères dissipant de l’énergie à partir du GTP ou de l’ATP
pour leur assemblage dynamique, ainsi que les moteurs moléculaires se déplaçant
grâce à l’ATP sur ces polymères, ont été des innovations critiques pour définir
la polarité d’unicellulaires eucaryotes au moins 10 fois plus gros que les
procaryotes. Le réseau cytoplasmique des microtubules des cellules animales
organise l’espace cellulaire. Chez la plupart des unicellulaires, la longueur de
persistance des microtubules est exploitée dans des réseaux corticaux qui
donnent aux cellules leur forme. Leur liaison à la membrane plasmique leur
confère une stabilité qui les rend résistants à l’isolement du cortex [ 17]. C’est le cas aussi
des 9 doublets périphériques des axonèmes 6,.
L’association des doublets périphériques à la membrane plasmique permet aux
forces produites par les dynéines 7
inter-doublets d’agir sur le milieu environnant. La gamme des propriétés des
microtubules a été sensiblement étendue récemment, et suggère la possibilité
d’un assemblage mécano-sensible [ 18].
Un large spectre de propriétés physiques modulables pourrait avoir été
exploité durant l’évolution cellulaire au moment de la transition entre la
pellicule pariétale de microtubules stables associés à la membrane plasmique
des unicellulaires, et l’organisation hautement versatile du réseau de
microtubules, organisé directement ou non par le centrosome, dans les
cellules différenciées des métazoaires.
|
La polarité propre des cellules et la transition vers la multicellularité La transition vers la multicellularité est l’un des problèmes les plus déroutants de
l’évolution biologique. Une question essentielle est de savoir comment une nouvelle
unité de sélection, démontrant des variations d’adaptation héritables, peut être
obtenue. Les conflits dans le groupe fondateur de cellules doivent être résolus pour
atteindre une unité de sélection à un niveau plus élevé, avec une coopération
augmentée entre les membres du groupe et une variation d’adaptation héritable au
niveau du groupe [19].
La transition vers une nouvelle unité de sélection est le résultat de
différents mécanismes favorisant l’alignement de l’adaptation des cellules. La
possibilité que ce remodelage dépende de mécanismes à l’échelle de la cellule
entière a rarement été envisagée dans la théorie évolutive.
La polarité propre des cellules n’est pas conservée chez tous les
multicellulaires Si on limite la comparaison aux trois principaux types d’organismes
multicellulaires, on constate qu’ils correspondent à des états multicellulaires
très différents. Ils sont apparus également à des périodes évolutives
différentes [ 10]. Les plantes à graines
ont perdu le flagelle ancestral ainsi que tout gène de dynéine. Les cellules
n’ont plus de polarité propre [ 20]. La cytocinèse ne se fait pas par fission et elle est
incomplète, les cellules maintenant entre elles des plasmodesmes 8. Les algues vertes unicellulaires, comme
Chlamydomonas, nagent en tirant leur corps cellulaire grâce
à deux flagelles symétriquement disposés qui traversent la paroi. La nage des
unicellulaires est en effet compatible avec la présence d’une paroi dans la
lignée verte, contrairement aux champignons et aux animaux. Des algues
unicellulaires très semblables, comme Volvox, peuvent former
des colonies parfaitement sphériques via des ponts
intercellulaires dus à l’interruption de la cytocinèse. Elles présentent une
claire division du travail entre les cellules somatiques périphériques
flagellées et les cellules germinales internes immobiles. Chaque cellule de la
colonie montre un décalage de l’orientation de la structure de connexion entre
le noyau et l’appareil flagellaire par rapport à son axe de symétrie, si bien
que chaque cellule peut nager en concertation avec les autres, permettant ainsi
à la colonie de nager comme un tout [ 21]. La colonie a une symétrie de rotation, qui implique
aussi une polarité dans le plan des cellules. La polarité de la colonie est donc
obtenue en contraignant la polarité interne des cellules individuelles. Les champignons sont le produit d’une évolution très complexe, et comprennent des
eucaryotes avec des cycles végétatifs très différents, depuis des espèces
multicellulaires avec des hyphes, jusqu’à des organismes unicellulaires, comme
la levure de boulanger Saccharomyces cerevisiae, ou la levure
fissile Schizosaccharomices pombe, qui résultent de transitions
secondaires. Les champignons « inférieurs » comme les chytrides9 ont des gamètes flagellés, alors que les
autres champignons ont perdu le flagelle, mais contrairement aux plantes, ont
conservé les gènes codant les dynéines. La perte du corps basal chez les
champignons s’est produite plusieurs fois et un corpuscule fusorial (SPB pour
spindle pole body), associé au noyau, a évolué à la place.
Le SPB se comporte comme le centrosome des cellules animales : il est associé
physiquement au noyau, il assure la nucléation et l’ancrage des microtubules en
interphase et en mitose, se duplique en phase S selon un mécanisme conservatif.
Les SPB dupliqués sont strictement nécessaires pour l’assemblage du fuseau
mitotique. Le remplacement du corps basal par le SPB s’accompagne toujours de
l’acquisition d’une paroi faite de chitine. Contrairement aux levures, modèles
plus simples d’étude de la polarité propre des cellules, les champignons
multicellulaires montrent une individuation cellulaire incomplète, depuis des
hyphes avec des centaines ou des milliers de noyaux jusqu’à des hyphes avec des
septa (ou segments) régulièrement espacés à larges pores,
souvent avec un contrôle du passage du cytoplasme et des organites, noyaux
compris, d’un segment à l’autre. Il n’y a pas de locomotion cellulaire, mais une
motilité intracellulaire incluant la migration des noyaux sur de grandes
distances le long des microtubules, grâce à la dynéine et à l’association d’un
SPB à chaque noyau [22]. Les métazoaires ne représentent qu’une petite fraction dans l’arbre des
eucaryotes [2], et pourtant la diversité
des formes animales est considérable. Contrastant avec les plantes et les
champignons chez lesquels la forme cellulaire est maintenue par une paroi
rigide, la forme des cellules animales reflète l’organisation spatiale de forces
internes principalement exercées par le réseau d’actine en réponse aux signaux
externes de la matrice extracellulaire ou des cellules voisines. La phylogénie
animale, aujourd’hui fondée sur l’analyse des génomes, est largement déconnectée
de l’évolution morphologique [23]. Les métazoaires sont cependant les seuls à faire des tissus
multicellulaires cohésifs à travers une succession de divisions cellulaires
complètes. Leurs tissus sont en permanence soumis à des forces variées, et le
développement des embryons utilise le plus souvent la migration des cellules sur
de grandes distances. Toutes ces activités requièrent une polarité propre des
cellules. Tout en conservant le flagelle ancestral, et à partir de lui, un
nouvel et double organite a été coopté, le cil primaire/centrosome
(primary cilium/centrosome organ ou PC/Corg), capable, en
fonction de l’état cellulaire dans un environnement donné, d’alterner entre un
cil primaire associé à la membrane plasmique et un centrosome associé au noyau
(Figures 2 et 3). Comme chez tous les
champignons et les animaux, la division cellulaire se termine par une fission
produite par la contraction de l’actine. Des mécanismes propres aux cellules
sont nécessaires pour contrôler les contacts intercellulaires, l’interaction
adhésive avec la matrice, l’orientation des axes de division, et le
repositionnement des cellules filles. Dans l’embryon syncitial précoce de la
mouche, la polarité corticale et les compartiments internes sont établis avant
la cellularisation [24]. Les centrosomes pourraient y jouer un rôle majeur dans
l’organisation du cytoplasme.
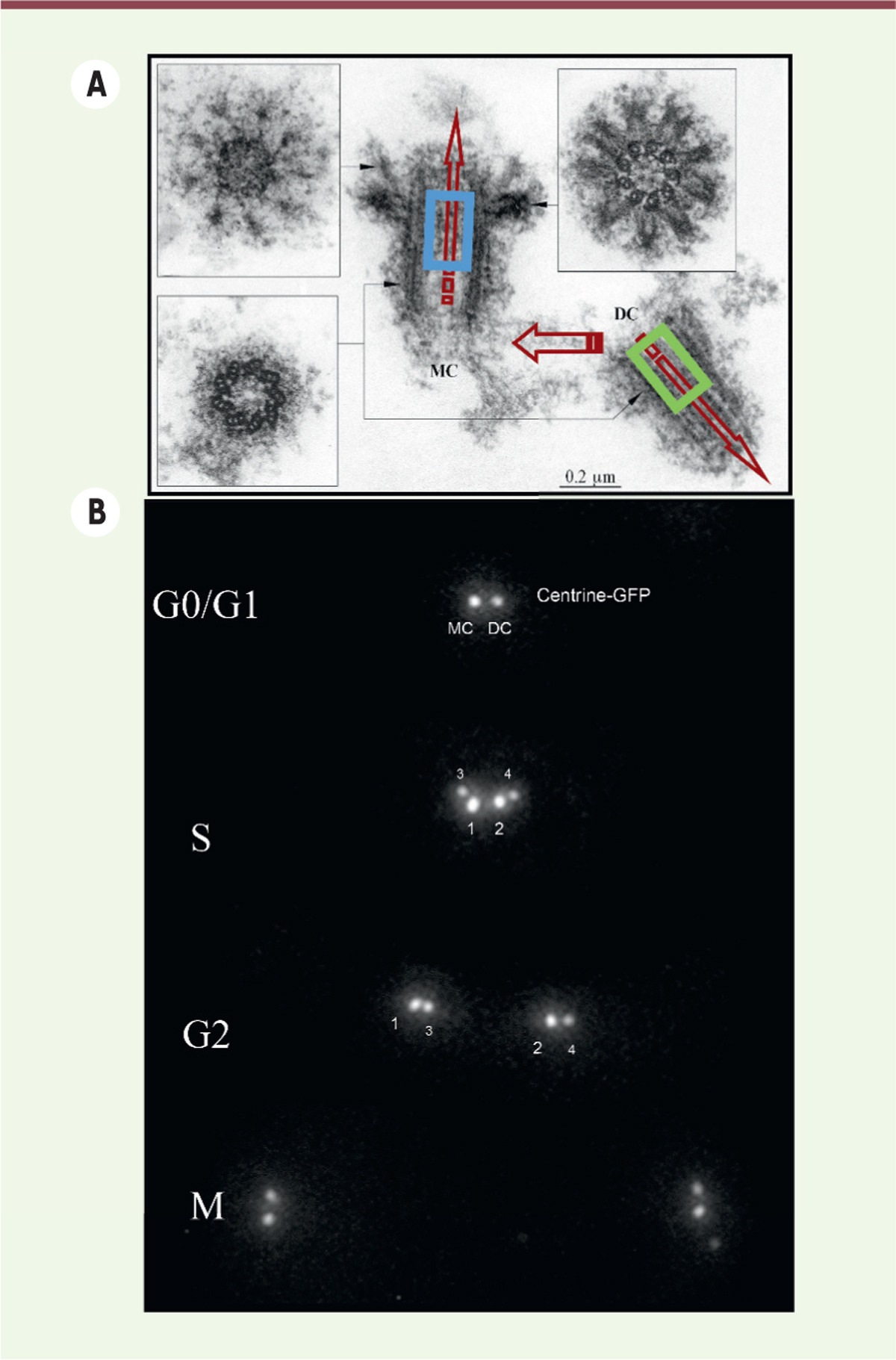
 | Figure 2. L’asymétrie constitutive du centrosome.
A. Ultrastructure d’un centrosome isolé de la
lignée lymphoblastique humaine KE37, montrant une polarité
constitutive (flèches rouges), qui est également liée à la
différence de génération entre les deux centrioles : le
centriole-père (MC) possède des bras distaux et sub-distaux
contrairement au centriole-fils (DC), qui est également 20 % plus
court. La concentration de centrine dans la lumière distale du
centriole parental (indiquée par un rectangle de couleur) est
supérieure à celle observée dans le centriole-fils (voir B). Chacun
des deux centrioles montre aussi une polarité proximo-distale
marquée. B. La reproduction du
centrosome repose sur la duplication conservative des deux
centrioles selon un décours temporel spécifique, révélé par
l’expression in vivo de la centrine-GFP qui se
concentre dans la lumière distale des centrioles (voir
A). |
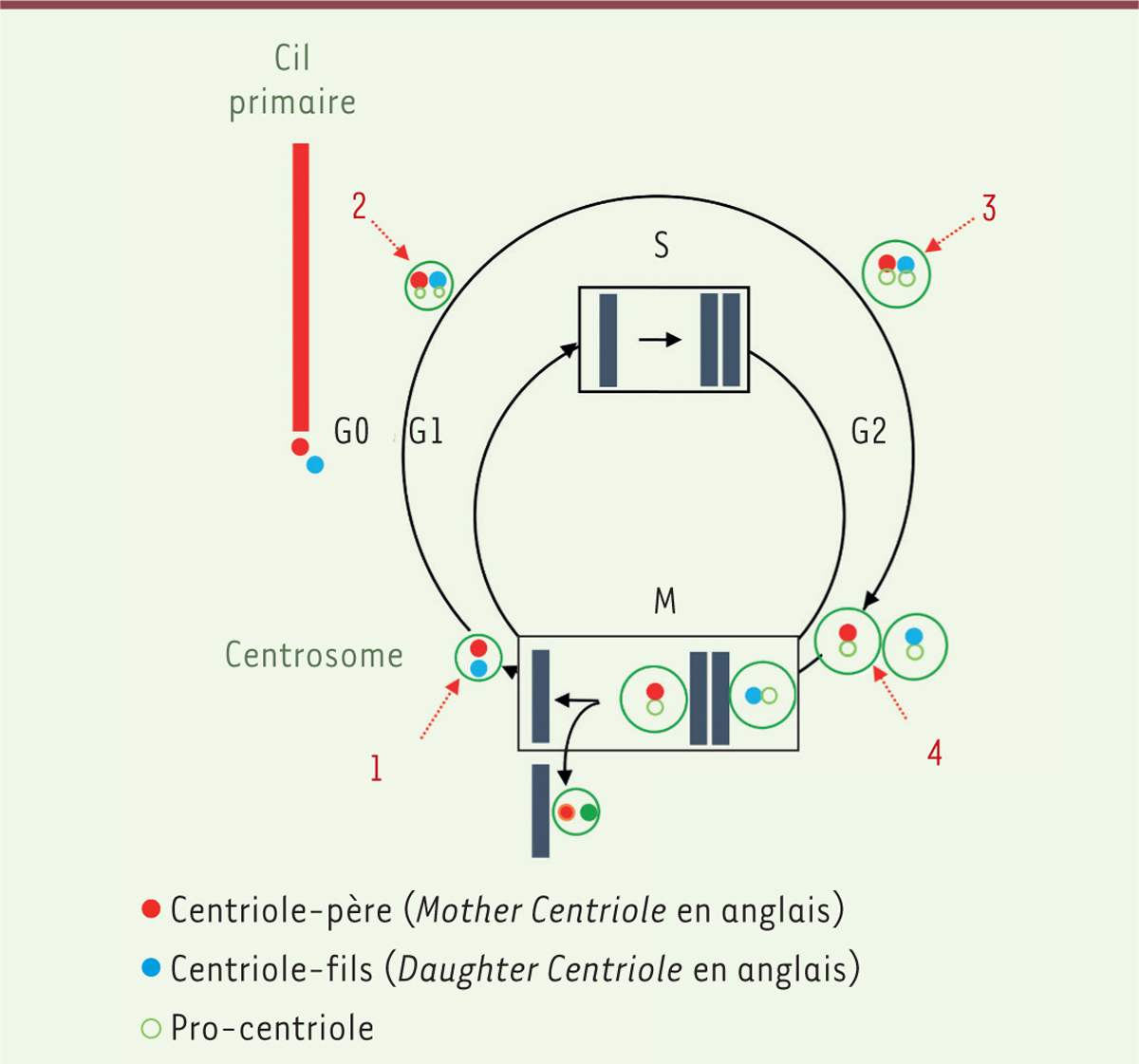
 | Figure 3.
Le cil primaire/centrosome est un organe sensoriel
marqueur de l’état prolifératif des cellules dans la plupart
des lignages de l’organisme. Le cycle de
reproduction du centrosome est coordonné avec celui des chromosomes.
Dans beaucoup de cellules en G0, dites quiescentes, un cil primaire
pousse à partir du centriole parental du centrosome. Les flèches
rouges indiquent quatre étapes critiques du cycle du centrosome :
(1) le désengagement des deux centrioles en fin de mitose ; (2) le
démarrage de la duplication des centrioles à l’interface G1/S ; (3)
la maturation du centrosome en G2 ; (4) la ségrégation des deux
centrosomes en pré-prophase. |
La possibilité que le PC/Corg soit une innovation critique pour
préserver la polarité propre des cellules dans la transition vers les
métazoaires mérite donc d’être explorée.
La conservation d’une polarité cellulaire propre est-elle à l’origine des
métazoaires ? Plusieurs scenarios ont été proposés pour la transition vers les métazoaires. À
côté de l’ancienne hypothèse de la Gastræa 10,, l’hypothèse dite de la synzoospore 11, due à Zakhvatkin [ 25] a été récemment remise en lumière [ 10]. Quand le PC/Corg est-il apparu pour la
première fois ? La présence de cils primaires immobiles avec une structure (9+0)
(les cils immobiles ont des axonèmes dépourvus de la paire centrale de
microtubules) et utilisant des canaux calciques a été établie dans l’osculum des
éponges, une structure en forme de cheminée à travers laquelle l’eau sort de
l’éponge [ 26].
L’osculum fonctionnerait comme un système sensoriel détectant les changements de
flux et contrôlant la réponse de l’éponge toute entière. Ainsi, les porifères
(qui rassemblent des organismes pluricellulaires peu complexes chez lesquels il
n’y a pas de véritables tissus ni d’organes, tels que les éponges) et qui n’ont
ni muscles ni nerfs conventionnels, ont cependant une sensorialité et répondent
aux changements dans le fluide environnant. Un tel réseau organisé de cils
primaires pourrait représenter une première étape dans l’évolution de systèmes
sensoriels de coordination, suggérant qu’une pression de sélection sur la
sensorialité était à l’origine de la capacité des cellules individuelles des
organismes multicellulaires de déclencher des réponses coordonnées à
l’environnement. Un scenario raisonnable de la transition des unicellulaires vers les animaux
pourrait être qu’une pression de sélection pour maintenir une polarité propre
des cellules, nécessaire pour que les cellules individuelles sentent
l’environnement et déclenchent des réponses coordonnées, ou pour être placées de
manière concertée dans les tissus, ait favorisé la cooptation, à partir du corps
basal/flagelle des unicellulaires ancestraux, d’un nouvel organe cellulaire. Ce
dernier serait capable d’adopter deux versions inter-convertibles en fonction de
l’environnement ou de l’état prolifératif des cellules individuelles amiboïdes :
le cil primaire non vibratile associé à la membrane plasmique, et le centrosome,
organite associé au noyau, constitué autour de corps basaux/centrioles. Cette
transition aurait été progressive dans le lignage multicellulaire animal : chez
beaucoup d’animaux dits inférieurs, tels les cnidaires, la plupart des cellules
ont un cil/flagelle vibratile qui leur permet de nager.
Le nouveau PC/Corg, qui maintient l’une ou l’autre des extrémités de la
connexion ancestrale noyau-corps basaux, aurait été sélectionné sur la même
fonction intégrée de sensorimotricité que le flagelle ancestral, et serait
distribué sous une version ou sur l’autre, dans des cellules différentes, ou
dans la même cellule à des moments différents. Il participerait aussi de
manière primordiale à la transmission de la polarité propre des
cellules-mères aux cellules-filles durant la division. Dans tous les cas,
ces cellules doivent être des mécano-senseurs très performants, capables de
donner forme à des tissus mous, eux-mêmes mécano-sensibles, dans des
organismes doués de locomotion.
Le nouvel organe permet un changement d’organisation de la polarité propre
des cellules en fonction du contexte cellulaire Les fonctions du cil primaire et du centrosome ont fait l’objet de nombreuses
revues, y compris dans des ouvrages collectifs ; voir par exemple le numéro
thématique de médecine/sciences sur les cils primaires et
ciliopathies ( →).
(→) Voir le numéro thématique Cils primaires et
ciliopathies, m/s n° 11, novembre 2014, pages 935-1 046
Rappelons seulement que le cil primaire est un organite sensoriel unique, une «
antenne », au rôle critique dans beaucoup de cellules post-mitotiques, recevant
de nombreuses signalisations dont la combinatoire est loin d’être comprise, et
que le centrosome est un organite unique, toujours à la recherche d’une
définition générique. On ne peut en effet espérer arriver à une compréhension
complète des fonctions du centrosome dans divers organismes sans une analyse
comparative de l’économie cellulaire résultant de la stratégie de survie de
chaque organisme. Le consensus général a été longtemps que la première fonction des
centrioles dans les cellules animales était de servir de modèle structural
pour la pousse des cils ou des flagelles et que leur rôle dans les
centrosomes aux pôles du fuseau mitotique, s’il existait, était
secondaire [27]. Cependant, si le PC/Corg des métazoaires a évolué par
filiation directe à partir du flagelle des ancêtres unicellulaires, on est
conduit à penser différemment : c’est parce que les corps basaux des
unicellulaires non seulement servent de modèle structural pour les axonèmes,
mais également participent à tout le processus de division cellulaire depuis
leur position pariétale, que ces deux fonctions pouvaient être associées à
deux versions de l’organite ancestral dans le contexte multicellulaire
(Figure 3). Une version, le cil
primaire, maintient une position pariétale, lorsque les cellules sont
quiescentes, au contact avec le milieu interstitiel, tandis que l’autre, le
centrosome, maintient une position juxtanucléaire, dans les cellules qui
prolifèrent, ou dans les cellules circulantes qui ont une signalisation et
une communication polarisée avec les autres cellules, ou encore dans des
cellules appartenant à un tissu entièrement cohésif. La transition
uni-multicellulaires aurait imposé chez les animaux deux versions d’un
organite fondé sur les corps basaux de manière à accommoder les nouvelles
contraintes topologiques dans les organismes multicellulaires, permettant
ainsi la croissance des tissus tout en préservant la sensorimotricité des
cellules individuelles. |
La polarité propre des cellules et l’évolution de l’individualité Tout centrosome possède une différence de génération entre ses deux centrioles
(Figure 2), qui se
retrouve chez les deux centrosomes après ségrégation en phase G2-M, et qui est
exploitée durant le développement pour distribuer les déterminants de destin
cellulaire [28], ou pour
maintenir les pools de cellules souches. Cette différence de génération entre les
deux centrosomes au moment de la division a-t-elle le moindre rôle dans la
transmission de la lignée germinale durant le développement de l’embryon ? |
Transmission de la lignée germinale durant le développement La manière dont les cellules germinales sont spécifiées est extrêmement variable
selon les espèces. Une spécification précoce est un élément critique de la doctrine
de « la continuité du plasme germinal » due à Weismann, qui est à la base de la
théorie synthétique de l’évolution [19]. Une
différenciation terminale précoce de la lignée germinale est loin d’être générale
[19]. C’est un caractère limité à
quelques taxons d’animaux supérieurs chez lesquels l’individualité est un caractère
dérivé propre [19]. Chez les nématodes et chez les mouches, les cellules germinales se forment très tôt,
durant le début du développement du zygote. Les mécanismes sont très différents,
mais dépendent cependant l’un et l’autre de l’orientation du fuseau mitotique et de
la différence de génération entre les deux pôles. Chez la plupart des animaux, les
cellules germinales une fois spécifiées migrent dans les gonades en formation où se
produisent la méiose et la gamétogenèse. Dans les ovocytes de la plupart des espèces
animales, y compris l’espèce humaine, le corps de Balbiani12, forme un important compartiment asymétrique, non délimité
par une membrane. Chez le poisson-zèbre, la formation du corps de Balbiani et la
polarisation de l’ovocyte sont apparemment couplées à l’appariement des chromosomes
méiotiques homologues par le centrosome de l’ovocyte, durant l’étape conservée du
bouquet13 [29]. Dans la plupart des espèces animales, le
centrosome est éliminé durant la méiose de l’ovocyte. La polarité du zygote est
rétablie à la fécondation. Le centrosome est l’objet, durant la spermatogénèse,
d’une transformation des centrioles en corps basaux du flagelle, avant de se
transformer de nouveau en centrioles du centrosome du zygote. Bien que loin d’être décrite de manière complète dans la plupart des modèles, la
préservation de la polarité propre des cellules durant la gamétogenèse mâle et
femelle et la fécondation est apparemment critique. |
Régénération et reproduction asexuée : comment sont-elles associées ? La capacité de certains animaux de régénérer les parties manquantes est une propriété
très variable d’une espèce à l’autre. Généralement, les animaux capables de
reproduction asexuée sont également capables de régénérer facilement leurs tissus.
Nombre d’espèces en forme de ver sont capables de régénération postérieure, mais pas
antérieure [30]. Ce fait
indique que la capacité de régénération respecte la polarité de l’organisme. Chez
les animaux à la reproduction sexuée obligatoire, la capacité de régénération est
généralement considérablement diminuée [30].
Existe-t-il une propriété cellulaire pouvant éclairer cette association de la
reproduction asexuée avec la capacité de régénérer le corps de l’animal en
respectant sa polarité ? Les planaires (des vers plats aquatiques de la famille des
plathelminthes) dont certaines espèces sont bien connues pour leur remarquable
capacité à régénérer, grâce à des cellules souches pluripotentes, les néoblastes, à
l’origine de tous les types cellulaires. Un seul néoblaste peut sauver un animal
irradié de manière létale. Une souche asexuée de Schmidtea
mediterranea, l’espèce la plus utilisée, est capable de se reproduire
asexuellement indéfiniment. Le génome de S. mediterranea a pu être
récemment assemblé [31]. De
manière remarquable, ces planaires ont perdu nombre de gènes essentiels, tels que
MAD (mitotic arrest deficient) 1 et 2, composants au cœur du
contrôle de l’assemblage du fuseau mitotique (ou SAC pour spindle assembly
checkpoint), ainsi que beaucoup d’autres composants du SAC. Or MAD1 et
MAD2 sont très conservés, y compris chez les vers plats. Apparemment, ces planaires
ont développé une autre réponse de type SAC en l’absence des composants canoniques.
Cette absence du SAC classique est probablement reliée à une autre perte remarquable
dans l’évolution des planaires, celle du PC/Corg [32] : la dynamique du SAC dépend de manière
critique de la localisation des différents complexes, la perte des centrosomes aux
pôles du fuseau des néoblastes ayant probablement un impact sur l’ensemble du
réseau. Ainsi, bien que ces planaires se déplacent en glissant sur les cils vibratiles des
cellules épithéliales multiciliées et produisent des spermatozoïdes biflagellés,
elles n’ont ni centrosome ni cil primaire dans les néoblastes, seules cellules
capables de se diviser. Tous les gènes contrôlant l’assemblage de corps
basal/centriole trouvés chez les unicellulaires ou les métazoaires sont présents.
Quelques gènes codant des composants clés dans la formation du centrosome, tels que
SPD2 (spindle-defective protein 2)/Cep192 (centrosomal
protein 192kDa), sont absents. Le clivage spiral, qui caractérise ce
clade, est perdu. Toutes ces propriétés sont spécifiques : le ver plat
Macrostomum lignano a des centrosomes dans les néoblastes, se
reproduit sexuellement, se développe selon un clivage spiral et son pouvoir de
régénération est faible. Peut-on interpréter ces données dans le cadre de l’évolution de la
multicellularité ? Est-il possible que les organismes animaux utilisent, de
manière plus cryptique, l’équivalent de la stratégie observée dans les colonies
de Volvox, où la polarité de l’organisme multicellulaire impose des changements
de l’axe de polarité des cellules individuelles en fonction de leur position
dans la colonie ? En d’autres termes, est-il possible qu’une part du remodelage
nécessaire à une organogénèse réussie, soit déclenchée par des conflits précoces
entre les polarités propres des cellules, qui doivent être résolus pour
préserver une polarité globale de l’organisme ? La plupart des animaux utilisent la voie Wnt canonique pour contrôler leur axe
antéro-postérieur. Ce rôle de Wnt est très ancien. Il est antérieur à l’évolution
des animaux à symétrie bilatérale : il influence aussi l’axe primaire de polarité
chez les cnidaires [33].
Active à l’arrière et inhibée à l’avant, la voie Wnt est conservée dans la
définition de l’axe des protostomiens et des deutérostomiens14, y compris chez les planaires où l’axe de polarisation est
indépendant des mouvements de tissus et des événements liés au développement qui se
produisent pendant la gastrulation chez la plupart des autres espèces. Durant la
régénération, les planaires rétablissent les identités axiales par une activité
β-caténine élevée à la partie postérieure de la blessure et une activité β-caténine
faible à la partie antérieure de la blessure. Par ailleurs, la β-caténine a été
localisée au niveau du centrosome, où elle participerait à la progression mitotique
[34]. Elle se lie à, et
est phosphorylée par Nek2 (NIMA (never in mitosis gene a)-related kinase
2), qui contrôle la cohésion du centrosome. Les protéines d’interaction
de la β-caténine participant à la voie Wnt ont été aussi localisées au niveau du
centrosome. Finalement, une distribution asymétrique des composants de la voie
Wnt-β-caténine oriente le plan de division et dirige la transmission asymétrique des
centrosomes [35]. La polarité cellulaire dans le plan (PCP, planar cell polarity) est
une propriété clé de beaucoup de tissus adultes, comprenant Frizzled (Fz), le
récepteur membranaire de Wnt, qui définit et coordonne la polarité des cellules
statiques et mobiles. La voie PCP est cruciale pour le contrôle de l’orientation des
corps basaux et pour la coordination de la direction du battement ciliaire dans
beaucoup d’épithéliums multiciliés chez les vertébrés. La voie Fz-PCP est
probablement aussi une propriété ancestrale des métazoaires, apparue avec la
multicellularité. Des arguments évolutifs suggèrent que la voie Fz-PCP est
responsable de la nage et de la prise de nourriture orientées en relation avec
l’orientation du corps dans beaucoup de types larvaires ciliés dans le lignage
animal [36]. La voie Fz-PCP
et la spécification de l’axe dépendant de Wnt/b-caténine pourraient donc avoir été
coordonnées chez les premiers métazoaires, grâce à la participation d’un ligand
commun de Wnt. Certains composants essentiels de la voie PCP étaient apparemment
absents des organismes unicellulaires ancestraux. Wnt est apparu avec la
multicellularité animale tandis que des composants participant à la forme cellulaire
ou à la migration étaient présents dans les organismes unicellulaires ancestraux
[36].
Ainsi, les centrioles ou corps basaux pourraient être utilisés par les voies
de signalisation responsables du développement de l’embryon comme des outils
pour positionner les cellules. En leur absence, comme chez les planaires, la
mise en place de l’axe par la voie Wnt coordonnée à la voie Fz-PCP ne serait pas
perturbée, même après interruption physique par coupure. Cette situation
préserverait le potentiel prolifératif des cellules, permettant au corps de
régénérer à partir d’une partie grâce aux cellules pluripotentes.
Chez les autres animaux, la spécification de l’axe par la voie Wnt serait
modifiée tout au long, chaque fois que les cellules, avec leur polarité propre,
répondraient à la signalisation et modifieraient leur position, l’orientation de
leurs divisions, la durée de leur cycle de division ou l’expression génique.
Cela conduirait à des organes cohérents, construits par des cellules
positionnées de telle façon que toutes les polarités individuelles soient
correctement orientées à l’échelle de l’organe pour son activité. Chaque tissu a
ses propres cellules souches. Elles agissent comme cellules progénitrices,
exploitant l’asymétrie du PC/Corg de manière spécifique, pour la croissance ou
pour la migration. Cela représenterait une solution, élaborée au cours du
développement de l’embryon, permettant aux polarités propres des cellules dans
les organes et à la polarité de l’organisme tout entier, d’être compatibles. Le
corollaire serait que l’organisme ne pourrait se régénérer à partir d’une
partie, ni se reproduire asexuellement. Dans cette vision, la capacité
différente des organismes à régénérer des tissus serait à chercher à l’échelle
cellulaire, dans la capacité des cellules à exprimer une polarité propre plus ou
moins forte, leur permettant de répondre à la spécification de l’axe du
corps.
|
Intégration de la sensorimotricité et développement cérébral La démonstration que la plupart des gènes MCPH (microcephaly primary
hereditary) responsables de la microcéphalie primaire chez l’homme
codent une protéine ayant quelque rôle dans le cil primaire ou le centrosome,
suggère des contraintes spécifiques liées au PC/Corg au cours du développement du
cerveau [37]. Le cerveau
est l’organe dans lequel la polarité propre des cellules est exploitée dans ses
ultimes possibilités. La neurogenèse est un processus très complexe dans lequel la
balance spatiale et temporelle entre prolifération et différenciation est
précisément régulée. L’orientation du fuseau mitotique joue un rôle clé dans cette
régulation. Les cellules filles qui maintiennent l’identité des cellules souches
dans le néocortex de la souris héritent préférentiellement du centriole parental sur
lequel pousse le cil primaire. Le centriole parental est capable de retenir la
membrane ciliaire, permettant ainsi une reformation précoce du cil qui se traduit
par une signalisation précoce dans la cellule correspondante. De plus, la
reformation du cil primaire dans les cellules filles en cours de différenciation se
produit sur le côté baso-latéral au lieu du pôle apical. C’est apparemment le
premier événement cellulaire identifiable avant la délamination des progéniteurs
neuronaux de la ceinture des jonctions adhérentes apicales du neuro-épithélium
[38]. Cela fournit un
exemple direct du rôle du PC/Corg dans la réorientation de la polarité cellulaire
durant la morphogenèse.
Le développement d’un organe d’intégration de l’information sensorimotrice
comme le cerveau implique donc beaucoup de contraintes liées spécifiquement au
PC/Corg, soit au centrosome et à son rôle durant la division, soit au cil
primaire et à son rôle dans la signalisation, soit aux deux, ce qui pourrait
expliquer sa susceptibilité particulière aux mutations dans les gènes gouvernant
l’assemblage ou l’activité du PC/Corg.
Il a été proposé que le contrôle de la nage pourrait être à l’origine des circuits
neuronaux [39]. Au stade
larvaire pluteus
15 de beaucoup d’animaux marins, des rangées
de cils dont l’organisation est très conservée dans l’évolution, servent à déplacer
la larve multicellulaire en même temps que leur battement attire les proies
planctoniques [40]. Comme
pour les organismes unicellulaires, un compromis entre prise de nourriture et nage
existe, qui varie en fonction de l’environnement, et qui potentiellement implique le
contrôle neuronal des cils. |
Ce survol a commencé avec la proposition que l’intégration de la sensorialité et de
la motricité était la principale fonction évolutivement contrainte imposant une
organisation polarisée chez les ancêtres unicellulaires. Et que le corps
basal/flagelle permettait de surcroît une prise de nourriture efficace pour la
cellule en déplacement et jouait un rôle clé dans la transmission de cette fonction
à chaque génération. Ce survol se termine sur le rôle du PC/Corg, coopté chez les
métazoaires à partir du corps basal/flagelle ancestral, dans la morphogenèse de
l’organe responsable de l’intégration sensorimotrice centralisée dans l’espèce
humaine. C’est un exemple de la conservation évolutive d’un module fonctionnel
contraint : il conduit à sélectionner des stratégies de survie semblables à
plusieurs échelles, pour les uni- et les multicellulaires, qui reposent sur les
mêmes mécanismes moléculaires et cellulaires. Ce survol a également discuté du rôle
potentiel du PC/Corg cellulaire dans l’établissement de l’individualité biologique
chez les métazoaires. Le même PC/Corg apparait comme ayant un rôle critique dans le
développement du cerveau, donc dans le développement potentiel d’une individualité
comportementale.
Au-delà des conséquences critiques pour le développement de l’embryon et
pour l’histogenèse, la conservation d’une polarité propre des cellules à la
transition vers la multicellularité dans le lignage animal, et sa transmission à
travers les divisions cellulaires, grâce à l’innovation du cil primaire et du
centrosome et à leur conversion réciproque en fonction de l’état de la cellule,
et grâce au mode conservatif de reproduction du corps basal-centriole, pourrait
avoir eu des implications de grande portée pour l’évolution de l’individualité
chez les métazoaires.
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Anderson
PW. More is
different . Science . 1972; ;
177 :
:393.–396. 2. Adl
SM,
Simpson
AG,
Lane
CE, et al.
The revised classification of eukaryotes .
J Eukaryot Microbiol . 2012; ;
59 :
:429.–493. 3. Azimzadeh
J,
Bornens
M
Nigg
E. The centrosome in
evolution . Centrosomes in development and
disease . 2004 ; New
York: : Wiley; :
:93.–121. 4. Yubuki
N,
Leander
BS. Evolution of
microtubule organizing centers across the tree of
eukaryotes . Plant J . 2013; ;
75 :
:230.–244. 5. Moestrup
HT. Ultrastructure
of the flagellar apparatus in Pyramimonas octopus (Prasinophyceae). II.
Flagellar roots, connecting fibres, and numbering of individual flagella in
green algae . Protoplasma . 1989;
; 148 : :41.–56. 6. Salisbury
JL,
Baron
A,
Surek
B,
Melkonian
M. Striated
flagellar roots: isolation and partial characterization of a
calcium-modulated contractile organelle . J Cell
Biol . 1984; ; 99 :
:962.–970. 7. Ogbadoyi
EO,
Robinson
DR,
Gull
K. A highorder
trans-membrane structural linkage is responsible for mitochondrial genome
positioning and segregation by flagellar basal bodies in
trypanosomes . Mol Biol Cell .
2003; ; 14 :
:1769.–1779. 8. Holmes
JA,
Dutcher
SK. Cellular
asymmetry in Chlamydomonas reinhardtii . J Cell
Sci . 1989; ; 94 :
:273.–285. 9. Taniguchi
K,
Shao
Y,
Twonshend
RF, et al.
An apicosome initiates selforganizing morphogenesis of human
pluripotent stem cells . J Cell Biol .
2017; ; 216 :
:3981.–3990. 10. Sebe-Pedro´s
A,
Degnan
BM,
Ruiz-Trillo
I. The origin of
Metazoa: a unicellular perspective . Nat Rev
Genet.
2017;; 18 :
:498.–512. 11. Fritz-Laylin
LK,
Prochnik
SE,
Ginger
ML, et al.
The genome of Naegleria gruberi illuminates early eukaryotic
versatility . Cell . 2010; ;
140 :
:631.–642. 12. Fritz-Laylin
LK,
Ginger
ML,
Walsh
C, et al.
The Naegleria genome: a free-living microbial eukaryote lends
unique insights into core eukaryotic cell biology .
Res Microbiol . 2011; ; 162 :
:607.–618. 13. Ginger
ML,
Portman
N,
McKean
PG. Swimming with
protists: perception, motility and flagellum assembly .
Nat Rev Microbiol . 2008; ; 6 :
:838.–850. 14. Farina
F,
Gaillard
J,
Guérin
C, et al.
The centrosome is an actin organizing centre .
Nat Cell Biol . 2016; ; 18 :
:65.–75. 15. Bray
D. Cell movements: from
molecules to motility. (2nd ed.) , 2nd ed.
Boca Raton, FL: : CRC
Press; , 2001. 16. Sherrington
C.. Man on his
nature . 1963 ; Cambridge,
UK: : Cambridge University
Press; , 17. Sherwin
T,
Gull
K. Visualization of
detyrosination along single microtubules reveals novel mechanisms of
assembly during cytoskeletal duplication in trypanosomes .
Cell . 1989; ; 57 :
:211.–221. 18. Aumeier
C,
Schaedel
L,
Gaillard
J, et al.
Self-repair promotes microtubule rescue .
Nat Cell Biol . 2016; ; 18 :
:1054.–1064. 19. Buss
LW. The evolution of
individuality . 1987 ; Princeton,
NJ: : Princeton University
Press; , 20. Dettmer
J,
Friml
J. Cell polarity in
plants: when two do the same, it is not the same .
Curr. Opin Cell Biol . 2011; ;
23 :
:686.–696. 21. Hoops
HJ. Motility in the
colonial and multicellular Vovocales: structure, function and
evolution . Protoplasma . 1997; ;
199 :
:99.–112. 22. Morris
NR,
Enos
AP. Mitotic gold in
a mold: Aspergillus genetics and the biology of mitosis .
Trends Genet . 1992; ; 8 :
:32.–37. 23. Telford
MJ,
Budd
GE,
Philippe
H. Phylogenomic
insights into animal evolution . Curr Biol .
2015; ; 25 :
:R876.–R887. 24. Mavrakis
M,
Rikhy
R,
Lippincott-Schwartz
J. Plasma membrane
polarity and compartmentalization are established before cellularization in
the fly embryo . Dev Cell . 2009;
; 16 : :93.–104. 25. Mikhailov
KV,
Konstantinova
AV,
Nikitin
MA, et al.
The origin of Metazoa: a transition from temporal to spatial cell
differentiation . Bioessays .
2009; ; 31 :
:758.–768. 26. Ludeman
DA,
Farrar
N,
Riesgo
A, et al.
Evolutionary origins of sensation in metazoans: functional
evidence for a new sensory organ in sponges . BMC
Evol Biol . 2014; ; 14 :
:3.. 27. Debec
A,
Sullivan
W,
Bettencourt-Dias
M. Centrioles:
active players or passengers during mitosis? . Cell
Mol Life Sci . 2010; ; 67 :
:2173.–2194. 28. Lambert
JD,
Nagy
LM. Asymmetric
inheritance of centrosomally localized mRNAs during embryonic
cleavages . Nature . 2002; ;
420 :
:682.–686. 29. Elkouby
YM,
Jamieson-Lucy
A,
Mullins
MC. Oocyte
polarization is coupled to the chromosomal bouquet, a conserved polarized
nuclear configuration in meiosis . PLoS
Biol . 2016; ; 14 :
:e1002335.. 30. Bely
AE. Distribution of
segment regeneration ability in the Annelida . Integr
Comp Biol . 2006; ; 46 :
:508.–518. 31. Grohme
MA,
Schloissnig
S,
Rozanski
A, et al.
The genome of Schmidtea mediterranea and the evolution of core
cellular mechanisms . Nature .
2018; ; 554 :
:56.–61. 32. Azimzadeh
J,
Wong
ML,
Downhour
DM, et al.
Centrosome loss in the evolution of planarians .
Science . 2012; ; 335 :
:461.–463. 33. Petersen
CP,
Reddien
PW. Wnt signaling
and the polarity of the primary body axis .
Cell . 2009; ; 139 :
:1056.–1068. 34. Mbom
BC,
Nelson
WJ,
Barth
A. beta-catenin at
the centrosome: discrete pools of b-catenin communicate during mitosis and
may co-ordinate centrosome functions and cell cycle
progression . Bioessays . 2013; ;
35 :
:804.–809. 35. Habib
SJ,
Chen
BC,
Tsai
FC, et al.
A localized Wnt signal orients asymmetric stem cell division in
vitro . Science . 2013; ;
339 :
:1445.–1448. 36. Lapebie
P,
Borchiellini
C,
Houliston
E. Dissecting the
PCP pathway: one or more pathways? Does a separate Wnt-Fz-Rho pathway drive
morphogenesis? . Bioessays .
2011; ; 33 :
:759.–768. 37. Chavali
PL,
Pütz
M,
Gergely
F. Small organelle,
big responsibility: the role of the centrosome in development and
disease . Phil Trans RSoc.
2014;; B 369:
:20150468.. 38. Wilsch-Brauninger
M,
Peters
J,
Paridaen
ML,
Huttner
WB. Basolateral
rather than apical primary cilia on neuroepithelial cells committed to
delamination . Development .
2012; ; 139 :
:95.–105. 39. Jekely
G. Origin and early
evolution of neural circuits for the control of ciliary
locomotion . Proc R Soc.
2011;; B 278 :
:914.–22. 40. Gilpin
W,
Prakash
VN,
Prakash
M. Vortex arrays and
ciliary tangles underlie the feeding-swimming trade-off in starfish
karvae . Nat Phys . 2017; ;
13 :
:380.–386. 41. Bornens
M.. Cell polarity:
having and making sense of direction: on the evolutionary significance of
the primary cilium/ centrosome organ in Metazoa .
Open Biol . 2018; ; 8 :
:180052.. doi: 10.1098/rsob.180052. |