| |
| Med Sci (Paris). 35(5): 470–477. doi: 10.1051/medsci/2019090.Les organoïdes rénaux Clara Steichen,1,2* Sébastien Giraud,1,3 and Thierry Hauet1,2,3 1Inserm U1082 – IRTOMIT (Ischémie reperfusion en
transplantation d’organes mécanismes et innovations
thérapeutiques), Poitiers, F-86000, France 2Université de Poitiers, Faculté de médecine et de
pharmacie, Poitiers, F-86000, France 3CHU de Poitiers, service de biochimie,
Poitiers, F-86000, France |

Vignette (Cellules épithéliales bordant une lumière au sein d’un organoïde rénal dérivé
d’iPSC [microscopie électronique], photo © Clara Steichen). En néphrologie, les modèles couramment utilisés en recherche fondamentale et
translationnelle ont leurs limites : les modèles in vitro sont
restreints à l’observation d’un seul type cellulaire, sans prise en compte des
interactions intercellulaires et environnementales caractéristiques d’un tissu ; les
modèles animaux, de l’organe isolé à l’animal entier, sont intégratifs, physiologiques
et plus prédictifs, mais chaque être vivant d’un groupe d’essai peut réagir différemment
à un traitement, induisant des biais non négligeables. Ils sont également liés à des
coûts et des temps de manipulation élevés, d’autant plus que les lois éthiques limitent
l’utilisation des êtres vivants à des fins scientifiques [1] (→).
(→) Voir la Synthèse de H. Hardin Pouzet et S. Morosan, m/s n° 2,
février 2019, page 153
S’orienter vers un modèle intermédiaire est donc une nécessité et les organoïdes rénaux
dérivés de cellules souches pluripotentes représentent une alternative judicieuse à
cette problématique. |
Origine du rein et des cellules progénitrices rénales Le rein est issu du feuillet intermédiaire de l’embryon, le mésoderme.
Spécifiquement, c’est du mésoderme intermédiaire que dérivent les deux tissus
précurseurs du rein, le bourgeon urétéral (BU, une structure épithéliale) et le
mésenchyme métanéphrique (MM, un tissu mésenchymateux). Entre ces deux structures,
existent des interactions inductives réciproques aboutissant à la formation du
metanephros, la structure mature du rein chez les mammifères
[2]. En effet, des
signaux provenant des cellules du MM, dont le facteur de survie neuronale
glial-derived neurotrophic factor, induisent la formation du BU
à partir du canal de Wolff1. Le BU envahit le
MM, notamment en sécrétant WNT(wingless-type MMTV integration site
family)9b, un membre de la famille des protéines WNT impliquées dans la
modulation de la différenciation et de la maturation cellulaires, attirant les
cellules du MM qui s’y condensent et forment la coiffe mésenchymateuse (CM). Cette
dernière est la niche dans laquelle se situent les cellules progénitrices rénales
(nephron progenitor cells, ou NPC). Ces cellules expriment
spécifiquement Osr1 (odd-skipped related transciption factor 1),
Pax2 (paired box protein pax-2) et Six1 (sine oculis
homeobox homolog 1), nécessaires à leur auto-renouvellement, ainsi que
la vimentine, un marqueur mésenchymateux. En réponse aux signaux du BU, ces cellules
sécrètent WNT(wingless-type MMTV integration site family)4, un
membre de la famille des protéines WNT impliquées dans la modulation de la
différenciation et de la maturation cellulaires qui agit de façon autocrine et
induit l’épithélialisation. Cette transition mésenchymo-épithéliale s’accompagne de
l’expression de la E-cadhérine. Dans ce même temps, s’éteignent les gènes
spécifiques des cellules indifférenciées. Ces cellules épithéliales s’agrègent en
vésicules qui forment les néphrons, du glomérule jusqu’au tube distal. Ce sont les
cellules dérivées du BU qui formeront le tube collecteur et l’uretère qui connecte
le rein à la vessie. Il est évident que l’accès aux cellules progénitrices résidant dans la CM serait
d’une grande valeur en médecine régénératrice. Or les NPC persistent difficilement
en dehors de leurs niches développementales. Quelques jours après la naissance chez
la souris, et à 34 semaines de grossesse chez la femme, les NPC sont tous
différenciées de façon terminale [3]. La formation de nouveaux néphrons dans le rein adulte n’existe donc
pas, ce qui explique, au moins partiellement, pourquoi le rein, même s’il peut
présenter une capacité de régénération post-lésions [4], n’est pas capable de réagir de manière
adaptée aux nombreuses situations physiopathologiques qui peuvent l’affecter. L’isolement et la culture de NPC de rongeurs [5] à partir de tissu rénal fœtal a été rapporté. Mais ces
cellules ne peuvent subir que quelques passages en culture [5]. La mise au point de milieux de culture spécifiques, mimant
leur niche in situ, a néanmoins permis de cultiver des NPC murines
jusqu’à dix passages [6].
Mais c’est grâce à la prise en compte de l’environnement physique des cellules dans
le rein fœtal, et notamment des interactions cellule-cellule par l’utilisation de
techniques de culture en trois dimensions, que Li et al. ont montré
qu’il était possible d’augmenter l’expansion à long terme des NPC murines et
humaines, jusqu’à respectivement 110 et 50 passages [7]. |
Les premiers organoïdes rénaux ont été obtenus en s’appuyant sur une propriété
inhérente aux NPC : placées dans des conditions de culture où elles n’adhèrent pas,
et en trois dimensions, ces cellules s’agrègent, s’organisent entre elles de façon
spontanée, en formant un amas de néphrons et de tubes collecteurs [8]. Bien que les structures obtenues ne
soient pas organisées comme dans un rein, on peut parler d’organoïde puisqu’une
définition possible en est : « une structure en trois dimensions,
organ-like, auto-assemblée in vitro à partir
de progéniteurs spécifiques » [9]. Des travaux plus récents ont pu générer des structures présentant un
niveau d’organisation supérieur, avec des néphrons dans un cortex distinct,
connectés à des tubes collecteurs irradiant de la médullaire, et des anses de Henlé
plongeant du cortex dans la médullaire [10, 11]. Dans de telles structures, les néphrons peuvent présenter une activité
physiologique [12] même si
l’absence d’uretère empêche, bien entendu, l’évaluation de l’ensemble des fonctions
rénales. Afin de mimer des gradients spatiaux existant dans le développement du rein
in situ, la mise en contact d’un seul côté de l’organoïde avec
des billes libérant du BMP4 (bone morphogenetic protein 4) permet
la différenciation géo-spécifique des cellules qui en sont proches vers des cellules
ureter-like du tube collecteur, ce qui permet de casser la
symétrie de l’organoïde en élevant son réalisme anatomique [13]. |
Organoïdes rénaux dérivés de cellules souches pluripotentes Longtemps restreinte aux modèles animaux, l’étude du développement embryonnaire a été
rendu possible chez l’homme avec l’isolement puis la culture de cellules souches
embryonnaires. Ces cellules pluripotentes ont la capacité de se différencier dans
tous les types cellulaires d’un organisme adulte [14]. Moins de 10 ans après les travaux
pionniers, la possibilité d’induire des cellules somatiques à la pluripotence par
reprogrammation cellulaire a étendu le champ des possibilités : la technologie des
iPSC (induced pluripotent stem cells), en plus de ne pas nécessiter
l’utilisation d’embryons, permet de choisir le fond génétique des cellules
puisqu’elles peuvent être dérivées de cellules isolées d’un individu présentant une
pathologie génétique particulière [15]. Injectées à des souris immunodéficientes, les cellules souches pluripotentes (CSP)
forment des tératomes, des tumeurs composées de tissus issus des 3 feuillets
embryonnaires. Ces tératomes peuvent contenir des tubules rénaux et des glomérules,
montrant la capacité des CSP à se différencier en tissus rénal in
vivo [14]. Mais la
différenciation in vivo dans ces conditions n’a rien de spécifique.
In vitro, générer des cellules rénales à partir de CSP est
possible, mais la complexité réside dans le fait de diriger leur différenciation en
contrôlant les conditions de culture afin de les orienter vers un type cellulaire
spécifique, et cela pour tendre vers un protocole efficace et reproductible. Dans le cas du rein, la première étape du protocole consiste à différencier les CSP
en cellules de la ligne primitive. Ceci est réalisé par l’activation des voies de
signalisation WNT, activine/nodal et BMP4. Le rapport entre Activine et BMP4 permet
en effet d’induire soit la ligne primitive antérieure, soit la ligne primitive
postérieure. Une concentration forte de BMP4 et faible d’Activine permet ainsi de
diriger les cellules préférentiellement vers la ligne primitive postérieure, qui
inclut le mésoderme paraxial et intermédiaire, ce dernier étant celui d’intérêt dans
le cas du rein [16]. Une
alternative pour l’activation de la voie WNT consiste à inhiber la GSK3
(glycogen synthase kinase 3) en utilisant le CHIR99021 [16-19]. La structuration du mésoderme postérieur en mésoderme
paraxial, intermédiaire et latéral, peut être contrôlée par des combinaisons de
BMP4, d’activine/nodal, et de FGF9 (fibroblast growth factor-9)
[16], ou encore de BMP7 associé au
CHIR99021 [20], ou de FGF2
avec l’acide rétinoïque (RA) [21]. Différentes approches peuvent être utilisées pour spécifier le
mésoderme intermédiaire en cellules GATA3+ (spécifiques du MI antérieur
et des cellules du BU) incluant le FGF9 et le RA. Ainsi, différents types
cellulaires rénaux ont pu être générés à partir de CSP humaines, tels que des
progéniteurs rénaux [22],
des cellules du MI capables de former des cellules des tubules proximaux [21], et des cellules BU-like
capables de s’intégrer dans des embryons de reins de souris en contribuant à leur
développement [23]. Ces protocoles développés pour mimer la complexité du rein ont cependant montré leurs
limites. Les efforts déployés ont porté sur la génération d’organoïdes, en
appliquant notamment les technologies qui fonctionnaient déjà à partir de NPC,
c’est-à-dire des cultures en 3 dimensions. Les premiers organoïdes rénaux réalisés à
partir de cellules souches pluripotentes ont été rapportés dès 2014. Taguchi
et al. ont en effet décrit la différenciation de CSP en MM
capables de s’organiser en structures rénales comprenant des glomérules avec
podocytes et des tubules rénaux [24]. Par la suite, Morizane et al. ont obtenu des
organoïdes contenant des tubules avec segmentation qui s’auto-organisaient en
structures pseudo-glomérulaires avec la présence de tubules proximaux, d’anses de
Henlé et de tubules distaux [18]. Enfin, Freedman et al. ont obtenu des organoïdes
contenant des tubules rénaux, des podocytes et des cellules endothéliales [17]. Pour reproduire au plus près la structure d’un rein et l’ensemble de ses composants,
il a été nécessaire de générer à la fois des cellules dérivées du MM et des cellules
dérivées du BU. Ce sont ces dernières qui formeront, notamment, les cellules
stromales et vasculaires. Ces conditions ont été réunies dans les expériences
réalisées par le groupe de Little, qui a développé un protocole permettant d’induire
les 2 types de populations cellulaires à partir de cellules souches embryonnaires
humaines et ce, par une séquence utilisant le CHIR99021 et le FGF9 pour générer à la
fois les cellules du MM et du BU via la ligne primitive, et le MI,
en 7 jours de différenciation. À ce stade, les cellules sont détachées puis
cultivées sur un filtre de type Transwell afin de placer la
suspension cellulaire à une interface établie entre milieu de culture et air,
favorable pour l’auto-organisation des cellules [16]. Les structures obtenues contiennent notamment des cellules de type
tube collecteur, dérivées du BU, mais aussi des cellules
proximal-tubule-like dérivés du MM, montrant qu’une interaction
entre les types cellulaires, similaire à ce qu’il advient lors du développement du
rein in utero, s’est effectivement réalisée (Figure 1).
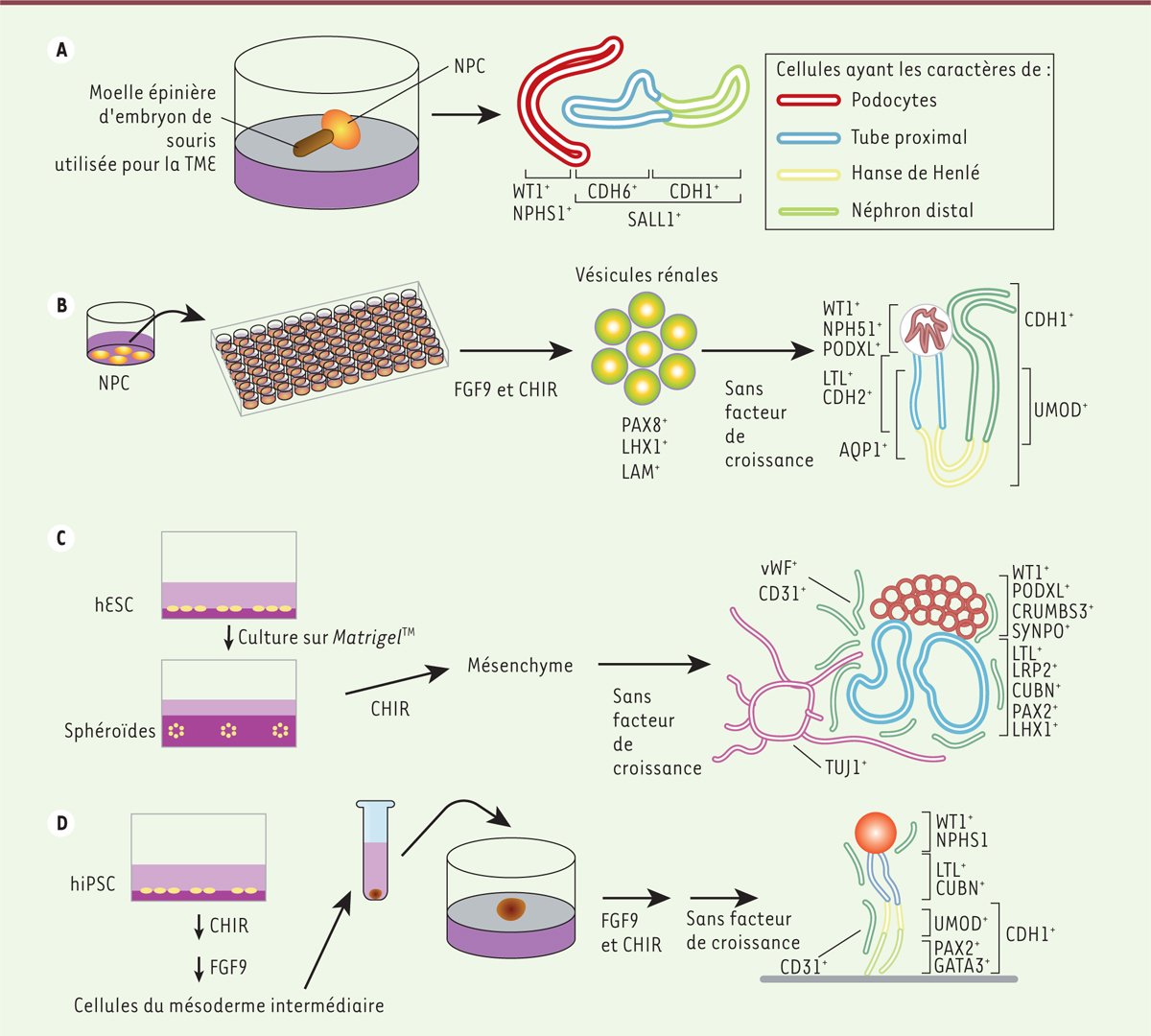
 | Figure 1.Les différentes méthodes de génération d’organoïdes de
rein. En A,
B, C
et D sont montrées les différentes
techniques permettant de générer des organoïdes de reins à partir de
cellules IPS humaines. NPC : nephron progenitor cells ;
WT1 : Wilms tumor 1 ; NPHS1 : nephrosis
1 ; CDH : cadherin ; SALL1 :
spalt-like transcription factor 1 ; PAX8 :
paired box 8 ; LHX1 : LIM homeobox
1 ; LAM : laminine ; PODXL :
podocalyxin-like ; LTL : lotus
tetragonolobus lectin ; AQP1 : aquaporin 1
; UMOD : uromodulin ; vWF: facteur de von Willebrand ;
TUJ1 : neuron-specific class 3 beta-tubulin ; SYNPO :
synaptopodin ; LRP2 : LDL receptor-related
protein 2 ; CUBN : cubiline ; PAX2 : paired box
2 ; GATA3 : GATA binding protein 3. FGF :
fibroblast growth factor ; CHIR : CHIR99021 ; TME :
transition mésenchymo-épithéliale (figure inspirée de la figure 3 de
[ 46]). |
Depuis, le protocole a été affiné afin de produire des proportions équivalentes de
cellules du BU et du MM, conduisant à des organoïdes remarquablement organisés. On
observe ainsi dans ces organoïdes la présence de structures
nephron-like, de glomérules, de tubules proximaux, d’anses de
Henlé et de tubes collecteurs, ressemblant fortement à l’organisation du rein
humain, en présence de cellules stromales et d’un réseau vasculaire constitué de
capillaires. L’analyse transcriptomique de ces structures montre un profil
d’expression génique similaire à celui de reins embryonnaires humains [19]. En terme de fonctionnalité, les organoïdes
rénaux ont la capacité d’endocytose sélective de dextran
cargoes2, et ils répondent à des
agents néphrotoxiques [17-19]. |
Les organoïdes rénaux : nouvel outil de modélisation et de compréhension de
maladies Tout comme celle des iPSC en 2006, une autre découverte majeure a littéralement
révolutionné le monde de la biologie cellulaire et moléculaire en 2012 : la mise en
œuvre de techniques d’édition de génome, un système modulable permettant de cliver
une séquence d’ADN à un endroit ciblé grâce à une endonucléase bactérienne «
programmable » par un ARN spécifiquement choisi (ARN guide). Cette technologie de
précision, nommée CRISPR (clustered regularly interspaced short palindromic
repeat), a depuis montré son efficacité dans des cellules humaines
[25] et a rapidement
été appliquée aux iPSC, permettant notamment la modélisation de maladies génétiques
en modifiant in vitro les gènes responsables sans qu’il soit
nécessaire de recourir à l’utilisation d’iPSC dérivées de cellules de patients. Le premier modèle génétique d’organoïdes rénaux généré par CRISPR a modélisé la
polykystose rénale (PKR). Il s’agit de la plus fréquente des maladies génétiques
rénales. Elle est caractérisée par le développement de kystes et de lésions
fibrotiques qui détériorent la fonction rénale. Dans sa forme dominante, la PKR est
induite par des mutations des gènes PKD (polykystic kidney disease)
1 et/ou 2, qui codent respectivement les fibrocystines
1 et 2. À partir d’iPSC humaines, des pertes de fonction ont pu être induites par la
méthode CRISPR, soit sur le gène PKD1, soit sur le gène
PKD2. Ces mutations n’ont pas affecté la capacité des iPSC à se
différencier en organoïdes rénaux. Néanmoins, quelques jours après la fin de la
différenciation des cellules, une proportion faible, mais détectable, d’organoïdes
ont développé des kystes, un phénomène qui n’a pas été observé avec des lignées
isogéniques indemnes de mutation. Cette étude a ainsi montré que la formation de
kystes était un phénomène inhérent aux cellules mutées et qu’elle peut être
reproduite in vitro [17]. Par vidéo-microscopie, il a été observé, en parallèle, que les kystes se formaient à
partir de structures tubulaires entières qui se détachent partiellement du support
de culture. En utilisant des plaques de culture à faible adhérence, un taux de
formation de kystes très élevé a ainsi pu être observé avec les organoïdes mutés
dans les gènes PKD, significativement supérieur à ceux obtenus dans
les conditions de culture précédentes, ce taux restant faible pour les lignées iPSC
non mutées. Cette observation souligne la tendance forte des cellules épithéliales à
former des kystes dans des conditions de non adhérence en trois dimensions, même en
l’absence de mutation. Elle montre également que la mutation des gènes
PKD a un rôle important dans la promotion de la kystogenèse
dans les organoïdes rénaux. Les kystes ainsi générés présentent des marqueurs
proximaux, distaux et de prolifération ; des caractéristiques retrouvées dans les
kystes isolés de biopsies de patients atteints de polykystose rénale. Ce travail
souligne le rôle critique de l’environnement des cellules et des forces d’adhérence
dans la kystogenèse [26].
Cultiver des cellules rénales à partir de biopsie de patients atteint de polykystose
rénale autosomique dominante est possible [27], mais il existe une hétérogénéité selon les sources
cellulaires et le fond épigénétique des patients. Le modèle des organoïdes rénaux
dérivés d’iPSC offre donc un avantage non négligeable : celui de pouvoir comparer
les cellules générées à des lignées iPSC contrôles isogéniques sans avoir à
considérer d’éventuelles variations de profils épigénétiques ou d’efficacité de
différenciation entre les patients. Très récemment, Little et al. ont utilisé les organoïdes rénaux
comme plate-forme de validation fonctionnelle de nouveaux variants génétiques
potentiellement impliqués dans l’apparition de maladies rénales. Par séquençage
haut-débit, ces auteurs ont mis en évidence chez un individu atteint de
néphronophtise3 une mutation possiblement
causale sur le gène IFT140 (intraflagellar transport
140). Ce gène code une sous-unité du complexe A de transport
intraflagellaire. Les organoïdes porteurs de ce variant présentent des tubules
raccourcis et des cils morphologiquement anormaux. Des iPSC ont été générées par
CRISPR pour corriger cette mutation, ce qui a permis d’annuler le phénotype anormal.
Des analyses transcriptomiques des cellules épithéliales isolées à partir des
organoïdes ainsi générés montrent une sous-régulation de gènes associés à la
polarité apico-basale et aux jonctions cellulaires. Ce défaut de polarisation a été
confirmé dans des tests de formation de kystes en culture sur
MatrigelTM [28]. Au-delà de la modélisation de maladies, les organoïdes rénaux peuvent aussi être
utilisés pour identifier de nouvelles cibles thérapeutiques. La podocalyxine
(PODXL1) est fortement exprimée dans les podocytes. Le gène qui la code est un gène
candidat dans le traitement de la glomérulosclérose segmentaire et focale (FSGS),
une maladie complexe, rare, hétérogène et peu comprise, qui se caractérise par des
lésions histologiques variées aboutissant à un défaut de la fonction de la barrière
de filtration glomérulaire. En culture, les podocytes primaires des patients
souffrant de FSGS ne prolifèrent pas et ils se dédifférencient rapidement. Cette
dédifférenciation est associée à une perte des pieds des podocytes et à une
extinction de l’expression de la néphrine (NPHS1), une protéine importante de la
barrière de filtration glomérulaire. Il est possible de différencier spécifiquement
des iPSC humaines en populations homogènes de podocytes qui, une fois transplantées
chez la souris, maturent au niveau du glomérule et sont vascularisés [29]. Les organoïdes rénaux
peuvent également contenir des podocytes, mais leur état de maturation n’était pas
connu jusqu’à une étude récente qui a montré qu’ils étaient semblables aux podocytes
présents dans les reins in situ en termes d’expression génique et
d’ultrastructure, avec la formation progressive de membranes basales riches en
jonctions et de membranes apicales riches en microvilli. En
utilisant des iPSC délétées du gène PODXL1 codant la podocalyxine,
Kim et al. ont généré des organoïdes dont les podocytes
présentaient un défaut dans l’assemblage des microvilli avec des
espaces entre les cellules conduisant à des jonctions intercellulaires poreuses. Ces
défauts avaient déjà été retrouvés dans les modèles murins de cette maladie,
montrant que la podocalyxine est conservée dans les processus de maturation des
podocytes et qu’elle est notamment impliquée dans la pathologie et le développement
de la FSGS [30]. La
technologie CRISPR a également été utilisée pour développer un système dans lequel
la différenciation rénale, la maturation des glomérules et le phénotype des
podocytes peuvent être évalués dans des organoïdes par microscopie de fluorescence
grâce à l’intégration de gènes rapporteurs et à l’extinction de l’expression du gène
codant la NPHS1 [31]. Les organoïdes rénaux représentent également un modèle intéressant pour comprendre
les mécanismes impliqués dans le développement de lésions rénales liées à des stress
intenses. Nous avons en effet observé que de nombreuses voies de signalisation et de
gènes activés lors du développement embryonnaire du rein, et donc dans la génération
d’organoïdes rénaux, sont réactivés dans un rein mature ayant subi une lésion
ischémique majeure [32].
Une séquence d’ischémie froide, dans un rein mature de porc, induit ainsi
l’activation du gène codant la LEO1 (RNA polymerase II-complex
component), un composant du PAF1C (polymerase-associated factor
1 complex) qui est requis pour la transcription des gènes
WNT, HOX et NOTCH, et est
impliqué dans le développement et le maintien de la pluripotence des cellules
souches embryonnaires [33].
Dans ce modèle porcin, les lésions d’ischémie induisent la sous-expression du gène
RHOU (ras-homolog family member U) qui est
régulé par un gène induit par WNT. RHOU, en lien avec Wrch (Wnt-1 responsive
CDC42 homolog), est impliqué précocement dans le développement des
organismes multicellulaires. Les reins porcins ayant subi une lésion ischémique
présentent également une sous-expression de CDC42 homolog
(cell division control protein-42 homolog) qui joue un rôle
essentiel dans la survie, la croissance et le développement [32]. |
Applications « haut-débit » des organoïdes rénaux Les reins sont une cible importante de la toxicité de médicaments ou d’autres
métabolites produits par le foie. Les tubules proximaux possèdent une grande variété
de transporteurs impliqués dans des interactions médicamenteuses. Les membres de la
famille SLC (solute carrier family) ou les transporteurs ABC
(ATP-binding cassette), comme MRP2/4 (multi-drug
resistance protein 2 and 4) et BRCP (breast cancer resistance
protein), jouent un rôle important dans ce phénomène de toxicité. Le
nombre de médicaments dont l’effet échoue à cause d’une mauvaise prédiction de leur
rôle néphrotoxique est estimé à 7 % [34], ce qui révèle les limites des modèles existants utilisés
pour évaluer leurs effets néfastes. De même, 30 à 50 % des insuffisances rénales
sévères ont pour origine une néphrotoxicité induite par un médicament [35]. Il est donc primordial
d’accélérer le développement de modèles alternatifs de prédiction permettant
d’évaluer la toxicologie médicamenteuse rénale. Dans des milieux de culture très spécifiques, les cellules tubulaires rénales
primaires maintiennent temporairement une architecture, une fonction et une polarité
cellulaire [36]. Leur
prolifération reste extrêmement limitée lorsqu’elles sont cultivées en deux
dimensions : après quelques doublements de population, les cellules s’étirent
horizontalement et changent rapidement de phénotype (dédifférenciation), ce qui les
éloigne de la réalité physiologique. Des lignées obtenues par immortalisation de
cellules tubulaires sont souvent utilisées, comme les cellules HK-2 et RPTEC/hTERT,
notamment dans des études de néphrotoxicité [37]. Il existe également de nombreuses lignées issues de
tumeurs primaires ou métastatiques (comme les lignées A-498 et Caki-1). Ces cellules
sont un outil majeur pour la compréhension des mécanismes cancéreux ou pour
l’identification de molécules anticancéreuses. Cependant, en dehors de ces
applications, leur pouvoir prédictif en toxicologie rénale générale reste limité de
par leur origine, éloignée de la réalité physiologique. Ces types cellulaires ont
déjà été couplés à des outils haut-débit pour réaliser des criblages
toxicologiques/pharmacologiques [38]. Très récemment, ces techniques de haut-débit ont été appliquées aux organoïdes rénaux
issus de CSP. Czerniecki et al. ont en effet développé une
plateforme automatisée de high-troughput-screening (HTS) pour
améliorer la différenciation et le phénotypage d’organoïdes rénaux humains. Ils ont
réalisé l’ensemble du protocole de différenciation des cellules (en 21 jours) de
façon automatisée sur des robots de culture cellulaire. Les analyses réalisées dans
ces conditions ont révélé une dose-dépendance et un effet seuil des composés
utilisés lors de la différenciation. Des compartiments différenciés qui n’avaient
pas été identifiés auparavant, avec la présence de cellules interstitielles et
pariétales, ont également été mis en évidence. Un criblage chimique, pour évaluer la
néphrotoxicité sur ces organoïdes rénaux, a été réalisé. Il a notamment permis de
révéler un rôle inattendu de la myosine dans la polykystose rénale, en utilisant des
organoïdes rénaux différenciés à partir d’iPSC modifiées par édition de génome
[39]. Une des barrières
à l’utilisation de ces modèles reste la génération d’organoïdes rénaux en nombre
suffisant pour ces applications. En ce sens, Przepiorski et al. ont
développé un protocole efficace permettant de générer des organoïdes rénaux en masse
à coût limité, grâce à un bioréacteur [40]. Une « puce glomérulaire » contenant seulement des podocytes matures dérivés d’iPSC a
été développée. Elle combine des techniques de microfluidique de type
organ-on-chip à un protocole efficace de différenciation de 35
jours. Cette puce in vitro imite structurellement et
fonctionnellement la membrane glomérulaire [41]. |
Les niveaux de différenciation cellulaire et d’architecture tissulaire observés au
sein des organoïdes rénaux sont remarquables. Utiliser de telles structures pour les
transplanter et ainsi suppléer la fonction d’un rein défaillant apparaît ainsi être
une option plus qu’intéressante. Malgré des similarités non discutables entre ces structures organoïdes et un rein,
les niveaux de fonctionnalité de ces deux entités ne sont pas similaires. La
fonction des reins repose sur la filtration du sang et l’élimination de ses déchets
dans l’urine, il est donc impératif que les organoïdes rénaux soient connectées au
système vasculaire et à la vessie du receveur. Pour ce qui est de la
vascularisation, Dekel et al. ont rapporté, en 2003, la
transplantation d’un rein fœtal humain chez des souris immunodéficientes. Ce rein,
qui présentait des glomérules et tubules matures, a été vascularisé après
transplantation par recrutement de cellules endothéliales. Ce phénomène a également
été observé en transplantant des reins fœtaux précoces, mais pas lorsque des reins
fœtaux plus matures ont été utilisés. La production d’urine, qui s’est accumulée
dans le pelvis faute de connexion du rein à la vessie murine, a aussi été observée
[42]. L’analyse transcriptomique des organoïdes rénaux générés par l’équipe de Little a
montré que ces derniers présentaient un profil d’expression similaire à un rein
fœtal [19]. C’est également le cas pour des
transplantations d’organoïdes rénaux dérivés de CSP humaines. Ces organoïdes ont été
obtenus dans des conditions définies et en l’absence de VEGF (vascular
endothelial growth factor) exogène. Quelques jours, voire quelques
semaines, après transplantation sous la capsule rénale de souris immunodéficientes,
la formation d’un réseau vascularisé dérivant du receveur, envahissant les
structures glomérulaires de l’organoïde, la maturation progressive de la barrière de
filtration glomérulaire, avec la déposition d’une membrane basale glomérulaire, le
développement d’un endothélium glomérulaire fenêtré, avec une migration apico-basale
des jonction serrées des podocytes, et une maturation de l’épithélium tubulaire,
avec l’apparition d’une bordure en brosse, ont été observés [43]. Cette maturation progressive ne se produit
pas dans des organoïdes rénaux générés, même s’ils sont maintenus en culuture
in vitro, montrant que la transplantation et la mise en contact
de l’organoïde avec un environnement physique, chimique et biologique adéquat
restent nécessaires et permettent la progressive maturation/morphogenèse des
organoïdes rénaux humains. Reste à considérer la faisabilité d’établir des connexions entre organoïde et système
urinaire. L’utilisation d’iPSC en clinique reste également limitée par l’existence
de barrières non négligeables. Il sera en effet nécessaire de s’assurer de l’absence
de cellules souches pluripotentes résiduelles et de l’incapacité de ces organoïdes à
se dédifférencier en cellules potentiellement tumorigènes. Les iPSC, par définition,
et de par leur mode d’obtention et de culture, sont des cellules prônes à
l’accumulation sélective ou non de mutations génétiques : mutations ponctuelles,
délétions, duplications, anomalies chromosomiques. Les protocoles de reprogrammation
tendent vers des stratégies de plus en plus protégées, notamment par l’utilisation
de stratégies non intégratives qui semblent avoir un impact moindre sur l’intégrité
génomique des cellules obtenues [44, 45]. Des
contrôles qualités drastiques seront néanmoins nécessaires afin de disposer de
cellules iPSC prêtes à être différenciées et transplantées chez l’homme [46]. La variabilité de l’efficacités des
protocoles de différenciation entre patients et clones d’iPSC sera aussi à
considérer, notamment lorsqu’un processus de production « à grande échelle » sera
envisagé. |
Reproduire un rein in vitro devient une éventualité réaliste : ces
versions miniatures d’organes, cultivées en laboratoire, peuvent être utilisées pour
comprendre des mécanismes biologiques, pour accompagner le développement de
médicaments, la recherche de nouvelles thérapies ou encore dans le cadre de la
médecine personnalisée. Cette innovation révolutionne la recherche en proposant une
alternative rapide (différenciation d’iPSC en moins d’un mois, représentant un gain
de temps par rapport à l’embryogenèse puis à la maturation des organes chez les
animaux) et moins coûteuse, compatible avec des applications haut-débit. Le
développement de cette technologie prend également tout son sens là où il convient
de réduire à son minimum l’utilisation des modèles animaux à des fins
expérimentales. Reste encore à prendre en compte les interactions inter-organes.
Dans ce domaine, les progrès sont fulgurants et des technologies fondées sur la
microfluidique de type body-on-chip (« organe sur puce ») sont
émergentes, laissant entrevoir la possibilité de connecter, grâce à des fluides
physiologiques, les organoïdes rénaux à d’autres structures organoïdes (foie,
vessie) et de reproduire, in vitro, la complexité du vivant à
l’échelle cellulaire, inter-cellulaire, inter-tissulaire et inter-organes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Hardin-Pouzet
H,
Morosan
S.
Organismes-modèles et réglementation de la recherche
animale . Med Sci (Paris) . 2019;
; 35 : :53.–56. 2. Combes
AN,
Davies
JA,
Little
MH. Cell–cell
interactions driving kidney morphogenesis . Curr Top
Dev Biol . 2015; ; 112 :
:467.–508. 3. Pleniceanu
O,
Harari-Steinberg
O,
Dekel
B. Concise review:
Kidney stem/progenitor cells: differentiate, sort out, or
reprogram? . Stem Cells Dayt Ohio .
2010; ; 28 :
:1649.–1660. 4. Humphreys
BD,
Valerius
MT,
Kobayashi
A, et al.
Intrinsic epithelial cells repair the kidney after
injury . Cell Stem Cell . 2008; ;
2 : :284.–291. 5. Brown
AC,
Blank
U,
Adams
DC, et al.
Isolation and culture of cells from the nephrogenic zone of the
embryonic mouse kidney . J Vis Exp.
2011;; 22 : pii:
2555.. 6. Brown
AC,
Muthukrishnan
SD,
Oxburgh
L. A synthetic niche
for nephron progenitor cells . Dev Cell .
2015; ; 34 :
:229.–241. 7. Li
Z,
Araoka
T,
Wu
J, et al.
3D Culture supports long-term expansion of mouse and human
nephrogenic progenitors . Cell Stem Cell .
2016; ; 19 :
:516.–529. 8. Unbekandt
M,
Davies
JA. Dissociation of
embryonic kidneys followed by reaggregation allows the formation of renal
tissues . Kidney Int . 2010; ;
77 :
:407.–416. 9. Lancaster
MA,
Knoblich
JA. Organogenesis in
a dish: modeling development and disease using organoid
technologies . Science . 2014; ;
345 : :1247125.. 10. Ganeva
V,
Unbekandt
M,
Davies
JA. An improved
kidney dissociation and reaggregation culture system results in nephrons
arranged organotypically around a single collecting duct
system . Organogenesis . 2011; ;
7 : :83.–87. 11. Chang
C-H,
Davies
JA. An improved
method of renal tissue engineering, by combining renal dissociation and
reaggregation with a low-volume culture technique, results in development of
engineered kidneys complete with loops of Henle .
Nephron Exp Nephrol . 2012; ;
121 :
:e79.–e85. 12. Lawrence
ML,
Chang
CH,
Davies
JA. Transport of
organic anions and cations in murine embryonic kidney development and in
serially-reaggregated engineered kidneys . Sci
Rep . 2015; ; 5 :
:9092.. 13. Mills
CG,
Lawrence
ML,
Munro
DAD, et al.
Asymmetric BMP4 signalling improves the realism of kidney
organoids . Sci Rep . 2017; ;
7 : :14824.. 14. Thomson
JA,
Itskovitz-Eldor
J,
Shapiro
SS, et al.
Embryonic stem cell lines derived from human
blastocysts . Science . 1998; ;
282 :
:1145.–1147. 15. Takahashi
K,
Tanabe
K,
Ohnuki
M, et al.
Induction of pluripotent stem cells from adult human fibroblasts
by defined factors . Cell . 2007;
; 131 : :861.–872. 16. Takasato
M,
Er
PX,
Becroft
M, et al.
Directing human embryonic stem cell differentiation towards a
renal lineage generates a self-organizing kidney .
Nat Cell Biol . 2014; ; 16 :
:118.–126. 17. Freedman
BS,
Brooks
CR,
Lam
AQ, et al.
Modelling kidney disease with CRISPR-mutant kidney organoids
derived from human pluripotent epiblast spheroids .
Nat Commun . 2015; ; 6 :
:8715.. 18. Morizane
R,
Lam
AQ,
Freedman
BS, et al.
Nephron organoids derived from human pluripotent stem cells model
kidney development and injury . Nat
Biotechnol . 2015; ; 33 :
:1193.–1200. 19. Takasato
M,
Er
PX,
Chiu
HS, et al.
Kidney organoids from human iPS cells contain multiple lineages
and model human nephrogenesis . Nature .
2015; ; 526 :
:564.–568. 20. Mae
S-I,
Shono
A,
Shiota
F, et al.
Monitoring and robust induction of nephrogenic intermediate
mesoderm from human pluripotent stem cells . Nat
Commun . 2013; ; 4 :
:1367.. 21. Lam
AQ,
Freedman
BS,
Morizane
R, et al.
Rapid and efficient differentiation of human pluripotent stem
cells into intermediate mesoderm that forms tubules expressing kidney
proximal tubular markers . J Am Soc Nephrol .
2014; ; 25 :
:1211.–1225. 22. Toyohara
T,
Mae
S-I,
Sueta
S-I, et al.
Cell therapy using human induced pluripotent stem cell-derived
renal progenitors ameliorates acute kidney injury in mice .
Stem Cells Transl Med . 2015; ;
4 : :980.–992. 23. Xia
Y,
Nivet
E,
Sancho-Martinez
I, et al.
Directed differentiation of human pluripotent cells to ureteric
bud kidney progenitor-like cells . Nat Cell
Biol . 2013; ; 15 :
:1507.–1515. 24. Taguchi
A,
Kaku
Y,
Ohmori
T, et al.
Redefining the in vivo origin of metanephric nephron progenitors
enables generation of complex kidney structures from pluripotent stem
cells . Cell Stem Cell . 2014; ;
14 : :53.–67. 25. Mali
P,
Yang
L,
Esvelt
KM, et al.
RNA-guided human genome engineering via Cas9 .
Science . 2013; ; 339 :
:823.–826. 26. Cruz
NM,
Song
X,
Czerniecki
SM, et al.
Organoid cystogenesis reveals a critical role of microenvironment
in human polycystic kidney disease . Nat
Mater . 2017; ; 16 :
:1112.–1119. 27. Freedman
BS,
Lam
AQ,
Sundsbak
JL, et al.
Reduced ciliary polycystin-2 in induced pluripotent stem cells
from polycystic kidney disease patients with PKD1 mutations .
J Am Soc Nephrol . 2013; ; 24 :
:1571.–1586. 28. Forbes
TA,
Howden
SE,
Lawlor
K, et al.
Patient-iPSC-derived kidney organoids show functional validation
of a ciliopathic renal phenotype and reveal underlying pathogenetic
mechanisms . Am J Hum Genet .
2018; ; 102 :
:816.–831. 29. Sharmin
S,
Taguchi
A,
Kaku
Y, et al.
Human induced pluripotent stem cell-derived podocytes mature into
vascularized glomeruli upon experimental transplantation .
J Am Soc Nephrol . 2016; ; 27 :
:1778.–1791. 30. Kim
YK,
Refaeli
I,
Brooks
CR, et al.
Gene-edited human kidney organoids reveal mechanisms of disease
in podocyte development . Stem Cells Dayt
Ohio . 2017; ; 35 :
:2366.–2378. 31. Boreström
C,
Jonebring
A,
Guo
J, et al.
A CRISP(e)R view on kidney organoids allows generation of an
induced pluripotent stem cell–derived kidney model for drug
discovery . Kidney Int . 2018; ;
94 :
:1099.–1110. 32. Giraud
S,
Steichen
C,
Allain
G, et al.
Dynamic transcriptomic analysis of ischemic injury in a porcine
pre-clinical model mimicking donors deceased after circulatory
death . Sci Rep . 2018; ;
8 : :5986.. 33. Rozenblatt-Rosen
O,
Hughes
CM,
Nannepaga
SJ, et al.
The parafibromin tumor suppressor protein is part of a human Paf1
complex . Mol Cell Biol . 2005; ;
25 :
:612.–620. 34. Fuchs
TC,
Hewitt
P. Biomarkers for
drug-induced renal damage and nephrotoxicity-an overview for applied
toxicology . AAPS J . 2011; ;
13 :
:615.–631. 35. Pannu
N,
Nadim
MK. An overview of
drug-induced acute kidney injury . Crit Care
Med . 2008; ; 36 :
:S216.–S223. 36. Detrisac
CJ,
Sens
MA,
Garvin
AJ, et al.
Tissue culture of human kidney epithelial cells of proximal
tubule origin . Kidney Int .
1984; ; 25 :
:383.–390. 37. Jenkinson
SE,
Chung
GW, van
Loon
E, et al.
The limitations of renal epithelial cell line HK-2 as a model of
drug transporter expression and function in the proximal
tubule . Pflugers Arch . 2012; ;
464 :
:601.–611. 38. Ramm
S,
Adler
M,
Vaidya
VS. A
high-throughput screening assay to identify kidney toxic
compounds . Curr Protoc Toxicol.
2016;; 69 :
:10.1.–9.10.26. 39. Czerniecki
SM,
Cruz
NM,
Harder
JL, et al.
High-throughput screening enhances kidney organoid
differentiation from human pluripotent stem cells and enables automated
multidimensional phenotyping . Cell Stem
Cell . 2018; ; 22 :
:929.–940. 40. Przepiorski
A,
Sander
V,
Tran
T, et al.
A simple bioreactor-based method to generate kidney organoids
from pluripotent stem cells . Stem Cell Rep .
2018; ; 11 :
:470.–484. 41. Musah
S,
Dimitrakakis
N,
Camacho
DM, et al.
Directed differentiation of human induced pluripotent stem cells
into mature kidney podocytes and establishment of a Glomerulus
Chip . Nat Protoc . 2018; ;
13 :
:1662.–1685. 42. Dekel
B,
Burakova
T,
Arditti
FD, et al.
Human and porcine early kidney precursors as a new source for
transplantation . Nat Med . 2003;
; 9 : :53.–60. 43. van den
Berg
CW,
Ritsma
L,
Avramut
MC, et al.
Renal subcapsular transplantation of PSC-derived kidney organoids
induces neo-vasculogenesis and significant glomerular and tubular maturation
in vivo . Stem Cell Rep . 2018; ;
10 :
:751.–765. 44. Schlaeger
TM,
Daheron
L,
Brickler
TR, et al.
A comparison of non-integrating reprogramming
methods . Nat Biotechnol . 2015;
; 33 : :58.–63. 45. Steichen
C,
Luce
E,
Maluenda
J, et al.
Messenger RNA-versus retrovirus-based induced pluripotent stem
cell reprogramming strategies: analysis of genomic
integrity . Stem Cells Transl Med .
2014; ; 3 :
:686.–691. 46. Assou
S,
Bouckenheimer
J, De
Vos
J. Concise review:
assessing the genome integrity of human induced pluripotent stem cells: What
quality control metrics? . Stem Cells Dayt
Ohio . 2018; ; 36 :
:814.–821. 47. Morizane
R,
Bonventre
JV. Kidney
organoids: a translational journey . Trends Mol
Med . 2017; ; 23 :
:246.–263. |