| |
| Med Sci (Paris). 35(6-7): 497–500. doi: 10.1051/medsci/2019105.IL-1RAP, un candidat pour l’immunothérapie par
CAR T-cells Mathieu Neto Da Rocha,1 Rim Trad,1 Walid Warda,1 Rafik Haderbache,1 Lucie Bouquet,1 Clémentine Nicod,1 Marina Deschamps,1 and Christophe Ferrand1* 1Établissement français du sang de Bourgogne Franche-Comté,
Inserm UMR1098 - Université de Bourgogne Franche-Comté,
8, rue du Dr Jean-François-Xavier
Girod, BP1937, 25020Besançon,
France MeSH keywords: Animaux, Anticorps monoclonaux, Antigènes néoplasiques, Marqueurs biologiques tumoraux, Caspase-9, Protéines de fusion bcr-abl, Régulation de l'expression des gènes tumoraux, Gènes-suicide transgéniques, Tumeurs hématologiques, Cellules souches hématopoïétiques, Humains, Immunothérapie adoptive, Protéine accessoire du récepteur à l'interleukine-1, Cellules tueuses naturelles, Leucémie myéloïde chronique BCR-ABL positive, Leucémie aigüe myéloïde, Lymphocytes TIL, Souris, Souris de lignée BALB C, Tumeurs, Leucémie-lymphome lymphoblastique à précurseurs B et T, Récepteurs chimériques pour l'antigène, génétique, usage thérapeutique, immunologie, métabolisme, thérapie, cytologie, effets indésirables, méthodes, anatomopathologie, transplantation |
Immunothérapie cellulaire et CAR T-cellsLes lymphocytes T (LT) circulants ou infiltrant la tumeur et les cellules NK
(natural killer) sont les acteurs cellulaires majeurs de
l’immuno-surveillance des cancers. En cas de progression tumorale, différentes
immunothérapies modulatrices peuvent être proposées, comme l’utilisation de
cytokines, l’inhibition des points de contrôle immunitaire, l’injection de cellules
immunocompétentes autologues ou allogéniques (c’est-à-dire une greffe de cellules
souches hématopoïétiques [CSH]) modifiées ou non. Une possibilité est de renforcer
des LT par génie génétique, en leur faisant exprimer un récepteur chimérique
(chimeric antigen receptor, CAR) spécifique d’antigènes
exprimés par les cellules tumorales, afin de les rediriger et de les activer contre
la tumeur. Un CAR est composé d’un domaine de reconnaissance extracellulaire
(single chain fragment variable, scFv) dérivé d’un anticorps
monoclonal (monoclonal antibody, mAb) dirigé contre l’antigène
tumoral ciblé, d’une région charnière, d’un domaine transmembranaire, et du domaine
d’activation T intracellulaire de CD3ζ associé à plusieurs domaines de
co-stimulation (CD28, 4.1BB, ou OX40) destinés à augmenter l’activation des LT
[12]
(→).
(→) Voir la Chronique génomique de B. Jordan, m/s n° 11,
novembre 2017, page 1003
L’utilisation thérapeutique de ces CAR T-cells a constitué une
véritable révolution dans le traitement des hémopathies malignes lymphoïdes B
réfractaires au traitement ou en rechute, ou encore en situation d’impasse
thérapeutique, en ciblant l’antigène CD191 dans
les leucémies aiguës lymphoblastiques (LAL) [1], les lymphomes, ou le myélome multiple. Les taux élevés de
rémission observés ont d’ailleurs conduit à l’autorisation de mise sur le marché de
deux médicaments dans le cadre des thérapies innovantes (Kymriah®, des laboratoires
Novartis, et Yescarta®, des laboratoires Gilead) [13] (→).
(→) Voir la Synthèse de V. Catros, m/s n° 4, avril 2019, page
316
L’utilisation de CAR T-cells ciblant divers antigènes (CD123, FLT3
[Fms-like tyrosine kinase 3], CD33, CLL-1 [C-type
lectin-like molecule-1], etc.) est actuellement proposée dans des
essais pré-cliniques pour le traitement des leucémies aiguës myéloblastiques (LAM),
mais la cible antigénique idéale n’a pas encore été identifiée. |
La protéine IL-1RAP, un biomarqueur potentiel de certaines leucémies et tumeurs
solides La protéine membranaire accessoire du récepteur de l’interleukine 1 (IL-1
receptor accessory protein, ou IL-1RAP) s’associe aux récepteurs de
l’IL-1α, l’IL-1β, et de l’IL-33, et est indispensable à leur signalisation,
conduisant à un état pro-inflammatoire. Elle appartient à la famille de l’IL-1, qui
est sécrétée très tôt au cours de la réponse immunitaire par les cellules
dendritiques, les monocytes, et les macrophages. Il existe cinq variants d’épissage
de l’ARNm de cette protéine, qui codent trois isoformes membranaires et deux
isoformes solubles. Il a aussi été montré que l’IL-1RAP s’associe à deux récepteurs
tyrosine kinase, FLT3 et c-KIT (stem cell factor receptor), et
favorise ainsi la prolifération des cellules tumorales dans la LAM [2]. Le profil d’expression d’un groupe de gènes, dont le gène IL-1RAP,
permet de discriminer les cellules souches hématopoïétiques normales de celles de
leucémie myéloïde chronique (LMC). Dans ces cellules, la transduction de la séquence
oncogénique p210 BCR-ABL
2 est à l’origine d’une augmentation de
l’expression membranaire d’IL-1RAP, et les cellules LMC persistant après traitement
par des inhibiteurs de tyrosine kinase (ITK) expriment toujours IL-1RAP à leur
surface, bien que plus faiblement [3]. L’expression d’IL-1RAP a été aussi identifiée comme un biomarqueur
des différentes phases cliniques de la LMC [4] et nous avons montré, dans un groupe de patients atteints de
LMC traités par ITK (ClinicalTrials.gov: NCT02842320), que la diminution du nombre
de cellules exprimant IL-1RAP était corrélée au ratio BCR-ABL
(IS)3 [5]. Dans les LAL à chromosome Philadelphie (LAL
Ph+), les gènes de fusion produisent des transcrits atypiques qui codent les
protéines p190, p210 et p230. La présence d’IL-1RAP dans les cellules de LAL-p190
est controversée, alors qu’elle a été bien établie dans les cellules de LAL-p210
[6]. IL-1RAP est
également exprimé dans les LAM à caryotype normal, dans les LAM-7/7q-
(monosomie 7 ou délétions de 7q), et dans les syndromes myélodysplasiques à haut
risque, cette expression étant associée à une moindre survie globale des patients
[7]. Dans les tumeurs
solides, l’expression d’IL-1RAP est augmentée dans les cancers du sein triple
négatifs (RE- [récepteur de l’œstrogène] / RP- [récepteur de la progestérone]/HER2-
[human epidermal growth factor receptor 2]), et est corrélée à
une survie sans récidive plus courte [8]. |
IL-1RAP et LMC, support de développement d’une immunothérapie par CAR
T-cellsUn anticorps monoclonal spécifique d’IL-1RAP inhibe l’interaction de l’IL-1 avec son
récepteur (donc la signalisation conduisant à la sécrétion de cytokines
pro-inflammatoires), ainsi que l’expansion des cellules primaires de LMC. Cet
anticorps permet aussi de recruter des effecteurs cellulaires, tels que les cellules
NK, qui contribuent à l’élimination des cellules leucémiques de LMC ou de LAM [9] par cytotoxicité à médiation
cellulaire dépendante des anticorps (ADCC, antibody-dependent cell-mediated
cytotoxicity) [10]. L’ensemble de ces travaux a permis de proposer l’IL-1RAP comme une
cible tumorale potentielle pouvant être utilisée en thérapie CAR
T-cells. Avant le développement des inhibiteurs de tyrosine kinase,
l’implication du système immunitaire avait été démontrée dans la réponse
anti-tumorale, dans le traitement des LMC, à travers l’utilisation d’allogreffes de
cellules souches hématopoïétiques, de la DLI (donor lymphocyte
infusion), et de l’interféron a (IFNα) en traitement de première ligne.
C’est une des raisons qui nous a conduits à établir la « preuve de concept » d’une
immunothérapie par CAR T-cells dans cette hémopathie maligne. Son
application clinique sera sans doute restreinte, bien qu’elle laisse entrevoir la
possibilité d’éliminer les cellules souches hématopoïétiques tumorales quiescentes,
qui échappent au spectre d’action des inhibiteurs de tyrosine kinase. Sur la base de
ces constatations, nous avons développé un programme de production d’un CAR ciblant
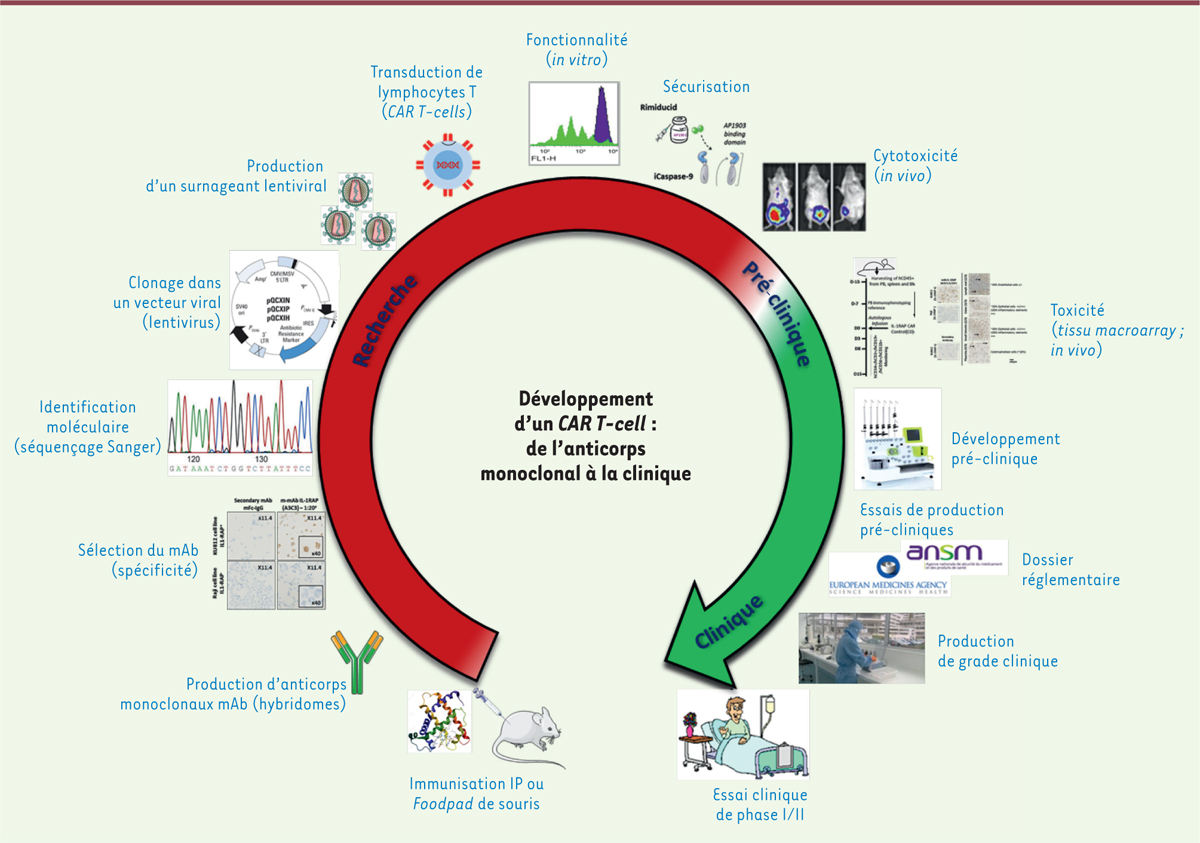
cette protéine d’intérêt (Figure
1) afin de modifier génétiquement des LT autologues.
 | Figure 1. Principales étapes de développement d’une thérapie par
CAR T-cells après identification de la cible. IP :
intrapéritonéale. |
|
« Preuve de concept » d’une immunothérapie par CAR T-cells
ciblant IL-1RAP Nous avons produit un anticorps monoclonal, en immunisant des souris BALB/c avec la
protéine humaine recombinante IL-1RAP. Cet anticorps (#A3C3, Diaclone SA, Besançon,
France : B-L43) a été sélectionné par cytométrie en flux, et analysé par
western blot, immunocytochimie ou microscopie de fluorescence
sur un panel de lignées cellulaires leucémiques, sur du sang placentaire, et sur des
prélèvements provenant de patients atteints de LMC. Les séquences nucléotidiques
codant les régions hypervariables de cette immunoglobuline, V(D)J (pour les chaînes
lourde, IgH) et VJ (pour les chaînes légères, IgL), constituant le scFv, couplées à
celles codant les séquences d’activation T de troisième génération
(CD28-4.1BB-CD3ζ), ont été clonées dans un vecteur lentiviral. Cette construction
(pSDY-5’LTR-iCASP9-T2A-CAR-P2A-∆CD19-3’LTR) comporte également un système de suicide
cellulaire inductible constitué d’un gène inductible par le Rimiducid® codant la
caspase-9 (gène iCASP9), qui permet d’éliminer des CAR
T-cells activées indésirables (safety switch), ainsi
qu’un gène codant une protéine de surface (∆CD19) permettant l’identification et la
sélection des CAR T-cells. Le surnageant des cultures cellulaires
produisant le virus recombinant permet de transduire des LT ex
vivo. L’activation du système suicide iCASP9/Rimiducid® in vitro ou dans
un modèle murin de xénogreffe permet d’éliminer plus de 90 % des CAR
T-cells après 48 heures d’exposition au Rimiducid®. Ce système
contribuera à limiter les effets indésirables liés aux CAR T-cells
(syndrome de relargage de cytokines, neurotoxicité, etc.) ou à la transduction
inopinée de cellules leucémiques résiduelles provenant de la cytaphérèse. En effet,
dans ce cas, l’expression du CAR à la surface va masquer l’épitope de l’antigène
tumoral, qui devient indétectable par les effecteurs cytotoxiques, conduisant ainsi
à un échappement [11].
In vitro, en présence de cellules leucémiques cibles exprimant
IL-1RAP à leur surface, les CAR T-cells IL-1RAP sont capables de
proliférer et de secréter de l’interféron g, des cytokines pro-inflammatoires, de la
perforine et du granzyme B, et finalement d’éliminer ces cellules tumorales. Ces
résultats ont été confirmés in vivo dans des modèles murins de
xénogreffe tumorale (Figure
2).
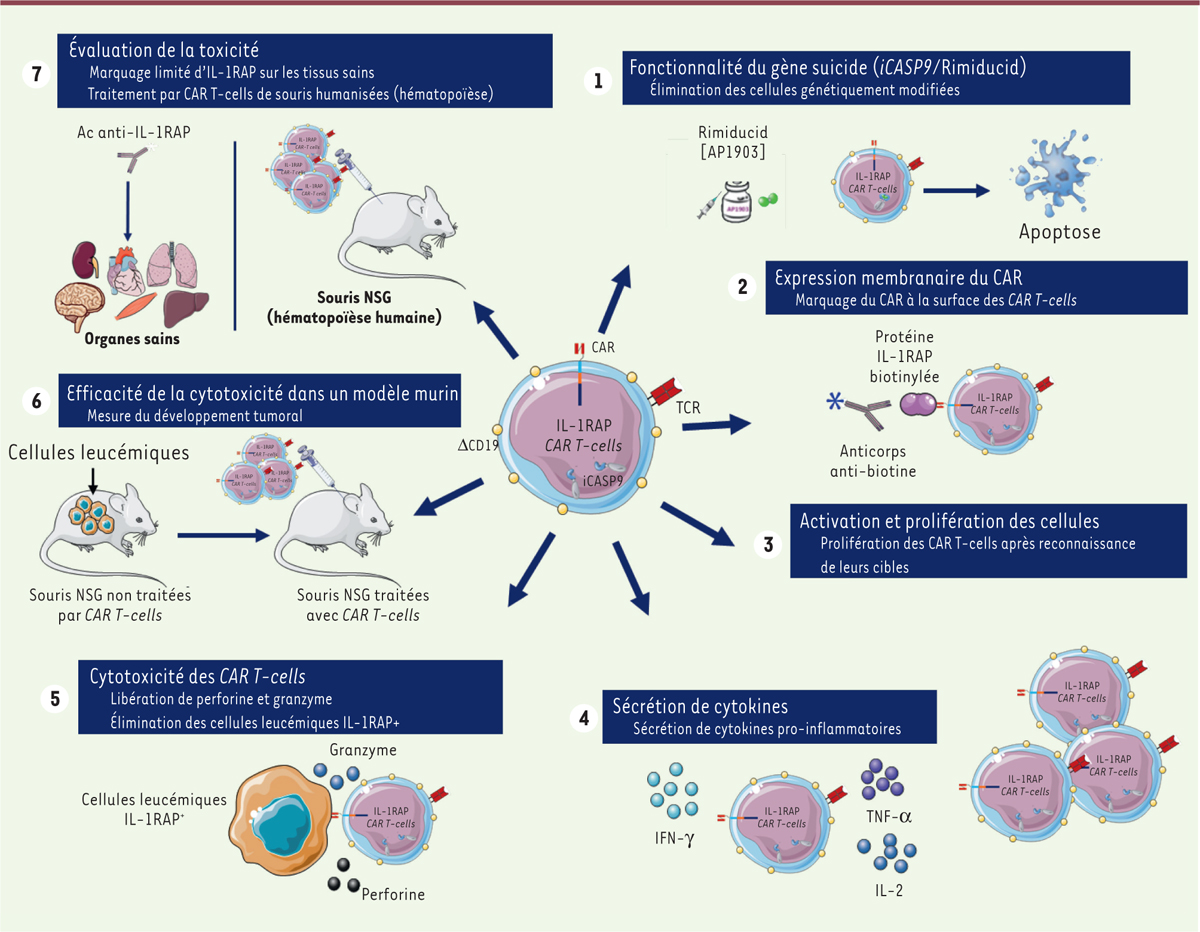
 | Figure 2. Tests in vitro et dans un modèle murin de l’efficacité d’une
immunothérapie par CAR T-cells ciblant des cellules leucémiques
exprimant IL-1RAP. Souris NSG : souris humanisées JAX™ transgéniques :
NOD.Cg-PrkdcSCID Il2rgtm1Wjl/SzJ (Charles
River) ; iCASP9 : gène codant la CASP9 inductible par
Rimiducid® ; TCR : récepteur de la cellule T ; ΔCD19 : gène
CD19 tronqué dans sa partie intracellulaire. |
Les premières études de toxicité potentielle d’un CAR IL-1RAP ont été réalisées par
immunocytochimie avec l’anticorps #A3C3 sur tissue macroarray
comportant 30 tissus différents issus de trois donneurs sains ; seuls 6 tissus se
sont révélés faiblement immunoréactifs. À noter que ni les cellules souches
hématopoïétiques exprimant CD34, ni les LT ou les polynucléaires, n’expriment
IL-1RAP à un taux détectable par cytométrie. Par contre, en situation autologue, les
CAR T-cells IL-1RAP ciblent partiellement les monocytes, mais
avec une efficacité moindre que pour les cellules leucémiques. Nous avons confirmé,
in vitro par culture de cellules progénitrices hématopoïétiques
en présence des CAR T-cells IL-1RAP autologues, mais aussi dans un
modèle murin reconstitué avec des cellules souches hématopoïétiques de sang
placentaire humain, que la reconstitution hématopoïétique n’est pas affectée, sauf
la population monocytaire dans une faible mesure. Ces travaux représentent la première « preuve de concept » qu’une thérapie par
CAR T-cells IL-1RAP permet de cibler et d’éliminer les cellules
leucémiques IL-1RAP+. Après avoir étudié sa sécurité et sa tolérance et démontré son
efficacité dans des essais cliniques de phase I et II, cette immunothérapie pourra
être comparée aux traitements existants et peut-être, au terme de ces essais,
proposée comme alternative à ces traitements. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Maude
SL,
Laetsch
TW,
Buechner
J, et al.
Tisagenlecleucel in children and young adults with B-cell
lymphoblastic leukemia . N Engl J Med.
2018; ; 378 :
:439.–448. 2. Mitchell
K,
Barreyro
L,
Todorova
TI, et al.
IL1RAP potentiates multiple oncogenic signaling pathways in
AML . J Exp Med.
2018; ; 215 :
:1709.–1727. 3. Jaras
M,
Johnels
P,
Hansen
N, et al.
Isolation and killing of candidate chronic myeloid leukemia stem
cells by antibody targeting of IL-1 receptor accessory
protein . Proc Natl Acad Sci USA.
2010; ; 107 :
:16280.–16285. 4. Zhao
K,
Yin
LL,
Zhao
DM, et al.
IL1RAP as a surface marker for leukemia stem cells is related to
clinical phase of chronic myeloid leukemia patients .
Int J Clin Exp Med.
2014; ; 7 :
:4787.–4798. 5. Warda
W,
Larosa
F, Neto Da
Rocha
M, et al.
CML Hematopoietic stem cells expressing IL1RAP can be targeted by
chimeric antigen receptor-engineered T cells . Cancer
Res.
2019; ; 79 :
:663.–675. 6. Blatt
K,
Menzl
I,
Eisenwort
G, et al.
Phenotyping and target expression profiling of
CD34+/CD38- and CD34+/CD38+
stem and progenitor cells in acute lymphoblastic leukemia .
Neoplasia.
2018; ; 20 :
:632.–642. 7. Barreyro
L,
Will
B,
Bartholdy
B, et al.
Overexpression of IL-1 receptor accessory protein in stem and
progenitor cells and outcome correlation in AML and MDS .
Blood.
2012; ; 120 :
:1290.–1298. 8. Zheng
P,
Zhang
Y,
Zhang
B, et al.
Synthetic human monoclonal antibody targets hIL1 receptor
accessory protein chain with therapeutic potential in triple-negative breast
cancer . Biomed Pharmacother.
2018; ; 107 :
:1064.–1073. 9. Agerstam
H,
Hansen
N, von
Palffy
S, et al.
IL1RAP antibodies block IL-1-induced expansion of candidate CML
stem cells and mediate cell killing in xenograft models .
Blood.
2016; ; 128 :
:2683.–2693. 10. Agerstam
H,
Karlsson
C,
Hansen
N, et al.
Antibodies targeting human IL1RAP (IL1R3) show therapeutic
effects in xenograft models of acute myeloid leukemia .
Proc Natl Acad Sci USA.
2015; ; 112 :
:10786.–10791. 11. Ruella
M,
Xu
J,
Barrett
DM, et al.
Induction of resistance to chimeric antigen receptor T cell
therapy by transduction of a single leukemic B cell .
Nat Med.
2018; ; 24 :
:1499.–1503. 12. Catros
V.. Les CAR-T cells,
des cellules tueuses spécifiques d’antigènes tumoraux : de nouvelles
générations pour le traitement des tumeurs solides .
Med Sci (Paris).
2019; ; 35 :
:316.–326. 13. Jordan
B.. Immunothérapie
CAR-T : une autorisation qui fait date . Med Sci
(Paris).
2017; ; 33 :
:1003.–1006. |