| |
| Med Sci (Paris). 35(6-7): 501–503. doi: 10.1051/medsci/2019107.Un partenariat inattendu dans
l’adipocyte Une enzyme, la lipase-hormonosensible, et un facteur de
transcription, ChREBP, contrôlent de concert la sensibilité à
l’insuline Pauline Morigny1 and Dominique Langin1,2* 1Institut des maladies métaboliques et cardiovasculaires,
I2MC, UMR1048, Inserm université Paul Sabatier, CHU Rangueil,
1, avenue Jean Poulhès,
BP 84225,
31432Toulouse Cedex 4,
France 2Service de biochimie, Institut fédératif de biologie,
Hôpitaux de Toulouse, France MeSH keywords: Adipocytes, Tissu adipeux, Animaux, Facteurs de transcription à motifs basiques hélice-boucle-hélice et à glissière à leucines, - traduction non trouvée, Acides gras, Glucose, Humains, Insulinorésistance, Lipolyse, Foie, Souris, Obésité, Acide oléique, Acide palmitique, Sterol Esterase, métabolisme, génétique, physiologie, effets des médicaments et substances chimiques, physiopathologie, antagonistes et inhibiteurs |
Les personnes obèses ont un risque accru de développer un diabète de type 2. Une
résistance à l’action de l’insuline (ou insulinorésistance) est fréquemment associée à
un excès de masse grasse et constitue un défaut précoce du développement du diabète de
type 2. Le métabolisme du tissu adipeux est un déterminant majeur de la sensibilité à
l’insuline au niveau systémique1. Chez la souris,
l’invalidation génique du transporteur du glucose GLUT4 dans le tissu adipeux entraîne
une insulinorésistance [1] et la
manipulation directe de la voie de signalisation de l’insuline dans les cellules
adipeuses permet de confirmer cet effet systémique [2]. Des défauts de signalisation de l’insuline dans
le tissu adipeux ont par ailleurs été rapportés chez des patients insulinorésistants et
diabétiques de type 2 [3]. Dans
ce contexte, l’amélioration de l’action de l’insuline dans le tissu adipeux pourrait
permettre de recouvrer une sensibilité systémique à l’insuline dans les états
prédiabétiques et diabétiques. Les glitazones, une classe de molécules améliorant
l’action systémique de l’insuline, agissent par modulation de la sensibilité des
cellules adipeuses à l’insuline [4]. Leurs effets secondaires ont néanmoins entraîné leur retrait du marché
dans de nombreux pays, et il existe donc un besoin non satisfait de médicaments ciblant
le tissu adipeux. Un taux circulant excessif d’acides gras est considéré comme un
facteur important dans la genèse d’une insulinorésistance en induisant une lipotoxicité
dans des tissus sensibles à l’insuline, tels que le foie et les muscles squelettiques
[5]. Une réduction des taux
plasmatiques d’acides gras non estérifiés par inhibition de la lipolyse des cellules
adipeuses a donc été proposée pour tenter d’améliorer la sensibilité à l’insuline.
Cependant, des données chez l’homme remettent en cause le lien entre la production
d’acides gras à partir de la lipolyse des tissus adipeux et la résistance à l’insuline
dans l’obésité [6]. |
Relation entre la lipase hormono-sensible adipocytaire et la sensibilité à
l’insuline Notre laboratoire s’intéresse depuis de nombreuses années à la relation entre la
lipase hormono-sensible (LHS) adipocytaire, une enzyme clé impliquée dans le
contrôle de la lipolyse, et la sensibilité à l’insuline. Nous avons en effet décrit
en 2013 qu’une invalidation partielle de la LHS chez la souris améliore la tolérance
au glucose et à l’insuline, favorise l’utilisation du glucose par le muscle et le
tissu adipeux, et inhibe la production hépatique de glucose [7]. Néanmoins, les taux circulants d’acides gras
étant inchangés chez ces animaux, les mécanismes impliqués dans ces effets
bénéfiques restaient incompris. Dans une étude récemment publiée dans la revue
Nature Metabolism, nous montrons qu’une invalidation partielle
de la LHS dans des adipocytes humains en culture favorise l’entrée du glucose dans
la cellule ainsi que son utilisation pour la synthèse d’acides gras (lipogenèse
de novo), et améliore la transmission du signal insulinique
[8]. En utilisant des
inhibiteurs pharmacologiques des enzymes de la lipogenèse de novo,
nous avons constaté que l’activation de cette voie est essentielle aux effets
bénéfiques de l’invalidation de la LHS sur la sensibilité à l’insuline. Une étude du
profil en acides gras des adipocytes a permis de révéler l’enrichissement en un
acide gras à longue chaîne mono-insaturé, l’acide oléique (un acide gras
majoritairement retrouvé dans l’huile d’olive), au détriment d’acides gras saturés
délétères, tels que l’acide palmitique. L’enzyme-clé de ce remaniement est
l’élongase des acides gras à longue chaîne ELOVL6 (elongation of long-chain
fatty acids family member 6), dont la synthèse est fortement induite à
la suite d’une invalidation du gène codant la LHS dans des adipocytes humains en
culture, ou dans le tissu adipeux de divers modèles murins. Une déficience en
ELOVL6 conduit, in vitro et in
vivo, à un enrichissement des adipocytes en acide palmitique au
détriment de l’acide oléique, et à une insulino-résistance adipocytaire. Chez
l’homme, l’expression d’ELOVL6 est fortement diminuée dans le tissu
adipeux de personnes obèses et insulinorésistantes, et une chirurgie
bariatrique2 permet de la recouvrer,
confirmant le lien entre ELOVL6 et sensibilité à l’insuline. D’un point de vue
mécanistique, la surexpression d’ELOVL6 dans des adipocytes humains
augmente la fluidité de leur membrane plasmique améliorant la signalisation par
l’insuline. |
Le facteur de transcription ChREBP est responsable des effets bénéfiques de
l’invalidation de la LHS sur la sensibilité à l’insuline Le facteur de transcription ChREBP (carbohydrate-responsive element-binding
protein) est un acteur essentiel du contrôle de la lipogenèse
de novo dans les adipocytes [12] (→).
(→) Voir la Synthèse de F. Benhamed et al.,
m/s n° 8-9, août-septembre 2013, page 765
Son effet bénéfique sur la sensibilité à l’insuline des tissus adipeux a été montré
[9]. ChREBPα est
l’isoforme la plus fortement exprimée et la plus stable. Présent dans le cytosol,
ChREBPα se déplace vers le noyau suite à une forte entrée de glucose dans la
cellule, où il devient actif et acquiert son activité transcriptionnelle. Il induit
alors l’expression d’une seconde isoforme de ChREBP à très forte activité
transcriptionnelle, ChREBPβ, à l’origine de la synthèse des enzymes lipogéniques. La
synthèse de ChREBPβ par les adipocytes est fortement induite à la suite d’une
invalidation de la LHS. Une réduction de l’expression de ChREBPβ, au contraire,
conduit à une baisse de synthèse d’acide oléique et à une réduction du signal
insulinique, attestant de l’implication de ce facteur de transcription dans les
effets bénéfiques d’une invalidation de la LHS. Le gène codant ELOVL6 s’est avéré
être une cible préférentielle du facteur ChREBP. Comparée à celle des gènes codant
les autres enzymes lipogéniques, l’expression de ELOVL6 est la plus
affectée suite à une déficience en ChREBP in vitro et in
vivo. Ces résultats ont été confirmés par la liaison directe de ChREBP
sur l’élément de réponse au glucose du promoteur d’ELOVL6. Chez
l’homme, l’expression d’ELOVL6 est fortement induite lors d’un
clamp hyperglycémique-hyperinsulinémique, et est étroitement corrélée à la synthèse
de ChREBPβ dans le tissu adipeux sous-cutané. |
L’interaction de la LHS avec ChREBP réprime son activité
transcriptionnelle L’absence de modification des taux d’acides gras produits par les adipocytes
invalidés pour le gène codant la LHS nous a conduits à supposer qu’une interaction
physique entre la LHS et le facteur ChREBP pouvait être responsable de l’inhibition
de ce facteur. Par la combinaison de nombreuses techniques d’étude des interactions
protéine-protéine dont la technique de ligature de proximité (proximity
ligation assay)
3, nous avons mis en évidence, in
vitro et in vivo, l’existence d’une interaction
physique entre la LHS et ChREBPα dans le cytoplasme des adipocytes. Dans des
adipocytes humains et dans le tissu adipeux murin, l’invalidation du gène codant la
LHS réduit cette interaction avec ChREBPα, ce qui entraîne sa relocalisation
nucléaire. L’activité enzymatique de la LHS n’est pas nécessaire à son interaction
avec ChREBPα puisqu’une forme naturelle de LHS démunie d’activité catalytique
conserve ses capacités de liaison au facteur. La surexpression de cette forme non
catalytique de LHS conduit à la perte de l’expression d’ELOVL6,
abolissant l’amélioration de la signalisation insulinique dans des adipocytes
invalidés pour la LHS. Ainsi, la LHS, en interagissant avec le facteur ChREBPα,
conduit à sa rétention dans le cytosol et inhibe son activité transcriptionnelle.
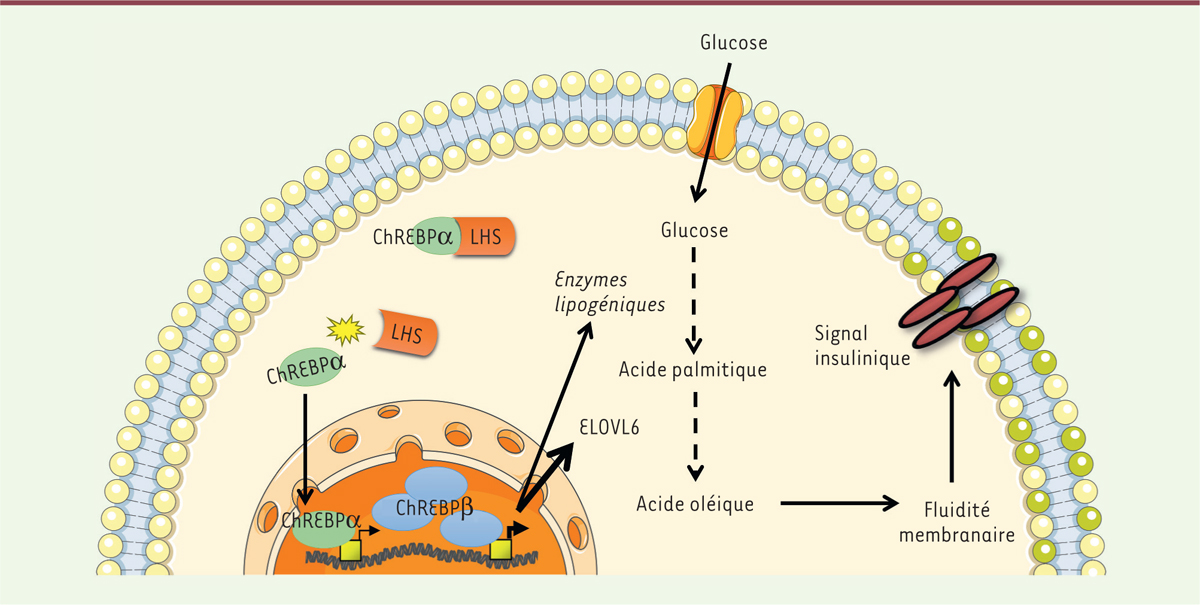
L’invalidation de la LHS dans l’adipocyte provoque la libération et la translocation
nucléaire de ChREBPα, l’induction de la transcription de ChREBPβ et
d’ELOVL6, ainsi que la synthèse d’acide oléique, ce qui
améliore la fluidité membranaire et la signalisation par l’insuline (Figure 1).
 | Figure 1. Description schématique de la voie LHS / ChREBP/ELOVL6 contrôlant la
signalisation par l’insuline dans l’adipocyte. La LHS interagit avec le
facteur de transcription ChREBPα dans le cytosol et inhibe la
translocation nucléaire de cette protéine. Dans le noyau, ChREBPα active
un autre promoteur de son propre gène, ce qui augmente la production de
l’isoforme superactive ChREBPβ. Il en résulte une induction de la
transcription du gène ELOVL6 qui est responsable d’une
augmentation de la synthèse d’acide oléique. L’augmentation de la
proportion d’acide oléique dans les phospholipides de la membrane
plasmique améliore la fluidité de la membrane plasmique et la
signalisation par l’insuline. LHS : lipase hormono-sensible ; ChREBP :
carbohydrate-responsive element-binding protein ;
ELOVL6 : elongation of long-chain fatty acids family member
6. |
|
Dans la cellule adipeuse, la réduction de l’interaction entre la LHS et le facteur de
transcription ChREBP favorise sa translocation nucléaire et son activité
transcriptionnelle. Cette nouvelle voie fournit ainsi une base moléculaire du
mécanisme de contrôle différentiel de la lipogenèse de novo dans le
foie et le tissu adipeux. ChREBP est impliqué dans la régulation de la lipogenèse
de novo dans les deux tissus [10]. La lipogenèse de novo est
généralement considérée comme néfaste dans le foie, car elle est activée lors du
développement de la stéatose hépatique. En revanche, elle est considérée comme
bénéfique dans le tissu adipeux, car le lien positif avec la sensibilité à
l’insuline a été démontré à la fois dans des études cliniques et chez la souris
[11]. La LHS est
exprimée à un niveau beaucoup plus important dans les adipocytes que dans les
hépatocytes et aucune interaction n’est détectée entre LHS et ChREBP dans les
hépatocytes humains. Diminuer l'effet inhibiteur de la LHS sur l'activité de ChREBP
peut donc constituer un mécanisme spécifique des cellules adipeuses pour améliorer
la lipogenèse de novo et la signalisation de l’insuline. En conclusion, notre travail a permis d’identifier une voie critique pour la
signalisation optimale de l’insuline dans les cellules adipeuses. Elle relie la
lipase neutre LHS au facteur de transcription sensible au glucose ChREBP et à son
gène cible ELOVL6, qui code l’élongase des acides gras à longue
chaîne. Ceci constitue un exemple, unique à ce jour, d’une enzyme impliquée dans le
métabolisme des lipides qui, indépendamment de son activité enzymatique, inhibe
l’activité d’un facteur de transcription par le biais d’une interaction
protéine-protéine. L’inhibition de l’interaction LHS-ChREBP dans le tissu adipeux
pourrait donc constituer une stratégie pour réduire la résistance à l’action de
l’insuline chez les personnes obèses diabétiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Abel
ED,
Peroni
O,
Kim
JK, et al.
Adipose-selective targeting of the GLUT4 gene impairs insulin
action in muscle and liver . Nature.
2001; ; 409 :
:729.–733. 2. Softic
S,
Boucher
J,
Solheim
MH, et al.
Lipodystrophy due to adipose tissue specific insulin receptor
knockout results in progressive NAFLD .
Diabetes.
2016; ; 65 : :8.. 3. Nyman
E,
Rajan
MR,
Fagerholm
S, et al.
A single mechanism can explain network-wide insulin resistance in
adipocytes from obese patients with type 2 diabetes .
J Biol Chem.
2014; ; 289 :
:33215.–33230. 4. Hammarstedt
A,
Sopasakis
VR,
Gogg
S, et al.
Improved insulin sensitivity and adipose tissue dysregulation
after short-term treatment with pioglitazone in non-diabetic,
insulin-resistant subjects . Diabetologia.
2005; ; 48 :
:96.–104. 5. Samuel
VT,
Shulman
GI. Mechanisms for
insulin resistance: common threads and missing links .
Cell.
2012; ; 148 :
:852.–871. 6. Karpe
F,
Dickmann
JR,
Frayn
KN. Fatty acids,
obesity, and insulin resistance: time for a reevaluation .
Diabetes.
2011; ; 60 :
:2441.–2449. 7. Girousse
A,
Tavernier
G,
Valle
C, et al.
Partial inhibition of adipose tissue lipolysis improves glucose
metabolism and insulin sensitivity without alteration of fat
mass . PLoS Biol.
2013; ; 11 :
:e1001485.. 8. Morigny
P,
Houssier
M,
Mairal
A, et al.
Interaction between hormone-sensitive lipase and ChREBP in fat
cells controls insulin sensitivity . Nature
Metab.
2019; ; 1 :
:133.–146. 9. Herman
MA,
Peroni
OD,
Villoria
J, et al.
A novel ChREBP isoform in adipose tissue regulates systemic
glucose metabolism . Nature.
2012; ; 484 :
:333.–338. 10. Abdul-Wahed
A,
Guilmeau
S,
Postic
C. Sweet Sixteenth
for ChREBP: established roles and future goals . Cell
Metab.
2017; ; 26 :
:324.–341. 11. Solinas
G,
Boren
J,
Dulloo
AG. De novo
lipogenesis in metabolic homeostasis: more friend than foe? .
Mol Metab.
2015; ; 4 :
:367.–377. 12. Benhamed
F,
Poupeau
A,
Postic
C. Le facteur de
transcription ChREBP : un modulateur clé de la sensibilité à
l’insuline . Med Sci (Paris).
2013; ; 29 :
:765.–771. |