| |
| Med Sci (Paris). 35(6-7): 512–514. doi: 10.1051/medsci/2019103.L’autophagie chez « l’hôte » Une source d’alimentation pour les tumeurs Laura Poillet-Perez1 1Institut Rutgers du cancer de l’État du New
Jersey, 195 Little Albany
street, NJ08903New Brunswick,
États-Unis. MeSH keywords: Animaux, Arginase, Arginine, Autophagie, Hépatocytes, Humains, Souris, Tumeurs, Processus néoplasiques, métabolisme, sang, physiologie, physiopathologie |
L’autophagie est un processus catabolique impliqué dans la dégradation et le recyclage
des protéines et organelles endommagées, régulé par les protéines ATG
(autophagy-related genes) (→).
(→) Voir le numéro thématique Autophagie, m/s n°
3, mars 2017
Les composants cytoplasmiques altérés sont ainsi séquestrés par les autophagosomes, des
vésicules à double membrane qui fusionnent ensuite avec les lysosomes pour former des
autolysosomes [1]. Le contenu de
ces autolysosomes sera dégradé et recyclé en acides aminés, acides nucléiques, ou acides
gras afin de permettre leur réutilisation par les cellules [2]. Un taux basal d’autophagie est nécessaire à
l’homéostasie et au métabolisme cellulaires. Mais l’autophagie peut également être
induite pour la survie de la cellule en cas de carence en nutriments ou de stress
oxydant [3]. L’importance de
l’autophagie a été démontrée par des expériences de délétion du gène
Atg7 chez des souris adultes mises à jeûn qui conduit à une
déficience métabolique systémique, caractérisée par une réduction de la quantité de
lipides dans le tissu adipeux blanc, du stockage du glycogène dans le foie, et du
contenu en protéines des muscles. Ces souris sont également incapables de maintenir leur
glycémie, ce qui ne leur permet pas de survivre [4]. |
L’autophagie de « l’hôte » est nécessaire à la croissance tumorale Étant donné le rôle de l’autophagie dans le métabolisme et l’homéostasie cellulaires,
il n’est pas surprenant que son dysfonctionnement ait été impliqué dans les maladies
neurodégénératives, les maladies infectieuses, ou le cancer [5]. Cependant le rôle de l’autophagie dans le
cancer reste controversé. En effet, l’autophagie est considérée comme anti-tumorale
aux stades précoces de la tumorigenèse, en éliminant les espèces réactives de
l’oxygène, et en limitant l’inflammation et les instabilités génomiques, connues
pour induire l’initiation tumorale. En revanche, à des stades plus tardifs de la
croissance tumorale, elle permet la progression et la survie des cellules tumorales
en conditions de stress oxydant et métabolique induits par le microenvironnement
[6] (→).
(→) Voir la Synthèse de C. Joffre et al.,
m/s n° 3, mars 2017, page 328
Jusqu’à présent, la plupart des études concernant l’autophagie et le cancer se
concentraient uniquement sur le rôle de l’autophagie tumorale (au sein des cellules
cancéreuses) dans la progression tumorale. Néanmoins, la délétion systémique
d’Atg7 (à la fois dans les cellules normales et dans les
cellules cancéreuses) conduit à une régression spectaculaire de la tumeur, qui est
plus importante que celle observée lorsque seule l’autophagie dans les cellules
cancéreuses est affectée par la suppression du gène Atg7 [4]. Ce résultat indique ainsi l’importance, pour
la croissance tumorale, de l’autophagie non seulement dans les cellules tumorales
(autophagie tumorale) mais également dans les cellules saines du microenvironnement
tumoral (autophagie de « l’hôte »). De récentes études ont également suggéré
l’importance de l’autophagie de « l’hôte » pour la croissance du cancer du pancréas
chez la souris, et dans un autre modèle tumoral, chez Drosophila
melanogaster (la mouche du vinaigre) [7, 8]. Notre étude, quant à elle, a confirmé que l’autophagie de «
l’hôte » était nécessaire à la croissance tumorale. Elle a également permis de
caractériser le mécanisme qui était impliqué. Nous avons en effet montré que
l’autophagie de « l’hôte » permet de maintenir un taux sanguin d’arginine nécessaire
à la croissance tumorale. Nous avons comparé des souris déficientes en autophagie
(Atg7
D/D) à des souris témoins (Atg7
+/+) quant à la croissance de différentes lignées cellulaires cancéreuses
dont l’autophagie n’avait pas été altérée [9]. La perte d’autophagie dans les cellules de « l’hôte »
(Atg7
D/D) diminue la croissance de plusieurs lignées de cellules cancéreuses,
dont celles de mélanome (Yumm 1.1 and Yumm 1.3), celles de cancer urothélial (MB49),
et celles de cancer du poumon non à petites cellules (NSCLC, 71.8), confirmant ainsi
l’importance, pour la croissance tumorale, de l’autophagie de « l’hôte ». Néanmoins,
nous avons également montré que certaines cellules de mélanome (Yumm 1.7 and Yumm
1.9) sont capables de proliférer en présence, mais aussi en l’absence d’autophagie
dans les cellules de « l’hôte », ce qui suggére l’existence de mécanismes
d’adaptation [9]. |
L’autophagie de « l’hôte » maintient le métabolisme tumoral Nous avons examiné les mécanismes par lesquels l’autophagie de « l’hôte » pouvait
favoriser la croissance tumorale. Une caractéristique essentielle des cellules
tumorales est leur capacité à reprogrammer leur métabolisme afin d’obtenir les
nutriments ou intermédiaires métaboliques nécessaires à leur survie et leur
multiplication [10].
L’autophagie est importante pour le métabolisme des cellules [4]. Son inhibition induit en effet une altération du métabolisme
globale des cellules de « l’hôte » rendant l’environnement de la tumeur défavorable
à sa croissance. Puisque les deux sources principales de nutriments pour la tumeur
chez « l’hôte » sont la circulation sanguine et le microenvironnement tumoral, nous
avons comparé, par spectrométrie de masse, les taux de différents métabolites dans
le sérum de souris Atg7
D/D et Atg7+/+
. Nous avons ainsi montré que le taux de 19 métabolites était modifié dans
le sérum des souris Atg7
D/D, déficientes en autophagie [9].
En particulier, la concentration sérique d’arginine y est très fortement réduite
[4, 9]. L’arginine est un acide aminé semi-essentiel, qui peut être obtenu
par l’alimentation, par synthèse de novo, ou par recyclage des
protéines endogènes. Elle est impliquée dans de nombreux processus biologiques,
notamment la synthèse des protéines, le cycle de l’urée, et l’activation de mTOR
(mammalian target of rapamycin), une enzyme contrôlant le
métabolisme cellulaire. De nombreuses cellules cancéreuses humaines n’expriment pas
les enzymes nécessaires au métabolisme de l’arginine, telles que l’argininosuccinate
synthase 1 (ASS1) ou l’ornithine transcarbamoyltransférase (OTC). Elles dépendent
donc de l’apport exogène de cet acide aminé pour leur croissance et leur division :
elles sont dites auxotrophes pour l’arginine [11]. Les tumeurs que nous avons étudiées
n’expriment pas ASS1 et OTC in vivo, et sont
incapables de proliférer dans un milieu dépourvu d’arginine in
vitro [9]. Les lignées
cellulaires cancéreuses dont la croissance est semblable chez les souris
Atg7
D/D et les souris témoins, n’expriment pas non plus ASS1
et OTC. Un mécanisme de compensation en réponse à la carence en
arginine ou un autre mécanisme constitutif de résistance à l’inhibition de
l’autophagie, indépendant de l’auxotrophie pour l’arginine, doit donc exister. |
L’autophagie dans les cellules du foie est particulièrement importante au
maintien de la concentration d’arginine dans le sang Nous avons recherché comment l’inhibition de l’autophagie basale pouvait conduire à
la réduction du taux d’arginine circulante. Par des analyses protéomique et
métabolique comparant les sérums des souris Atg7
+/+ et Atg7
D/D, nous avons pu mettre en évidence chez les souris
Atg7
D/D une augmentation de la quantité et de l’activité de l’arginase 1
(ARG1), l’enzyme responsable de la dégradation de l’arginine en ornithine [9]. Une diminution du taux d’arginine a
également été observée dans les tumeurs des souris Atg7
D/D
in vivo, ce qui confirme, chez ces souris, l’insuffisance d’apport
en arginine aux cellules tumorales n’exprimant pas ASS1, inhibant ainsi leur
prolifération. La supplémentation en arginine des souris Atg7
D/D restaure partiellement le taux d’arginine circulante et la croissance
tumorale. L’arginase 1 est principalement exprimée dans les hépatocytes, mais elle peut être
libérée dans la circulation sanguine en cas de lésion ou d’inflammation hépatique
[12]. La délétion
ciblée d’Atg7 dans le foie entraîne, comme pour les souris
Atg7
D/D, une augmentation du taux sanguin d’arginase 1 et une diminution de
l’arginine. Elle provoque également une diminution de la quantité d’arginine dans
les tumeurs et une inhibition de la croissance tumorale, bien que moins importante
que celle observée en cas d’invalidation ubiquitaire du gène [9]. Cette différence pourrait s’expliquer par la capacité de
l’autophagie dans les cellules non-cancéreuses constituant le microenvironnement
tumoral de fournir de l’arginine aux cellules tumorales [9]. Nos résultats indiquent donc que la délétion
d’Atg7 dans le foie conduit à la libération dans le sang par
les hépatocytes d’arginase 1 permettant la dégradation de l’arginine circulante en
ornithine. Cet effet dépend bien de l’autophagie puisque des résultats similaires
ont été obtenus lors de l’invalidation d’Atg5 (dans toutes les
cellules de « l’hôte », ou restreinte aux hépatocytes), un autre gène indispensable
à l’autophagie. |
Vers l’utilisation de l’arginase 1 en association avec des inhibiteurs de
l’autophagie chez les patients ? Nos résultats indiquent que l’autophagie dans les cellules du foie empêche la
libération de l’arginase 1 par ces cellules et la dégradation de l’arginine
circulante en ornithine, qui contribue à la croissance des tumeurs auxotrophes pour
l’arginine (Figure 1). Notre
étude a également mis en évidence une nouvelle vulnérabilité métabolique des
cellules cancéreuses et confirmé l’importance, pour la croissance tumorale, de
l’autophagie de « l’hôte »[9]. L’autophagie
joue un rôle important dans le contrôle des nutriments essentiels pour la croissance
de la tumeur en agissant sur les sources locale et systémique d’acides aminés. Son
inhibition thérapeutique chez des patients atteints de cancer devrait permettre de
réduire l’apport en nutriments essentiels pour la tumeur et de limiter ainsi sa
croissance. De nombreuses tumeurs étant auxotrophes pour l’arginine, des thérapies
visant à dégrader l’arginine, par l’utilisation d’enzymes telles que l’arginase 1 ou
l’arginine déiminase, sont en développement. Les premiers essais cliniques chez les
patients atteints de cancer sont prometteurs puisqu’ils ont montré des effets
bénéfiques et une faible toxicité pour les patients. L’utilisation combinée
d’inhibiteurs de l’autophagie, comme la chloroquine ou le LY294002 (un inhibiteur de
la phosphatidylinositol 3-kinase, PI3K), augmente la mort des cellules de cancer du
poumon non à petites cellules induite par l’arginase 1 in vitro, et
potentialise l’effet anti-tumoral de cette enzyme in vivo [13]. Il est désormais
nécessaire de progresser dans notre compréhension des interactions entre autophagie,
métabolisme, et croissance tumorale afin de développer, améliorer, et adapter les
futurs traitements pour les patients atteints de cancer.
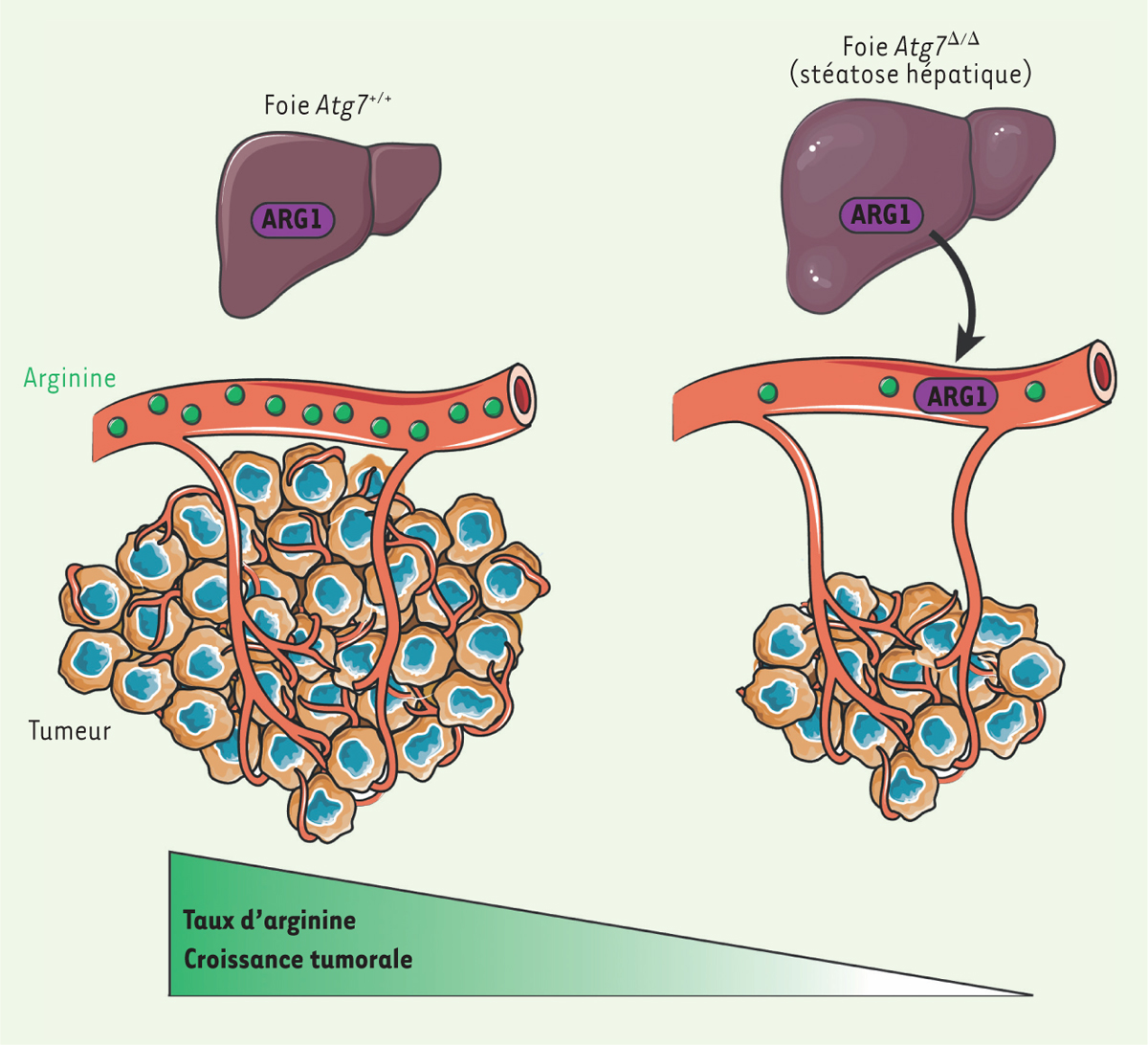
 | Figure 1. Rôle de l’autophagie de « l’hôte » dans la croissance tumorale. Chez les
souris contrôle, l’arginine produite par les reins est utilisée par les
cellules tumorales pour leur croissance. Chez les souris déficientes en
autophagie, la délétion d’Atg7
(autophagy-related gene) dans le foie libère l’ARG1
(arginase 1) dans la circulation, conduisant à la
dégradation de l’arginine. Dans ces conditions, les tumeurs auxotrophes
pour l’arginine sont incapables de proliférer. Illustrations réalisées
avec l’aide de Servier, CC-BY-3.0 (https://smart.servier.com/). |
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Je remercie tous les co-auteurs qui ont participé à cette étude et les membres de
l’équipe du Rutgers Cancer Institute of New Jersey. Ce travail a été financé par le
National institute of health (R01CA163591), et par une bourse post-doctorale de New
Jersey commission for cancer research (DHFS16PPC034).
|
1. Klionsky
DJ,
Codogno
P. The mechanism and
physiological function of macroautophagy . J Innate
Immun.
2013; ; 5 :
:427.–433. 2. Guo
JY,
Teng
X,
Laddha
SV, et al.
Autophagy provides metabolic substrates to maintain energy charge
and nucleotide pools in Ras-driven lung cancer cells .
Genes Dev.
2016; ; 30 :
:1704.–1717. 3. Rabinowitz
JD,
White
E. Autophagy and
metabolism . Science.
2010; ; 330 :
:1344.–1348. 4. Karsli-Uzunbas
G,
Guo
JY,
Price
S, et al.
Autophagy is required for glucose homeostasis and lung tumor
maintenance . Cancer Discov.
2014; ; 4 :
:914.–927. 5. Mizushima
N,
Levine
B,
Cuervo
AM,
Klionsky
DJ. Autophagy fights
disease through cellular self-digestion .
Nature.
2008; ; 451 :
:1069.–1075. 6. Joffre
C,
Djavaheri-Mergny
M,
Pattingre
S,
Giuriato
S. L’autophagie : le
yin et le yang des cancers . Med Sci (Paris).
2017; ; 33 :
:328.–334. 7. Sousa
CM,
Biancur
DE,
Wang
X, et al.
Pancreatic stellate cells support tumour metabolism through
autophagic alanine secretion . Nature.
2016; ; 536 :
:479.–483. 8. Katheder
NS,
Khezri
R,
O’Farrell
F, et al.
Microenvironmental autophagy promotes tumour
growth . Nature.
2017; ; 541 :
:417.–420. 9. Poillet-Perez
L,
Xie
X,
Zhan
L, et al.
Autophagy maintains tumour growth through circulating
arginine . Nature.
2018; ; 563 :
:569.–573. 10. Vander Heiden MG .
DeBerardinis RJ. Understanding the intersections between
metabolism and cancer biology . Cell.
2017; ; 168 :
:657.–669. 11. Patil
MD,
Bhaumik
J,
Babykutty
S, et al.
Arginine dependence of tumor cells: targeting a chink in cancer’s
armor . Oncogene.
2016; ; 35 :
:4957.–4972. 12. Morris
SM, Jr.
. Arginases and arginine deficiency
syndromes . Curr Opin Clin Nutr Metab Care.
2012; ; 15 :
:64.–70. 13. Shen
W,
Zhang
X,
Fu
X, et al.
A novel and promising therapeutic approach for NSCLC: recombinant
human arginase alone or combined with autophagy inhibitor .
Cell Death Dis.
2017; ; 8 : :e2720.. |