| |
| Med Sci (Paris). 35(6-7): 527–534. doi: 10.1051/medsci/2019095.Détection de l’ADN cytosolique par la voie
cGAS-STING De l’immunité innée vers le contrôle de la
tumorigenèse Romain Chanut1 and Virginie Petrilli1* 1Centre de recherche en cancérologie de Lyon, UM5286 U1052,
université de Lyon, centre Léon Bérard, 69008Lyon,
France |

Vignette (Photo © Inserm - Charlotte Boix). La réponse immunitaire innée est la première ligne de défense contre les infections. Elle
repose sur la reconnaissance de motifs essentiels et spécifiques aux pathogènes, les
PAMP (pathogen-associated molecular patterns), par des récepteurs
spécialisés de l’immunité innée, les PRR (pattern recognition
receptors). Des signaux de danger libérés par les cellules endommagées de
l’hôte, appelés DAMP (damage-associated molecular patterns) sont
également reconnus par ces PRR. Leur engagement induit une signalisation intracellulaire
aboutissant à une réponse inflammatoire permettant de lutter contre le pathogène et de
réparer le tissu. L’ADN bactérien, qui est enrichi en îlots CpG non méthylés, est
détecté par le récepteur membranaire TLR9 (toll-like receptor 9) [1], le LPS (lipopolysaccharide) des
membranes de bactéries à Gram négatif, par le TLR4. Les ARN viraux double brins
cytosoliques sont, eux, reconnus par les hélicases de type RIG-I (retinoic
acid-inducible gene 1 protein). Chez les eucaryotes, l’ADN est normalement
confiné dans le noyau de la cellule ou dans la mitochondrie. Sa présence dans le cytosol
est détectée par des senseurs de l’ADN, tels que AIM2 (absent
in melanoma 2), DAI (DNA-dependent activator of IRF) ou
IFI16 (interferon gamma-inducible protein 16), dont les spécificités ne
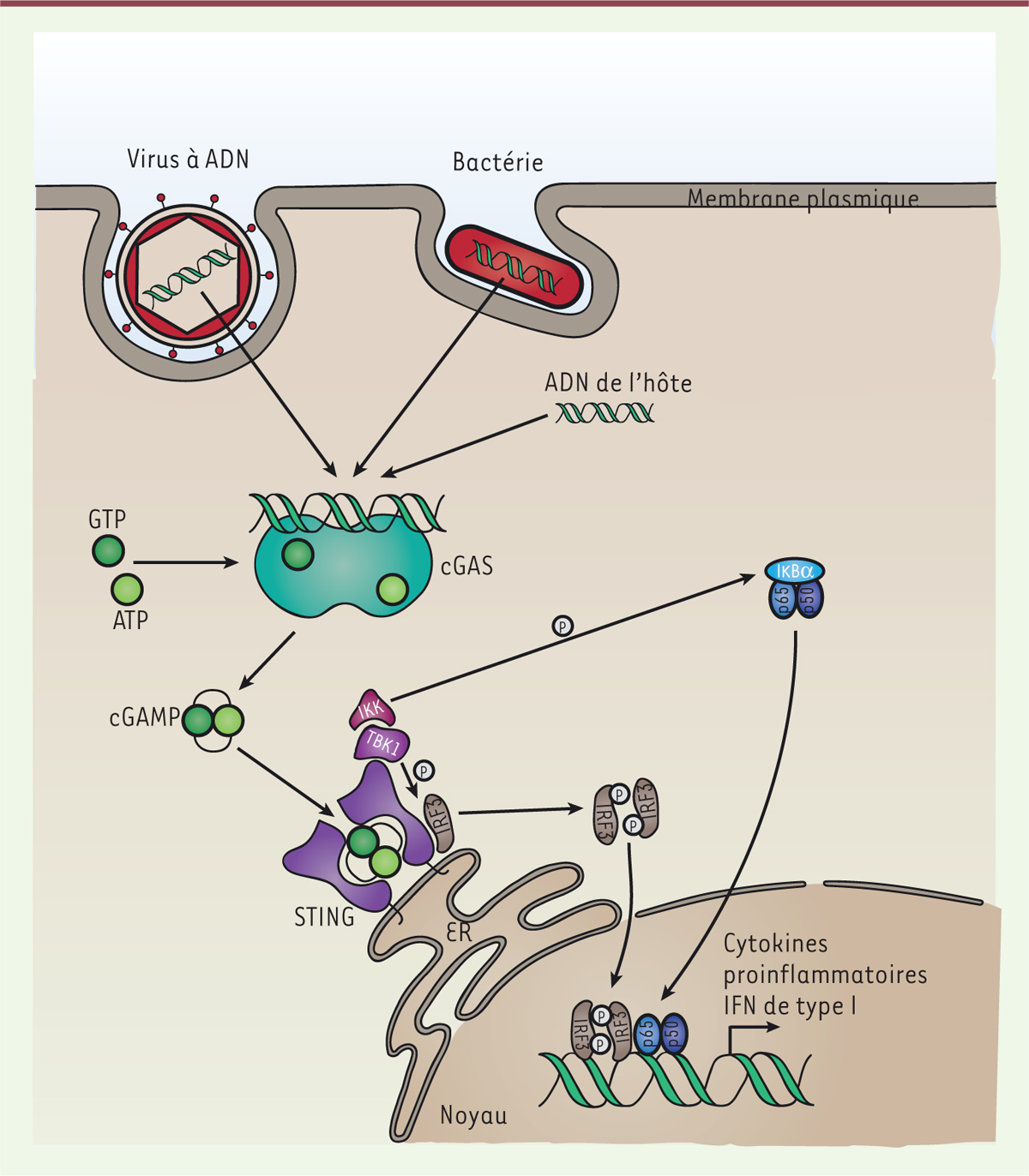
sont pas entièrement élucidées [1]. En 2013, le laboratoire de ZJ Chen a identifié la cGAS (cyclic GMP-AMP
synthase) comme étant un senseur majeur et ubiquitaire de
l’ADN cytosolique double brin indépendamment de sa séquence [2]. L’interaction de l’ADN cytosolique avec cGAS
entraîne son activation et conduit à la production du second messager cGAMP
(cyclic GMP-AMP) à partir d’ATP et de GTP. Ce messager se fixe à
son récepteur STING (stimulator of interferon genes) qui est localisé
sur la membrane du réticulum endoplasmique (Figure
1). Cette liaison induit son changement de conformation et
l’activation des kinases TBK1 (TANK-binding kinase 1) et IKK
(inhibitor of nuclear factor kappa kinase). Celles-ci phosphorylent
respectivement le facteur de transcription IRF3 (interferon regulatory factor
3) et IκBα, le répresseur de NF-κB (nuclear factor kappa
B). La forme phosphorylée d’IRF3 et le facteur de transcription NF-κB ainsi
libérés se relocalisent alors dans le noyau où ils induisent l’expression des gènes
codant les interférons de type I (IFN-I) et des cytokines inflammatoires. Ces médiateurs
contribuent à l’établissement d’une réponse immunitaire contre le pathogène détecté
[3]. cGAS ne détecte pas
seulement l’ADN d’origine microbienne, mais également celui de l’hôte lorsqu’il se
retrouve présent dans le cytosol à la suite d’un stress. Cet ADN est alors considéré
comme un DAMP. Cette réponse contre l’ADN de l’hôte peut être à l’origine de maladies
auto-immunes, comme le lupus érythémateux disséminé ou le syndrome d’Aicardi-Goutières
[4, 56] (→).
(→) Voir la Synthèse de P. Lebon et al., m/s n° 3, mars 2019,
page 232
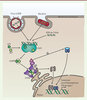 | Figure 1. Voie de signalisation cGAS-STING. L’ADN cytoplasmique double brin active
cGAS, stimulant la production de cGAMP à partir d’ATP et de GTP. cGAMP se
lie à STING et induit son changement de conformation, permettant le
recrutement de TBK1 et IKK. Ces deux kinases phosphorylent respectivement
IRF3 et IkBa. La forme phosphorylée de IkBa libère le facteur NF-κB
(sous-unités p65 et p50). Cet hétérodimère et P-IRF3 (IRF3 phosphorylé)
entrent dans le noyau où ils induisent l’expression des IFN-I et de
cytokines en se liant à leurs promoteurs cibles respectifs. TKB1 :
TANK-binding kinase 1 ; IKK : inhibitor of
NF-κB kinase ; IRF3 : interferon
regulatory factor 3 ; IκBα : NF-κB
inhibitor alpha ; NF-kB : nuclear factor kappa
B (est constitué de plusieurs sous-unités dont p65 et p50) ;
IFN-I : interféron de type I ; ER : réticulum endoplasmique. |
L’expression ubiquitaire de cGAS lui confère la capacité de surveiller de multiples
événements dans l’organisme. Depuis la découverte de ce PRR, ce domaine de recherche est
en ébullition. Les nombreuses études récentes n’ont pas seulement contribué à mieux
comprendre son rôle dans la détection des pathogènes, mais elles ont révélé de nouvelles
fonctions pour ce PRR dans la réponse anti-tumorale. Dans cette revue, nous nous
intéresserons aux travaux montrant les nouvelles fonctions de la voie cGAS-STING dans la
détection des stress génotoxiques et dans le contrôle de la progression tumorale. |
La voie cGAS-STING, une barrière anti-tumorale L’immunosurveillance des cellules cancéreuses Il existe une relation étroite entre les cellules cancéreuses et le système
immunitaire. Un modèle propose que ce dernier détermine le destin des cellules
cancéreuses au cours de 3 étapes : « les 3 E » [ 5]. La première étape est dite
d’ élimination, car le système immunitaire reconnaît et
élimine les cellules aux premiers stades de la tumorigenèse. Lors de l’étape qui
la suit, l’étape dite d’ équilibre, le système immunitaire
jugule les cellules tumorales qui, en réponse, s’adaptent continuellement à cet
environnement immunitaire. Certaines cellules cancéreuses échapperont à cette
surveillance, notamment en modifiant les antigènes qu’elles expriment.
Lorsqu’elles l’emportent sur le système immunitaire, tout en induisant un
microenvironnement fortement immunosuppresseur, on parle de l’étape
d’ échappement, qui correspond à la progression tumorale et
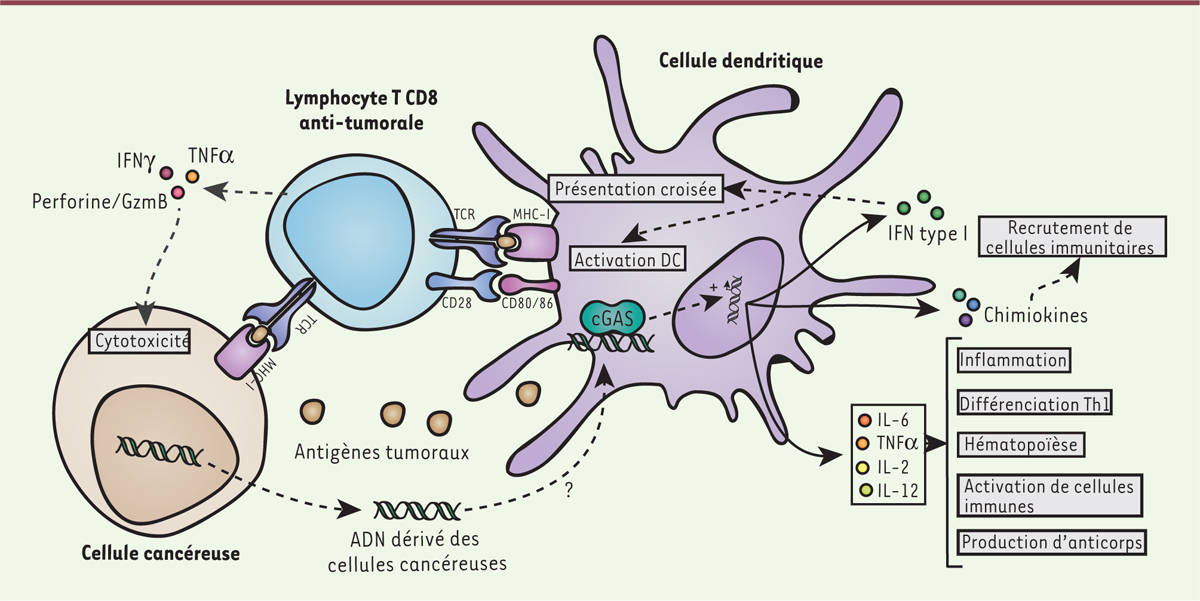
à l’apparition des métastases [ 5]. Les IFN-I jouent un rôle primordial dans l’activation de l’immunité
anti-tumorale. Ces IFN agissent sur les CPA (cellules présentatrices d’antigènes
[Ag]) en stimulant la présentation des Ag en association avec le complexe majeur
d’histocompatibilité de classe I (CMH-I). Des Ag produits par des cellules
tumorales, qui ont été phagocytées par les CPA, sont ainsi présentés, de façon
dite croisée, aux lymphocytes T CD8 cytotoxiques (LTC). La reconnaissance des Ag
par les LTC induit leur activation et conduit à la sécrétion de cytokines dont
le TNF-α (tumor necrosis alpha), de perforines et de granzyme
B, qui agiront de concert pour détruire la cellule cible tumorale. La capture
d’ADN tumoral par des APC, comme les DC (cellules dendritiques), activent la
voie cGAS-STING et induit la production d’IFN-I et de cytokines, comme
l’interleukine 12 (IL-12), ainsi que l’expression de molécules de costimulation,
telles que CD40, CD80 (ou B7.1) et CD86 (ou B7.2), et de facteurs qui sont
nécessaires à l’activation des lymphocytes T CD8 [6–9] (Figure
2). La stimulation des DC par des cellules tumorales
irradiées induit ainsi la présentation croisée d’Ag tumoraux et la stimulation
de lymphocytes T CD8 naïfs. Cet effet est perdu chez des souris qui n’expriment
pas STING, suggérant que l’absence de STING diminue l’immunité
anti-tumorale [7, 10].
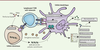 | Figure 2. cGAS et immunité anti-tumorale. L’activation de cGAS dans les
cellules immunitaires conduit à la production de cytokines
proinflammatoires et d’IFN-I indispensables à la mise en place de
réponses immunitaires spécifiques telles que la présentation croisée
des antigènes tumoraux, l’inflammation, la différenciation des
lymphocytes Th1, l’activation des cellules immunitaires et la
production d’anticorps ainsi qu’à une stimulation de l’hématopoïèse.
Des chimiokines sont également produites et permettent le
recrutement de cellules immunitaires. DC : cellule dendritique ;
GzmB : granzyme B ; MHC-I : complexe majeur d’histocompatibilité de
type I ; TCR : T cell receptor. |
À l’inverse, le traitement de souris par cGAMP, ou un ligand synthétique de
STING, stimule l’immunité anti-tumorale et réduit la croissance de la tumeur
[7, 10, 11] en
induisant une immunité adaptative mémoire [12]. Le traitement par cGAMP, combiné à la
stimulation du TLR4 par du LPS, permet également d’activer NLRP3
(NOD-like receptor family, pyrin domain-containing 3), un
PRR cytosolique senseur de danger [13]. Cela conduit à la formation de
l’inflammasome, complexe contrôlant l’activation de la caspase 1, à l’origine de
la pyroptose, une forme de mort cellulaire, et à la production d’IL-1β et
d’IL-18, qui contribuent à la mise en place d’une immunité anti-tumorale. L’immunothérapie est une stratégie thérapeutique anti-tumorale qui vise à bloquer
les points de contrôle inhibiteurs (comme PD-1 [programmed death
1] ou CTLA4 [cytotoxic-T-lymphocyte-antigen 4
protein]) exprimés par les cellules immunitaires, afin de restaurer
leur capacité à détruire les cellules cancéreuses. Dans un modèle murin de
mélanome, l’inactivation génétique de la voie cGAS-STING diminue drastiquement
l’efficacité de l’immunothérapie, se traduisant par un recrutement inefficace
des LTC dans les tumeurs [9, 10, 14]. cGAS et STING apparaissent donc essentiels au
développement d’une immunité anti-tumorale efficace. Mais quelle est la source d’ADN endogène capable d’activer cGAS dans un contexte
tumoral ? Au sein du microenvironnement tumoral, les cellules cancéreuses sont exposées à
des stress hypoxiques, mécaniques et métaboliques qui peuvent conduire à leur
mort. La mort des cellules cancéreuses peut également avoir pour origine les
thérapies appliquées (chimiothérapie, radiothérapie). Les cellules mourantes
libèrent alors des composants qui sont reconnus par les PRR comme des signaux de
danger (les DAMP), en particulier leur ADN. L’ADN tumoral est capté par des APC,
comme les DC, dans lesquelles il induit l’activation de cGAS. Dans les contextes
infectieux, cGAS peut être activé par un ADN microbien qui peut être contenu
dans des vésicules extracellulaires produites par les cellules infectées [15, 16]. Les cellules cancéreuses
libèrent également ce type de vésicules. Les exosomes, qui sont de petites
vésicules membranaires, contiennent en effet des acides nucléiques et des
protéines issus des cellules. Il est donc possible que cGAS puisse être activé
par ce biais [17], mais
les mécanismes moléculaires par lesquels l’ADN tumoral capté par les DC atteint
le cytosol de ces cellules restent à définir. Activation intrinsèque de cGAS-STING par les dommages à l’ADN L’instabilité génétique est un élément important du développement tumoral [ 18]. Une cellule normale
possède différents programmes impliqués dans le maintien de l’intégrité de son
génome : les voies de réparation de l’ADN, l’arrêt du cycle cellulaire et, si
les dommages sont trop importants, l’induction de l’apoptose ou de la
sénescence. Lorsque les gènes impliqués dans ces processus de sauvegarde sont
mutés ou inactivés, les cellules prolifèrent malgré la présence de dommages sur
leur ADN, entraînant alors plus de dommages et l’accumulation de mutations, et,
in fine, la transformation de la cellule. Les agents
génotoxiques, comme les irradiations ou les chimiothérapies, induisent la
production d’IFN-I et de cytokines proinflammatoires, suggérant un rôle de la
voie cGAS dans la détection des dommages à l’ADN [ 19, 20]. Les senseurs d’ADN, comme l’est cGAS, constituent donc un
mécanisme permettant de détecter l’ADN endommagé et d’empêcher l’initiation
tumorale. La radiothérapie et la chimiothérapie, qui reposent sur l’induction de
dommage à l’ADN dans le but de tuer les cellules cancéreuses, activent la voie
cGAS [21, 22] et plusieurs études
ont montré que des dysfonctionnements dans les voies de réparation de l’ADN
résultaient en l’activation de cGAS (Figure 3). Ainsi, la perte de fonction, par mutation ou
par invalidation, d’ATM (ataxia telangiectasia mutated), un
régulateur clé de la signalisation contrôlant les voies de réparation de l’ADN,
induit la production d’IFN-I via la voie cGAS-STING, in
vitro et in vivo [23, 24]. La perte de Rad51 et de RPA (replication
protein A), deux protéines majeures de la réparation d’ADN, conduit
également à l’activation de cGAS, in vivo et in
vitro dans des modèles cellulaires de cancers ovariens et mammaires
[25]. En situation
physiologique, lorsque l’ADN est répliqué ou réparé, de l’ADN simple brin est
généré et est lié à ces protéines. Leur délétion induit donc l’accumulation de
cet ADN et son passage vers le cytosol. STING peut également détecter les
dommages, indépendamment de cGAS, en formant un complexe avec p53 et IFI16
lorsque la voie ATM est activée [26].
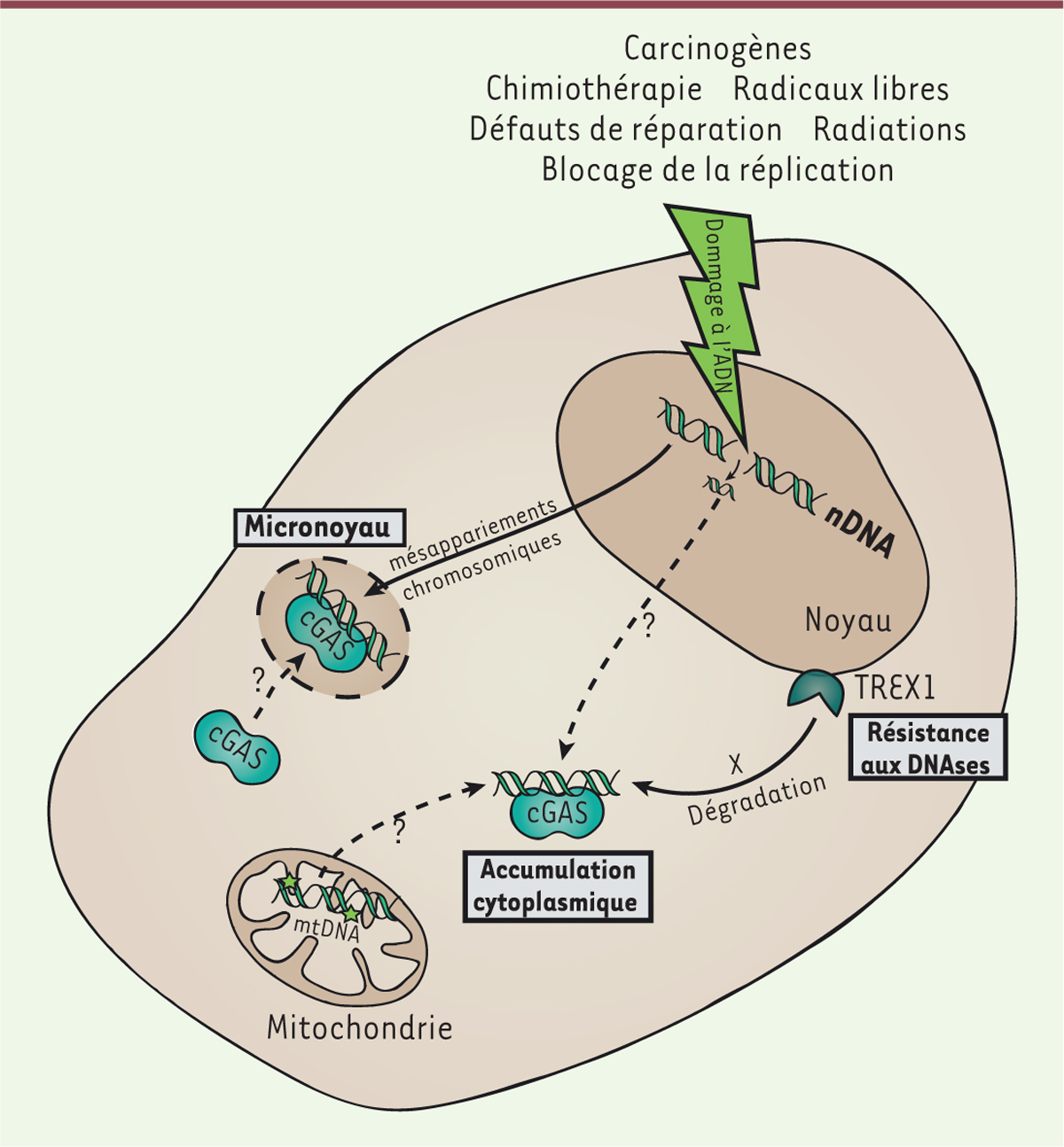
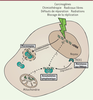 | Figure 3. Reconnaissance d’ADN endogène dans les cellules cancéreuses par cGAS.
Les cellules cancéreuses accumulent une instabilité génomique du
fait de réparation inefficace et de dommages récurrents de leur ADN.
Ceci peut conduire à l’accumulation d’ADN dans le cytoplasme et
activer cGAS. Les dommages peuvent également engendrer une mauvaise
séparation de l’ADN durant la division cellulaire résultant en la
formation de micronoyaux, qui sont également reconnus par cGAS.
Certains dommages à l’ADN, en induisant des modifications sur les
bases, confèrent une résistance aux DNAses et favorisent
l’accumulation cytoplasmique d’ADN. nDNA : ADN nucléaire ; mtDNA :
ADN mitochondrial. |
De nombreuses mutations affectant les voies de réparation de l’ADN conduisent à
une accumulation cytoplasmique d’ADN nucléaire dans plusieurs modèles de
cellules cancéreuses. Cet ADN provient de l’activité de facteurs impliqués dans
la résection de l’ADN, comme BLM (Bloom helicase) ou EXO1
(exonuclease 1), dont la sous-expression réduit
l’accumulation dans le cytoplasme [27–29]. Lors de dommages à l’ADN, le clivage par l’endonucléase MUS81
au niveau des fourches de réplication combiné à l’activation de la PARP1
(poly[ADP-ribose] polymerase 1, une enzyme impliquée dans
la détection des cassures d’ADN) sont responsables de l’accumulation d’ADN
nucléaire au niveau du cytoplasme et de l’activation de STING [27]. L’ADN mitochondrial endommagé en
réponse à un stress métabolique peut également fuiter vers le cytoplasme [30, 31]. Les cellules cancéreuses ont
une forte demande métabolique. Elles sont également plus sujettes à un stress
métabolique. Une fuite d’ADN mitochondrial pourrait donc contribuer à
l’activation de cGAS, bien qu’aucune étude n’ait adressé cette question à ce
jour. En situation physiologique, l’ADN qui atteint le cytosol est généralement
immédiatement dégradé par des nucléases comme TREX1 (three prime repair
exonuclease 1). Néanmoins, étant donné le haut niveau de mutations
des cellules en cours de transformation ou déjà cancéreuses, la quantité d’ADN
cytosolique peut surpasser la capacité de TREX1 à le dégrader. Il n’est
également pas exclu que TREX1 puisse être inactivée par des
mutations, prévenant ainsi la dégradation de l’ADN dans le cytoplasme [32, 33]. Des modifications chimiques de
l’ADN (comme le 8-hydroxyguanosine1,)
induites par des carcinogènes peuvent aussi le protéger de la dégradation par
les nucléases cytoplasmiques, exacerbant ainsi son accumulation dans le
cytoplasme et donc, potentiellement, l’activation de cGAS [33]. Dans différents modèles tumoraux, de fortes doses
d’irradiations peuvent induire l’expression de TREX1, celle-ci
inhibant les effets systémiques de la radiothérapie combinée à l’immunothérapie,
en empêchant la production d’IFN-I [34]. Les télomères constituent les extrémités des chromosomes. Ils se raccourcissent
au cours des divisions cellulaires conduisant les cellules vers la sénescence.
Les cellules cancéreuses échappent à ce mécanisme de raccourcissement par des
mécanismes de recombinaison homologue. Elles maintiennent ainsi leurs télomères,
ce qui leur permet une prolifération illimitée et l’échappement à la sénescence.
Dans ces cellules, l’accumulation de séquences, les ECTR
(extrachromosomal telomere repeats), nécessaires pour le
maintien des télomères a été décrite. Ces séquences s’accumulent, notamment dans
le cytoplasme. Elles sont également capables d’activer cGAS-STING, soulignant,
encore une fois, le rôle de cette voie dans la détection des cellules
cancéreuses [35]. Malgré toutes ces études montrant une accumulation d’ADN au niveau du cytoplasme,
les mécanismes par lesquels l’ADN nucléaire traverse l’enveloppe nucléaire sont
peu connus. cGAS rejoindrait l’ADN nucléaire lors de la mitose, mais le rôle de
cette localisation particulière reste encore inconnu [36]. Détection d’anomalies chromosomiques Les dommages à l’ADN peuvent conduire à la formation de structures chromosomiques
aberrantes au cours de la division cellulaire. Les cassures double brin,
associées à une réparation défectueuse, peuvent en effet conduire à une mauvaise
séparation des chromosomes lors de la mitose. Lorsque les cellules sortent de la
mitose, ces chromosomes, ou fragments d’ADN mal séparés, sont alors entourés
d’une enveloppe nucléaire formant un micronoyau qui est une caractéristique
fréquemment observée dans les cellules cancéreuses [ 37]. Deux études récentes ont montré que
cGAS était capable de reconnaître l’ADN présent dans ces micronoyaux [ 11, 36] (Figure
3). Dans des modèles cellulaires présentant un fort taux de
micronoyaux (les fibroblastes embryonnaires murins [MEF] déficients pour la
RNase H2 et pour le suppresseur de tumeur p53, et les cellules épithéliales
d’ostéosarcome) cGAS se localise dans ces structures nucléaires [ 36]. cGAS est également retrouvé associé
aux micronoyaux induits par irradiations de cellules épithéliales mammaires
[ 14, 38]. Dans les deux cas, cette localisation
de cGAS est à l’origine de l’activation de STING et de la mise en place d’une
réponse inflammatoire [ 36]. L’association
de cGAS avec les micronoyaux nécessite la progression du cycle cellulaire [ 14, 36] et la rupture mécanique de l’enveloppe nucléaire, qui précède
souvent des réarrangements chromosomiques massifs amenant à l’oncogenèse [ 36]. Le mécanisme permettant l’entrée de
cGAS dans les micronoyaux reste néanmoins mal défini. Activation des programmes de sauvegarde cellulaire La sénescence est un processus agissant comme une barrière à la tumorigenèse.
Elle promeut un état antiprolifératif en arrêtant de façon irréversible le cycle
cellulaire. cGAS joue un rôle important dans l’induction et le maintien du
processus de sénescence. Dans des modèles de fibroblastes murins et humains,
cGAS se localise à proximité de fragments chromatiniens situés à la frontière
entre noyau et cytosol. Des MEF déficients pour le gène codant cGAS
( cGAS
-/-) s’immortalisent spontanément et plus rapidement que les MEF qui
l’expriment. Les MEF cGAS
-/- échappent en fait à la sénescence [ 39– 41]. Ces cellules défectives expriment faiblement les
marqueurs de sénescence, tels que la β-galactosidase ou la protéine p16. Et la
sécrétion du SASP ( senescence-associated secretory phenotype),
un profil de sécrétion caractéristique des cellules senescentes constitué, entre
autres, d’IL-1a, d’IL-6, de TNFα et de chimiokines, comme CXCL10 ( C-X-C
motif chemokine ligand 10) stimulant le recrutement de cellules
immunitaires, y est altérée (Figure
4). cGAS est également essentiel pour induire la
sénescence en réponse à des stress génotoxiques ou à l’activation oncogénique
[ 39– 41]. cGAS semble donc fortement impliqué dans l’induction de la
sénescence in vitro. Il contribuerait aussi à la sénescence
paracrine en contrôlant le SASP. In vivo, des souris
déficientes pour STING ou cGAS et exposées à
des inducteurs de sénescence (par irradiations ou surexpression hépatique de
l’oncogène NRas) montrent une diminution des marqueurs de sénescence dans le
foie et les poumons [ 39, 40]. Les hépatocytes surexprimant
l’oncogène NRas persistent plus longtemps dans le foie des souris
cGAS -/-, suggérant un défaut d’élimination de ces cellules par le
système immunitaire, ce qui peut conduire à la génération de tumeurs [ 39, 40]. La sénescence dépendant de la voie cGAS-STING se révèle donc
être une importante barrière à la tumorigénèse in vivo.
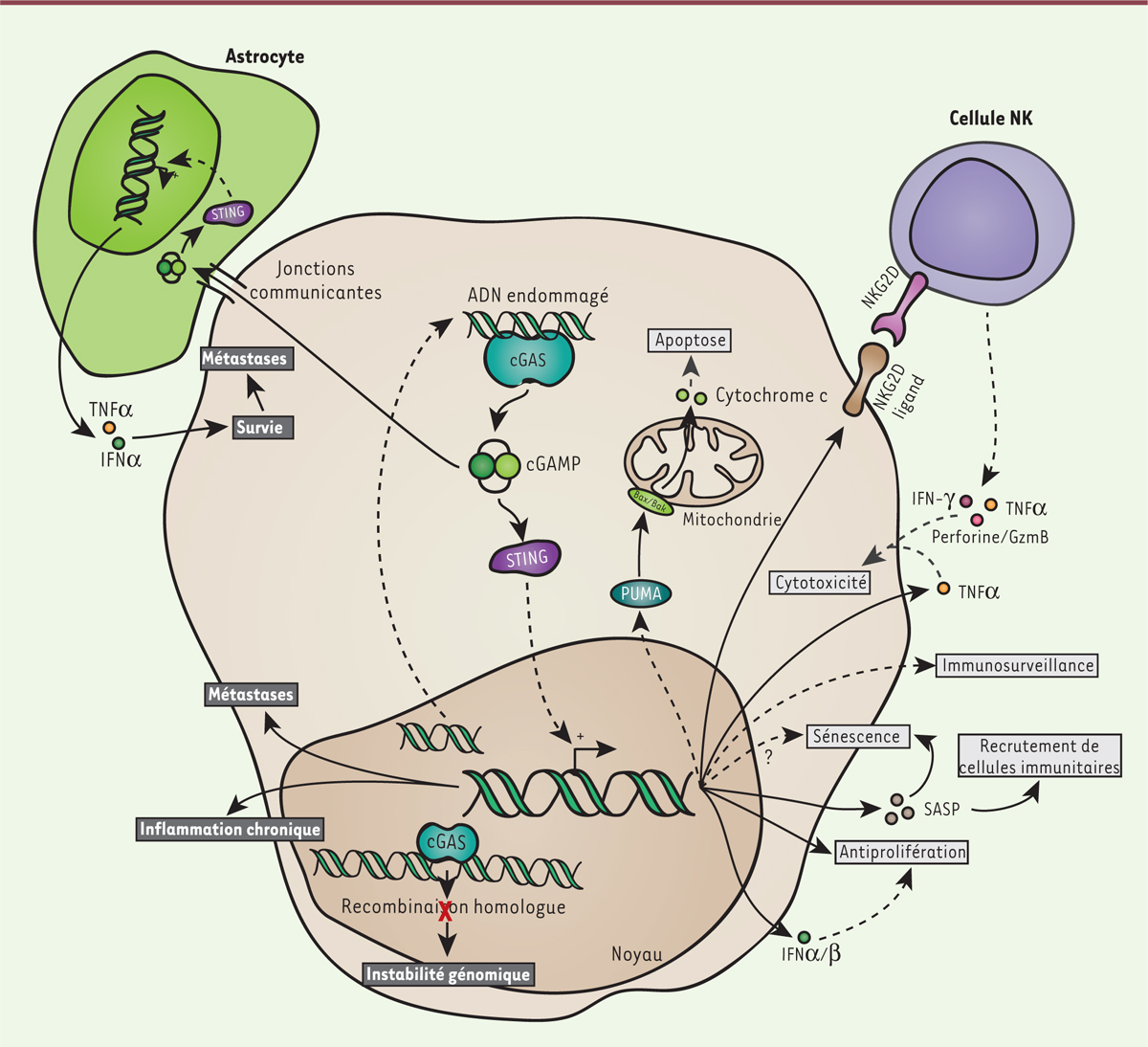
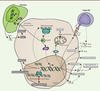 | Figure 4. Dualité des réponses tumorales reposant sur cGAS-STING. L’activation
de cGAS dans les cellules en cours de transformation induit
différentes réponses antitumorales comme la mise en place d’une
réponse immunitaire anti-tumorale. La voie conduit également à
l’expression de NKG2D qui induit la reconnaissance des cellules
cancéreuses par les cellules NK (natural killer)
causant une mort cellulaire ciblée des cellules cancéreuses. La
production de SASP par cGAS induit un état de sénescence.
L’activation de STING induit l’apoptose. L’activation continue de
cGAS peut induire une tumorigenèse liée à une inflammation
chronique. Cette voie peut également contribuer à une augmentation
de l’instabilité génomique en inhibant les voies de réponses aux
dommages à l’ADN. Elle peut enfin favoriser l’apparition de
métastases. GzmB : granzyme B ; NKG2D : natural killer group
2D ; SASP : senescence-associated secretory
phenotype ; PUMA : Bcl-2 binding component
3. |
L’étude de STING dans d’autres modèles cellulaires a révélé son effet
anti-prolifératif indépendamment de son rôle sur la stimulation des IFN de type
I [42, 43]. Dans les lymphocytes T, son
activation par un agoniste induit l’apoptose des cellules par une voie
impliquant les facteurs IRF-3 et p53 ; elle serait liée à une stimulation
prolongée de cette voie [43]. Cette
réponse apoptotique est maintenue dans les lymphomes T, ouvrant des perspectives
thérapeutiques intéressantes pour les agonistes de STING. Un autre mécanisme de sauvegarde impliquant STING a également été mis en
évidence. L’activation de STING, à la suite de dommages à l’ADN, induit
l’expression de ligands à la surface des cellules, reconnus par les récepteurs
NKG2D (natural killer group 2D) [44, 45] exprimés par les cellules NK, ce qui induit leur mort
par des mécanismes similaires à ceux utilisés par les LTC. |
cGAS-STING, une épée à double tranchant ? Bien que les fonctions anti-tumorales de la voie cGAS soient de mieux en mieux
documentées, des études récentes montrent que cette voie pourrait en réalité être
une épée à double tranchant, en jouant un rôle pro-tumoral par une action directe
sur la tumorigenèse. Le DMBA (7,12-diméthylbenzène[a]anthracène) est un carcinogène connu pour induire,
chez la souris, des tumeurs cutanées dépendant d’une inflammation chronique. Dans
des cultures in vitro de fibroblastes murins ou de kératinocytes
humains, le DMBA induit une accumulation d’ADN dans le cytoplasme des cellules et
une forte production de cytokines inflammatoires et d’IFN-I. Cette induction est
strictement dépendante de cGAS et de STING, suggérant un rôle de cette voie dans la
carcinogenèse cutanée. In vivo, le traitement de souris déficientes
pour STING, ou de souris chimériques ayant reçu des cellules de
moelle osseuse provenant de souris STING
-/- par le DMBA n’induit pas d’inflammation cutanée et de tumeurs,
soulignant le rôle de cGAS/STING dans la tumorigenèse induite par l’inflammation
chez la souris [46]. cGAS pourrait également jouer un rôle dans l’initiation de la tumorigénèse en
inhibant les voies de réparations de l’ADN, augmentant ainsi l’instabilité
génomique. Liu et al. ont en effet montré une translocation
nucléaire de cGAS au niveau des cassures double brin. cGAS interagit avec PARP1,
empêchant la recombinaison homologue (RH) qui en dépend. In vitro
et in vivo, la déplétion de cGAS favorise ainsi la réparation de
l’ADN par RH et réduit la croissance de la masse tumorale pulmonaire, in
vivo [47]. En
plus de ce rôle potentiel dans l’initiation tumorale, cGAS pourrait être impliqué
dans la progression tumorale en contribuant à la formation de métastases.
L’instabilité chromosomique, notamment la formation de micronoyaux et l’accumulation
d’ADN cytoplasmique, engage la voie STING et active la voie non canonique de NF-κB
impliquée dans l’invasion et la formation de métastases cérébrales, mammaires et
ganglionnaires [48]. cGAS
peut également avoir des effets paracrines néfastes. Par le biais des jonctions
communicantes, les cellules cancéreuses mammaires ou pulmonaires délivrent le cGAMP
qu’elles produisent aux astrocytes où il activera STING, à l’origine de la sécrétion
de facteurs de survie pour les cellules métastatiques, favorisant ainsi
l’établissement de métastases cérébrales [49]. |
Conclusion et perspectives Les senseurs d’ADN et leur rôle dans le cancer représentent un champ
de recherche émergeant, en particulier à la suite de la découverte récente du rôle
de cGAS en tant que détecteur ubiquitaire d’ADN cytosolique. La voie impliquant cGAS
est bien décrite pour la détection de pathogènes et l’induction d’une immunité
antimicrobienne. Nous donnons ici une nouvelle vision du rôle de cGAS comme
détecteur d’ADN dans la surveillance des tumeurs et l’induction d’une réponse
anti-tumorale par la mise en place d’une réponse immunitaire, l’induction de la mort
cellulaire et l’inhibition de la prolifération. La voie cGAS-STING façonne le
microenvironnement tumoral et alerte l’organisme des dommages qui s’accumulent à
l’intérieur des cellules. Considérant son rôle anti-tumoral, la voie cGAS-STING pourrait être exploitée en
thérapie contre le cancer. Des agonistes de cGAS ou de STING ont montré des effets
thérapeutiques dans différents modèles murins tumoraux, tels que des mélanomes, des
tumeurs du côlon, de la prostate, du sein, et des fibrosarcomes, en recrutant des
lymphocytes T CD8 antitumoraux. De nouvelles possibilités d’utilisation des
agonistes de cette voie s’ouvrent donc, comme adjuvants de la radiothérapie, de la
chimiothérapie et de l’immunothérapie [10,
50]. Des approches
innovantes, telles que des particules virales contenant cGAMP, offrent également des
perspectives thérapeutiques intéressantes afin d’induire la voie de façon ciblée
dans les tumeurs [51]. Il n’est cependant pas surprenant que les cellules cancéreuses échappent à cette voie
de signalisation, ce qui peut rendre cette approche thérapeutique difficile à
appliquer. Chez l’homme, dans des adénocarcinomes du côlon, et dans des modèles de
mélanomes, l’expression de cGAS ou STING est diminuée par l’hyperméthylation de
leurs promoteurs. La voie de signalisation est également perturbée en raison de la
séquestration de STING au niveau du réticulum endoplasmique [52, 53]. De même, les tumeurs fortement hypoxiques répriment cGAS
par l’induction de microARN régulateurs [54]. Pour les cancers viro-induits, la protéine E6 du
papillomavirus humain et la protéine E1A des adénovirus inhibent cGAS, bloquant
ainsi la réponse antivirale et promouvant l’oncogenèse virale [55]. Néanmoins, l’invalidation de la
voie cGAS-STING dans les cellules cancéreuses offre une opportunité de cibler ces
cellules via des thérapies utilisant des virus oncolytiques [53]. Dans cette revue, nous avons décrit les activités anti-tumorales de cGAS. La biologie
apparaît cependant beaucoup plus complexe. En effet, cette voie se révèle être de
plus en plus une épée à double tranchant, les preuves que cGAS pourrait avoir des
activités pro-tumorales s’accumulant. Ces fonctions pro-tumorales doivent donc être
prises en compte lors de la conception de protocoles thérapeutiques visant à activer
la voie cGAS-STING. Une meilleure connaissance dans la manière dont cGAS détecte
l’ADN endommagé des tumeurs, ainsi que les réponses tumorales passant par son
activation, sont nécessaires afin d’envisager de telles thérapies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Les auteurs remercient Marie-Cécile Michallet et Baptiste Guey pour la relecture du
manuscrit.
|
Footnotes |
1. Pandey
S,
Kawai
T,
Akira
S. Microbial sensing
by Toll-like receptors and intracellular nucleic acid
sensors . Cold Spring Harb Perspect Biol.
2015; ; 7 :
:a016246.. 2. Sun
L,
Wu
J,
Du
F, et al.
Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates
the type I interferon pathway . Science.
2013; ; 339 :
:786.–791. 3. Chen
Q,
Sun
L,
Chen
ZJ. Regulation and
function of the cGAS–STING pathway of cytosolic DNA sensing .
Nat Immunol.
2016; ; 17 :
:1142.–1149. 4. Crow
YJ,
Manel
N. Aicardi–Goutières
syndrome and the type I interferonopathies . Nat Rev
Immunol.
2015; ; 15 :
:429.–440. 5. Schreiber
RD,
Old
LJ,
Smyth
MJ. Cancer
Immunoediting: Integrating immunity’s roles in cancer suppression and
promotion . Science.
2011; ; 331 :
:1565.–1570. 6. Xu
MM,
Pu
Y,
Han
D, et al.
Dendritic cells but not macrophages sense tumor mitochondrial DNA
for cross-priming through signal regulatory protein α
signaling . Immunity.
2017; ; 47 :
:363.–73.e5. 7. Deng
L,
Liang
H,
Xu
M, et al.
STING-dependent cytosolic DNA sensing promotes radiation-induced
type i interferon-dependent antitumor immunity in immunogenic
tumors . Immunity.
2014; ; 41 :
:843.–852. 8. Klarquist
J,
Hennies
CM,
Lehn
MA, et al.
STING-mediated DNA sensing promotes antitumor and autoimmune
responses to dying cells . J Immunol.
2014; ; 193 :
:6124.–6134. 9. Woo
S-R,
Fuertes
MB,
Corrales
L, et al.
STING-dependent cytosolic DNA sensing mediates innate immune
recognition of immunogenic tumors . Immunity.
2014; ; 41 :
:830.–842. 10. Wang
H,
Hu
S,
Chen
X, et al.
cGAS is essential for the antitumor effect of immune checkpoint
blockade . Proc Natl Acad Sci USA.
2017; ; 114 :
:1637.–1642. 11. Li
T,
Cheng
H,
Yuan
H, et al.
Antitumor activity of cGAMP via stimulation of
cGAS-cGAMP-STING-IRF3 mediated innate immune response .
Sci Rep.
2016; ; 6 : :19049.. 12. Corrales
L,
Glickman
LH,
McWhirter
SM, et al.
Direct activation of STING in the tumor microenvironment leads to
potent and systemic tumor regression and immunity .
Cell Rep.
2015; ; 11 :
:1018.–1030. 13. Swanson
KV,
Junkins
RD,
Kurkjian
CJ, et al.
A noncanonical function of cGAMP in inflammasome priming and
activation . J Exp Med.
2017; ; 214 :
:3611.–3626. 14. Harding
SM,
Benci
JL,
Irianto
J, et al.
Mitotic progression following DNA damage enables pattern
recognition within micronuclei . Nature.
2017; ; 548 :
:466.–470. 15. Torralba
D,
Baixauli
F,
Villarroya-Beltri
C, et al.
Priming of dendritic cells by DNA-containing extracellular
vesicles from activated T cells through antigen-driven
contacts . Nat Commun.
2018; ; 9 : :2658.. 16. Sisquella
X,
Ofir-Birin
Y,
Pimentel
MA, et al.
Malaria parasite DNA-harbouring vesicles activate cytosolic
immune sensors . Nat Commun.
2017; ; 8 : :1985.. 17. Whiteside
TL. Tumor-derived
exosomes and their role in cancer progression . Adv
Clin Chem.
2016; ; 74 :
:103.–141. 18. Hanahan
D,
Weinberg
RA. Hallmarks of
cancer: The next generation . Cell.
2011; ; 144 :
:646.–674. 19. Burnette
BC,
Liang
H,
Lee
Y, et al.
The efficacy of radiotherapy relies upon induction of type I
interferon-dependent innate and adaptive immunity .
Cancer Res.
2011; ; 71 :
:2488.–2496. 20. Pauli
W,
Valkó
E. Zur Elektrochemie der
Kolloide. Kolloid-Zeitschrift.
1934; ; 66 :
:312.–316. 21. Pépin
G,
Nejad
C,
Thomas
BJ, et al.
Activation of cGAS-dependent antiviral responses by DNA
intercalating agents . Nucleic Acids Res.
2017; ; 45 :
:198.–205. 22. Wilkins
AC,
Patin
EC,
Harrington
KJ, et al.
The immunological consequences of radiation induced DNA
damage . J Pathol.
2019; ; 247 :
:606.–614. 23. Härtlova
A,
Erttmann
SF,
Raffi
FA, et al.
DNA damage primes the type I interferon system via the cytosolic
DNA sensor STING to promote anti-microbial innate immunity .
Immunity.
2015; ; 42 :
:332.–343. 24. Quek
H,
Luff
J,
Cheung
K, et al.
Rats with a missense mutation in Atm display neuroinflammation
and neurodegeneration subsequent to accumulation of cytosolic DNA following
unrepaired DNA damage . J Leukoc Biol.
2017; ; 101 :
:927.–947. 25. Wolf
C,
Rapp
A,
Berndt
N, et al.
RPA and Rad51 constitute a cell intrinsic mechanism to protect
the cytosol from self DNA . Nat Commun.
2016; ; 7 : :11752.. 26. Dunphy
G,
Flannery
SM,
Almine
JF, et al.
Non-canonical activation of the DNA sensing adaptor STING by ATM
and IFI16 mediates NF-κB signaling after nuclear DNA damage .
Mol Cell.
2018; ; 71 :
:745.–60.e5. 27. Ho
SSW,
Zhang
WYL,
Tan
NYJ, et al.
The DNA structure-specific endonuclease MUS81 mediates DNA sensor
STING-dependent host rejection of prostate cancer cells .
Immunity.
2016; ; 44 :
:1177.–1189. 28. Parkes
EE,
Walker
SM,
Taggart
LE, et al.
Activation of STING-dependent innate immune signaling by
S-phase-specific DNA damage in breast cancer . J Natl
Cancer Inst.
2017;; 109 :
:djw199.. 29. Erdal
E,
Haider
S,
Rehwinkel
J, et al.
A prosurvival DNA damage-induced cytoplasmic interferon response
is mediated by end resection factors and is limited by
Trex1 . Genes Dev.
2017; ; 31 :
:353.–369. 30. Carroll
EC,
Jin
L,
Mori
A, et al.
The vaccine adjuvant chitosan promotes cellular immunity via DNA
sensor cGAS-STING-dependent induction of type I interferons .
Immunity.
2016; ; 44 :
:597.–608. 31. West
AP,
Khoury-Hanold
W,
Staron
M, et al.
Mitochondrial DNA stress primes the antiviral innate immune
response . Nature.
2015; ; 520 :
:553.–557. 32. Wang
CJ,
Lam
W,
Bussom
S, et al.
TREX1 acts in degrading damaged DNA from drug-treated tumor
cells . DNA Repair (Amst).
2009; ; 8 : :1179.. 33. Gehrke
N,
Mertens
C,
Zillinger
T, et al.
Oxidative damage of DNA confers resistance to cytosolic nuclease
TREX1 degradation and potentiates STING-dependent immune
sensing . Immunity.
2013; ; 39 :
:482.–495. 34. Vanpouille-Box
C,
Alard
A,
Aryankalayil
MJ, et al.
DNA exonuclease Trex1 regulates radiotherapy-induced tumour
immunogenicity . Nat Commun.
2017; ; 8 : :15618.. 35. Chen
Y-A,
Shen
Y-L,
Hsia
H-Y, et al.
Extrachromosomal telomere repeat DNA is linked to ALT development
via cGAS-STING DNA sensing pathway . Nat Struct Mol
Biol.
2017; ; 24 :
:1124.–1131. 36. Mackenzie
KJ,
Carroll
P,
Martin
CA, et al.
cGAS surveillance of micronuclei links genome instability to
innate immunity . Nature.
2017; ; 548 :
:461.–465. 37. Fenech
M,
Kirsch-Volders
M,
Natarajan
AT, et al.
Molecular mechanisms of micronucleus, nucleoplasmic bridge and
nuclear bud formation in mammalian and human cells .
Mutagenesis.
2011; ; 26 :
:125.–132. 38. Mackenzie
KJ,
Carroll
P,
Lettice
L, et al.
Ribonuclease H2 mutations induce a cGAS/STING-dependent innate
immune response . EMBO J.
2016; ; 35 :
:831.–844. 39. Glück
S,
Guey
B,
Gulen
MF, et al.
Innate immune sensing of cytosolic chromatin fragments through
cGAS promotes senescence . Nat Cell Biol.
2017; ; 19 :
:1061.–1070. 40. Dou
Z,
Ghosh
K,
Vizioli
MG, et al.
Cytoplasmic chromatin triggers inflammation in senescence and
cancer . Nature.
2017; ; 550 :
:402.–406. 41. Yang
H,
Wang
H,
Ren
J, et al.
cGAS is essential for cellular senescence .
Proc Natl Acad Sci USA.
2017; ; 114 :
:E4612.–E4620. 42. Cerboni
S,
Jeremiah
N,
Gentili
M, et al.
Intrinsic antiproliferative activity of the innate sensor STING
in T lymphocytes . J Exp Med.
2017; ; 214 :
:1769.–1785. 43. Gulen
MF,
Koch
U,
Haag
SM, et al.
Signalling strength determines proapoptotic functions of
STING . Nat Commun.
2017; ; 8 : :427.. 44. Gasser
S,
Orsulic
S,
Brown
EJ, et al.
The DNA damage pathway regulates innate immune system ligands of
the NKG2D receptor . Nature.
2005; ; 436 :
:1186.–1190. 45. Lam
AR,
Le
Bert N,
Ho
SSW, et al.
RAE1 ligands for the NKG2D receptor are regulated by
STING-dependent DNA sensor pathways in lymphoma .
Cancer Res.
2014; ; 74 :
:2193.–2203. 46. Ahn
J,
Xia
T,
Konno
H, et al.
Inflammation-driven carcinogenesis is mediated through
STING . Nat Commun.
2014; ; 5 : :5166.. 47. Liu
H,
Zhang
H,
Wu
X, et al.
Nuclear cGAS suppresses DNA repair and promotes
tumorigenesis . Nature.
2018; ; 563 :
:131.–136. 48. Bakhoum
SF,
Ngo
B,
Laughney
AM, et al.
Chromosomal instability drives metastasis through a cytosolic DNA
response . Nature.
2018; ; 553 :
:467.–472. 49. Chen
Q,
Boire
A,
Jin
X, et al.
Carcinoma-astrocyte gap junctions promote brain metastasis by
cGAMP transfer . Nature.
2016; ; 533 :
:493.–498. 50. Baird
JR,
Friedman
D,
Cottam
B, et al.
Radiotherapy combined with novel STING-targeting oligonucleotides
results in regression of established tumors . Cancer
Res.
2016; ; 76 :
:50.–61. 51. Gentili
M,
Kowal
J,
Tkach
M, et al.
Transmission of innate immune signaling by packaging of cGAMP in
viral particles . Science.
2015; ; 349 :
:1232.–1236. 52. Xia
T,
Konno
H,
Barber
GN. Recurrent loss
of STING signaling in melanoma correlates with susceptibility to viral
oncolysis . Cancer Res.
2016; ; 76 :
:6747.–6759. 53. Xia
T,
Konno
H,
Ahn
J, et al.
Deregulation of STING signaling in colorectal carcinoma
constrains DNA damage responses and correlates with
tumorigenesis . Cell Rep.
2016; ; 14 :
:282.–297. 54. Wu
MZ,
Cheng
WC,
Chen
SF, et al.
miR-25/93 mediates hypoxia-induced immunosuppression by
repressing cGAS . Nat Cell Biol.
2017; ; 19 :
:1286.–1296. 55. Lau
L,
Gray
EE,
Brunette
RL, et al.
DNA tumor virus oncogenes antagonize the cGAS-STING DNA-sensing
pathway . Science.
2015; ; 350 :
:568.–571. 56. Lebon
P,
Crow
YJ,
Casanova
JL,
Gresser
I. Conséquences
pathologiques d’un excès d’interféron in vivo. Comment ne pas sous- estimer
des expériences in vivo quand elles peuvent paraître anecdotiques et non
conformistes . Med Sci (Paris).
2019; ; 35 :
:232.–235. |