| |
| Med Sci (Paris). 35(6-7): 535–543. doi: 10.1051/medsci/2019093.Instabilité des microsatellites et
cancer De l’instabilité du génome à la médecine
personnalisée Ada Collura,1* Jérémie H. Lefevre,1,2 Magali Svrcek,1,3 David Tougeron,4 Aziz Zaanan,5 and Alex Duval1 1Sorbonne Université, UPMC Univ Paris 06, Inserm, UMRS 938,
Équipe Instabilité des microsatellites et cancer, Centre de recherche Saint
Antoine, 75012Paris,
FranceÉquipe labellisée par la Ligue nationale ontre le cancer et SIRIC
CURAMUS, APHP.6 2Sorbonne Université, Department of Digestive Surgery, AP-HP,
Hôpital Saint-Antoine, F-75012, Paris, France 3AP-HP, Service d’anatomie et cytologie
pathologiques, 75012Paris,
France 4Département d’hépatogastroentérologie, Hôpital universitaire
de Poitiers, 86021Poitiers,
France 5Département de gastroentérologie et oncologie digestive,
Hôpital Européen George Pompidou, APHP, 75015Paris,
France |
Vignette (Photo @ Inserm - Julio C. Valencia). La découverte d’un lien entre la survenue de certains cancers et l’existence d’anomalies
du système de réparation des erreurs de réplication de l’ADN (système MMR pour
mismatch repair) a ouvert, il y a 25 ans, de nouveaux horizons dans
l’étude de la génétique des tumeurs chez l’homme [1]. Dans ces tumeurs, l’inactivation du système MMR est
systématiquement observée et conduit à un phénotype d’hyperinstabilité de l’ADN à
l’échelle du nucléotide. En d’autres termes, la séquence d’ADN tumoral est fréquemment
remaniée par des mutations somatiques ponctuelles en nombre. Ces remaniements affectent
en premier lieu des séquences répétées du génome, appelées microsatellites, avec des
insertions/délétions mono ou dinucléotidiques à l’origine de cancers MSI (microsatellite
instable), sans autre réarrangement génomique majeur (pas d’instabilité chromosomique ou
à un taux faible, comparé à ce qui est observé dans d’autres types tumoraux) [2]. Les cancers MSI sont fréquents chez l’homme. Ils peuvent être héréditaires, intégrés dans
le cadre du syndrome de Lynch, ou cancer colorectal héréditaire sans polypose (1/3 des
cas environ), favorisés du fait de mutations constitutionnelles hétérozygotes d’un des
gènes codant les protéines majeures du système MMR : MLH(mutL homolog
human)1,2, puis MSH6 (MutS homolog human
6) et PMS2 (postmeiotic segregation increased
2) (par ordre de fréquence)1 [3]. Le syndrome de Lynch représente
une des prédispositions au cancer les plus fréquentes chez l’homme. Dans ce syndrome,
les patients peuvent développer différents types de tumeurs (côlon, estomac, endomètre,
voies biliaires, rein, uretères, pancréas, lymphomes, leucémies, etc.), le plus souvent
à un âge jeune (avant 60 ans). Une variante plus sévère de ce syndrome a été récemment
rapportée. Appelé syndrome CMMRD (pour constitutive MMR-deficiency
syndrome), il concerne des patients ayant des mutations germinales
bi-alléliques d’un des gènes du système MMR (par ordre de fréquence : PMS2,
MSH6, puis MLH1, MSH2), entraînant l’émergence de tumeurs MSI dès l’enfance
avec, en particulier, des leucémies, des lymphomes, des cancers du côlon et des tumeurs
cérébrales d’une particulière gravité sur un plan pronostique [4]. Les cancers MSI demeurent néanmoins dans leur
majorité de survenue sporadique (dans deux tiers des cas environ), sans agrégation
familiale. Au total, un phénotype MSI est rencontré dans 10 à 15 % de certaines tumeurs
épithéliales (cancers colorectaux, de l’estomac, de l’endomètre), et dans une proportion
faible à très faible (1 à 5 %) de nombreux autres cancers, en grande majorité des
adénocarcinomes, sans d’ailleurs que nous ayons encore aujourd’hui une vision globale
totalement arrêtée de leur spectre clinique (cancer de la prostate, du rein, du poumon,
de l’ovaire, de la tête et du cou, du foie, de la vessie, glioblastomes, gliomes
cérébraux de bas grade, cancer du sein, etc.) [5]. Dans cette revue, nous présentons une synthèse des travaux dédiés à l’étude des cancers
MSI. Ces travaux ont été menés par des chercheurs et médecins qui ont consacré toute ou
une partie de leur activité à ces tumeurs durant ces 20 dernières années. Ils ont trait
à la mise au point de méthodes diagnostiques ayant permis d’identifier ce phénotype
tumoral chez l’homme, à la mise en évidence de facteurs de risque favorisant leur
émergence dans la population, à la caractérisation de mécanismes physiopathologiques
sous-jacents impliqués dans l’initiation et la progression tumorale MSI, à
l’identification de marqueurs d’intérêt pronostique ou même théranostique dans ces
cancers, ou encore à l’étude de l’impact des MSI sur la réponse à la chimiothérapie
(Figure 1). Ces travaux,
résumés ici2, donnent un aperçu de la recherche
nationale sur ce type tumoral. Ils ont été soutenus par la Fondation de France qui a
récompensé chacun de ces chercheurs en leur attribuant le prix Jean et Madeleine
Schaeverbeke.
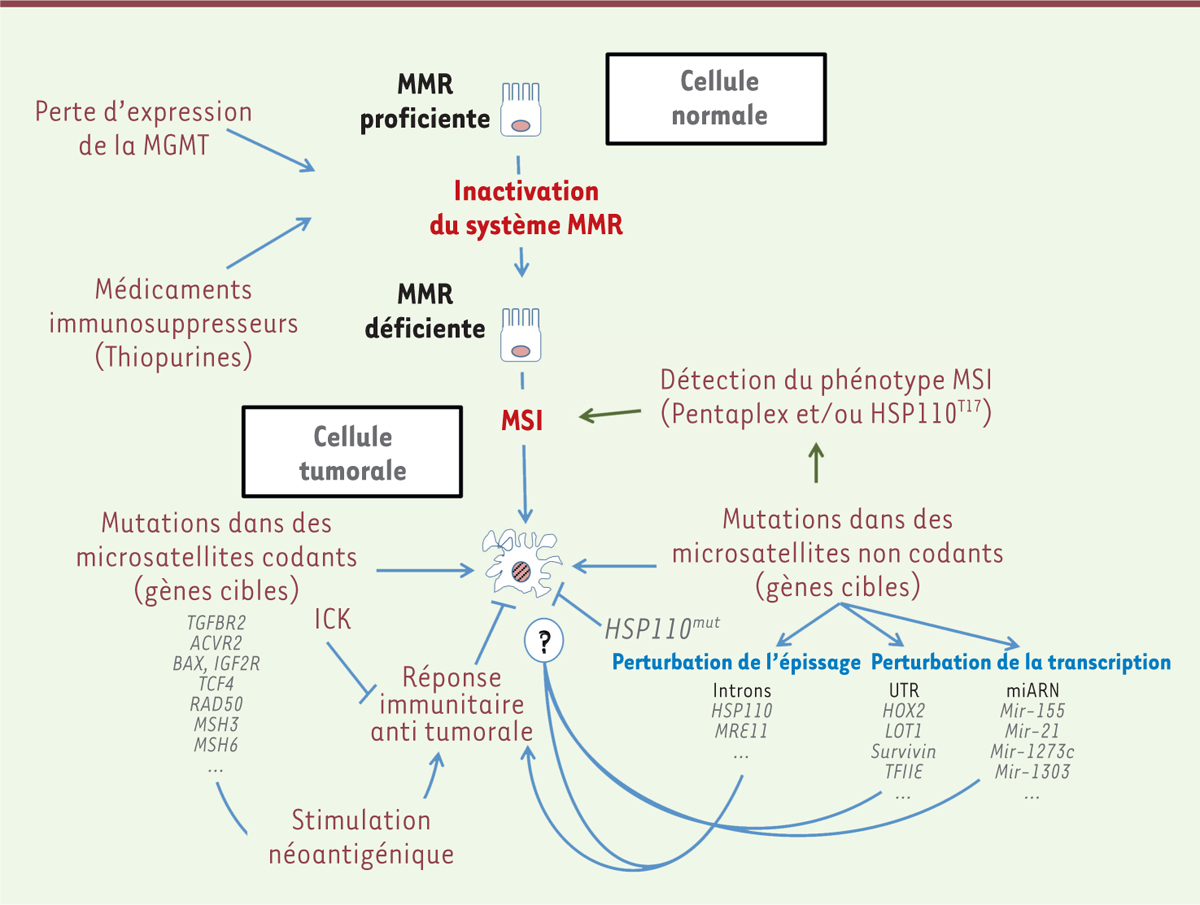
 | Figure 1. Étapes de la tumorigenèse MSI. MSI : instabilité des microsatellites ; ICK :
intestinal cell kinase. |
|
Diagnostic du phénotype MSI dans les tumeurs Le phénotype MSI d’une tumeur est aujourd’hui très fréquemment recherché chez les
patients présentant un cancer colorectal (CCR)3. Cet examen est de plus en plus recommandé pour d’autres types tumoraux
(voir plus haut, le spectre des tumeurs MSI). L’intérêt de la mise en évidence d’un
tel phénotype dans un cancer est double. Il permet d’une part d’identifier, ou de
contribuer à identifier, les patients à risque pour le syndrome de Lynch et le CMMRD
(tumeurs MSI héréditaires). Il représente d’autre part, et notamment à un stade
métastatique, un critère d’orientation thérapeutique puisque les patients présentant
un cancer MSI métastatique sont désormais candidats pour être traités par de
nouvelles thérapies (blocage des points de contrôle immunitaire par immunothérapie
par anticorps anti-PD-1 [programmed death-1], anti-CTLA-4
[cytotoxic T-lymphocyte associated protein 4], ou autres ; voir
ci-dessous pour plus de détails) [6]. Certains auteurs de cette revue ont contribué à la mise au point de
méthodes de référence utilisées aujourd’hui en routine à l’international pour
identifier le statut MSI à partir de l’ADN tumoral. Il s’agit en particulier du test
Pentaplex® qui repose sur la co-amplification de 5 marqueurs
microsatellites dans l’ADN tumoral et permet d’identifier de manière simple,
sensible et spécifique, le phénotype MSI d’une tumeur : ces marqueurs sont en effet
très stables dans les ADN normaux et quasi-systématiquement instables dans les ADN
tumoraux de cellules déficientes en MMR [7, 8].
Ces méthodes ont fait l’objet de simplifications ultérieures [9]. L’avenir est à leur potentialisation afin de
permettre la détection du phénotype MSI directement à partir du sang des patients
(détection d’ADN tumoral circulant sans nécessité d’un accès direct à la tumeur), ce
qui présente un intérêt en cas de patients métastatiques non opérables ou pour le
suivi de la maladie résiduelle après traitement. Cette détection dans le sang
périphérique a également un intérêt pour l’évaluation de MSI dans les tissus sains
de patients prédisposés à ce type de cancer (patients atteints de syndrome de Lynch
ou de CMMRD) puisqu’il a été rapporté que ces malades pouvaient présenter un bruit
de fond d’instabilité microsatellitaire dans certains tissus, avant même la survenue
de cancer, chez eux ou leurs apparentés [10]. Aujourd’hui, les CCR sont systématiquement examinés4 pour le statut MSI à partir d’une analyse de l’ADN tumoral par ces
méthodes de référence. Plusieurs études ont exploité ces méthodes afin d’identifier
en particulier les patients souffrant de syndrome de Lynch, prédisposés à la
survenue de CCR MSI héréditaires. Une série de 1 040 cas de CCR réséqués entre 2005
et 2009 a ainsi pu être analysée. Cent-cinq tumeurs présentaient une perte
d’expression protéique du système MMR et/ou une instabilité microsatellitaire. Plus
d’un tiers des syndromes de Lynch confirmés (avec mise en évidence d’une mutation
germinale MMR) ne présentaient aucun signe clinique évocateur d’une prédisposition
familiale et n’auraient donc pas été identifiés sans cette recherche systématique du
phénotype MSI sur l’ADN tumoral [11]. Cette très large étude montre ainsi qu’il est crucial de proposer
systématiquement un examen du statut MSI sur l’ADN tumoral chez les patients
présentant un CCR afin de repérer ceux qui, parmi eux, sont atteints de syndrome de
Lynch et donc prédisposés au développement de néoplasies MSI familiales. |
Identification de contextes cliniques et de facteurs de risques favorisant la
déficience MMR En dehors d’une prédisposition héréditaire liée à l’existence d’une mutation
germinale MMR hétérozygote (syndrome de Lynch) ou homozygote (CMMRD), l’émergence de
tumeurs MSI peut être favorisée dans certains contextes cliniques, par des
mécanismes bien spécifiques. Nous avons pu en effet montrer la survenue de tumeurs
intestinales MSI ou de lymphomes MSI chez des patients souffrant de maladies
inflammatoires chroniques de l’intestin (MICI)5
[12, 13]. On estime actuellement que 100 000
personnes en sont atteintes en France (60 000 pour la MC, 40 000 pour la RCH). Ces
malades présentent un risque accru de développer un cancer colorectal comparés à la
population générale et le phénotype MSI est retrouvé dans une fraction significative
des tumeurs colorectales compliquant une MICI (avec une fréquence globale de 8,3 %,
dont 7,8 % chez les patients RCH et 9,6 % chez les patients atteints de MC) [12]. Ces tumeurs intestinales MSI qui
surviennent dans un contexte de MICI, ont des caractéristiques qui ressemblent à
celles des tumeurs MSI héréditaires (c’est-à-dire une survenue chez l’adulte jeune,
une perte d’expression d’une des 4 protéines MMR : MLH1, MSH2, MSH6 ou PMS2 ; les
cas sporadiques sont essentiellement liés à la perte d’expression de MLH1 dans la
tumeur par l' hyperméthylation de son promoteur) [14]. D’autres travaux connexes ont permis d’identifier la survenue de lymphomes MSI dans
un contexte de greffe d’organe, c’est-à-dire chez des patients ayant bénéficié d’un
don d’organe et ayant été ensuite traités par immunosuppresseurs au long cours
(thérapie anti-rejet dans un contexte post-greffe) [15]. Contrairement aux lympho-proliférations
liées à la résurgence du virus d’Epstein-Barr (EBV), qui sont précocement observées
après la greffe, les lymphomes MSI sont négatifs pour le virus, et ils surviennent
en moyenne plus de 5 ans après la greffe d’organe [16]. Sur un plan mécanistique, l’inactivation du MMR dans ces situations particulières est
favorisée du fait de processus génotoxiques. En effet, l’inflammation chronique
(dans le cas des MICI) ou la prise de certains médicaments (comme les thiopurines :
l’azathioprine [ImurelTM]) prescrits dans les MICI mais aussi chez les
patients greffés d’organes, induisent des adduits6 de l’ADN, en particulier la modification de guanines [17]. Ce processus conduit dans les
tissus des patients (les cryptes coliques, le tissu lymphoïde, etc.) à la génération
de mésappariements de bases, normalement reconnus par le système MMR mais qui ne les
répare pas efficacement. Les cellules accumulent ainsi des lésions sur leur l’ADN
qui conduisent à un arrêt du cycle cellulaire puis à la mort des cellules par
apoptose. C’est dans ce contexte que l’inactivation du système MMR représente un
mécanisme d’échappement à la mort cellulaire, conférant aux cellules dans lesquelles
il survient un avantage sélectif en culture, ce qui favorise leur transformation
via des processus découlant de l’instabilité microsatellitaire.
Ce scénario a été validé, en particulier dans un modèle animal par l’administration
de thiopurines (ImurelTM) à des souris, démontrant ainsi que ce type de
molécule contribuait à favoriser l’émergence de tumeurs MSI [14, 18]. |
Caractérisation des événements somatiques conduisant à la transformation des
cellules déficientes en MMR L’inactivation du système MMR ne constitue pas en tant que tel un événement
transformant. C’est l’accumulation dans l’ADN tumoral de mutations somatiques
engendrées par le phénotype MSI qui participe au processus de transformation
multi-étapes conduisant à générer une tumeur [2]. Dans les tumeurs MSI, l’instabilité génétique est élevée (environ
une centaine de mutations par mégabase en moyenne), à l’origine de nombreux
évènements somatiques, principalement dans les microsatellites. Ces altérations
somatiques microsatellitaires sont susceptibles de participer au développement
tumoral lorsqu’elles modifient la fonction de gènes ayant un rôle dans l’oncogenèse
[19, 20]. Il convient de noter également que
les tumeurs MSI accumulent des mutations somatiques récurrentes au niveau de
séquences génomiques non répétées, en particulier sur quelques gènes majeurs du
processus transformant (BRAF, KRAS, PIK3CA, APC, CTNNB1
7, etc.) [21]. Un répertoire des altérations liées au MSI au niveau de répétitions
microsatellitaires codantes (notion de gènes cibles de MSI) a pu être dressé [22]. Ces mutations affectent
de manière tissu-spécifique (le répertoire de mutations varie selon les cancers MSI
du côlon, de l’estomac, de l’endomètre) des gènes impliqués dans des processus
biologiques divers, comme la régulation du cycle et/ou de la prolifération
cellulaire (TGFBR2, IGF2R, TCF4, AXIN2, PTEN, RIZ,
etc.), la régulation de l’apoptose (BAX, CASP5, BCL10, APAF1, FAS,
etc.), de la réparation et la signalisation des dommages de l’ADN (RAD50,
BLM, MRE11, MSH3, MSH6, MBD4, MLH3, CHK1, ATR, etc.) (pour revue voir
[20]). L’instabilité des microsatellites
altère également des dizaines d’autres gènes cibles dont le rôle n’est pas forcément
pertinent dans ces cancers (pas de rôle dans la transformation maligne). Dans la
plupart des cas, les conséquences fonctionnelles de ces mutations sont encore mal
définies. Les travaux de génomique dédiés au CCR MSI et l’analyse des fréquences
mutationnelles de ces gènes dans l’ADN tumoral ont montré que seule une fraction
minoritaire de ces mutations présente une fréquence mutationnelle importante au
cours du développement du cancer et peut en conséquence représenter les gènes
majeurs du développement tumoral MSI [23, 24]. À l’heure actuelle, grâce à l’utilisation du séquençage à haut débit,
la recherche sur l’instabilité microsatellitaire progresse pour la caractérisation
de ces répertoires de mutations [25]. Certains des auteurs de cette revue ont été impliqués dans la
description fine de l’exome d’une large série de CCR MSI. Ce travail, qui a donné
lieu à la publication de la première analyse génomique à haut débit des CCR
MMR-déficients [26], a
permis d’identifier les mutations dont la fréquence émerge d’un bruit de fond
d’instabilité très important caractérisant ce type tumoral. Ces mutations somatiques
de séquences répétées ou non jouent probablement un rôle clé dans ces cancers
(sélection positive). Ce travail a montré également que la tumorigenèse MSI est un
processus complexe qui engendre aussi des altérations somatiques en nombre, dont la
fréquence s’est révélée être moins élevée qu’attendue (après prise en compte de la
taille et de la nature de ces répétitions à chaque fois dans le modèle) du fait de
leur caractère probablement délétère (sélection négative). |
Découverte de la mutation d’ HSP110 dans les CCR MSI et
caractérisation de son impact physiopathologique et clinique Les protéines chaperonnes, ou HSP (heat shock protein),
interviennent dans de très nombreux processus biologiques. Comme leur nom l’indique,
elles stabilisent les protéines en les chaperonnant, facilitant ainsi leur
repliement dans différentes conditions, les protégeant contre des phénomènes
d’agrégation protéique, ou favorisant leur catabolisme lorsqu’il s’agit de protéines
endommagées ou dégradées. L’expression des HSP est induite par des stress divers
(thermique, stress oxydant, agressions chimiques, irradiations, etc.). Chez les
mammifères, il existe plusieurs familles d’HSP, classées selon leur masse
moléculaire. Dans les cancers, le rôle des chaperonnes est pléiotrope. Elles sont
très souvent surexprimées et jouent un rôle oncogénique en permettant aux cellules
malignes de s’adapter à différentes conditions de stress, endogènes comme exogènes,
au cours du développement tumoral, y compris pendant la phase de traitement par
chimiothérapie (facteur de chimiorésistance) [27]. Les HSP participent activement à la
transformation tumorale par de nombreux mécanismes, et jouent aussi un rôle dans
l’immunité anti-tumorale, en étant en particulier sécrétées dans le milieu extra-
cellulaire [28]. En 2011, nous avons rapporté un fait assez surprenant concernant l’une de ces
protéines chaperonnes dans les cancers colorectaux (CCR) [29], avec l’identification d’une mutation d’un
gène codant une HSP spécifiquement dans les CCR de phénotype MSI. Cette mutation
représentait ainsi le premier exemple d’altération d’une chaperonne dans un cancer
chez l’homme. Elle touche le gène HSP110 (encore appelé
HSPH1), au niveau d’un microsatellite, T17, intronique et
localisé dans une séquence polypyrimidiques en amont du site accepteur d’épissage de
l’exon 9 (intron 8). Ce microsatellite est muté dans les ADN tumoraux de CCR MSI par
la délétion de 1 à 6 bases. Ces délétions alléliques du microsatellite T17 entraîne,
lorsqu’elles sont de grandes tailles (supérieures à 5 paires de bases, ou délétions
larges), un épissage aberrant de l’exon 9 par saut d’exon et
sont donc à l’origine de la synthèse d’une protéine tronquée (mutation
frameshift, création d’un codon STOP prématuré). Environ 30 %
des CCR MSI présentent de telles délétions larges de manière
bi-allélique dans l’ADN tumoral. Dans ces tumeurs, la protéine HSP110 sauvage n’est
de fait plus exprimée, ou à des niveaux très bas. Cette inactivation somatique
d’HSP110 a des conséquences majeures sur un plan fonctionnel.
En effet, les cellules nullizygotes pour HSP110 (mutées sur les
deux allèles) deviennent très sensibles au stress, comme un stress apoptotique, et
sont ainsi hyper-sensibles à des traitements par différents agents, incluant ceux
utilisés dans les protocoles de chimiothérapie (5-Fluorouracile et Oxaliplatine)
[29]. Cliniquement, nous avons pu
établir, dans le cadre d’analyses de cohortes de patients en provenance de
différents centres hospitaliers, en France et à l’étranger, que les malades
présentant un CCR n’exprimant plus significativement HSP110 (tumeur HSP110
large/large) étaient d’excellents répondeurs à la
chimiothérapie par 5-Fluorouracile utilisé seul et par FOLFOX (une combinaison de
5-Fluorouracile et d’Oxaliplatine) [30]. Ces résultats sont intrigants puisqu’ils révèlent de manière assez paradoxale que la
mutation d’une protéine chaperonne, fréquente dans les CCR MSI, générée par une
instabilité microsatellitaire somatique de l’ADN, est clairement délétère pour les
cellules tumorales et diminue leur capacité de résistance aux drogues. Ils suggèrent
le scénario selon lequel certaines mutations somatiques ne peuvent être évitées par
les cellules tumorales MSI au niveau de grands microsatellites comme le T17
d’HSP110 qui constituent des points obligatoires de mutations
dans ce modèle tumoral hyper-instable. Des cribles (analyse de l’exome tumoral,
profils de séquençage d’ARN [RNA-seq]) sont en cours, à la
recherche d’autres mutations délétères dont la survenue serait observée dans les
mêmes conditions, en particulier des mutations touchant les processus d’épissage.
Des travaux plus récents nous ont également permis de mettre en évidence d’autres
effets délétères de la mutation d’HSP110 dans les CCR MSI au cours
du développement tumoral [31]. |
Impacts pronostique et prédictif de réponse à la chimiothérapie du MSI L’amélioration du pronostic conféré par le statut MSI chez les patients atteints de
cancer colorectal a été évoqué dès les premières descriptions de ce type
d'instabilité génétique. Par la suite, de nombreuses études, rétrospectives pour la
plupart, incluant des patients avec un CCR de stade 2 ou 3 (tumeurs respectivement
avec ou sans envahissement ganglionnaire mais non métastatiques à d’autres organes)
[32], ou des patients
présentant un CCR tous stades confondus [33], ont également rapporté des survies prolongées en rapport
avec le statut MSI des tumeurs. Une méta-analyse fondée sur 31 études ayant inclus
au total 7 642 patients tous stades confondus, dont 1 277 MSI, a montré une
réduction de 35 % du risque de décès chez les patients MSI par rapport aux patients
ne présentant pas d’instabilité des microsatellites (MSS, stabilité des
microsatellites) [34]. Le
bénéfice de survie observé pour les patients MSI persistait lorsque l’analyse était
restreinte à ceux atteints d’une tumeur de stade 2 ou 3. Depuis la publication de l'essai MOSAIC8,
l’utilisation de l’oxaliplatine en combinaison avec le 5-Fluorouracile constitue le
traitement adjuvant de référence après la résection des CCR de stade 3 [35]. En revanche,
l’indication d’une chimiothérapie adjuvante pour les tumeurs de stade 2 reste moins
bien standardisée et limitée aux patients présentant des facteurs de haut risque de
récidive tumorale (stade T4 : présence d’une perforation tumorale, etc.). Les
modèles précliniques réalisés avec des lignées cellulaires ont suggéré que les
tumeurs MSI étaient associées à une résistance au 5-Fluorouracile. Plusieurs études
cliniques ont évalué le rôle du MMR dans la réponse au traitement adjuvant par
5-Fluorouracile chez les patients opérés pour un CCR de stade 2 ou 3. Des résultats
contradictoires ont été obtenus, rapportant pour certains un bénéfice du
5-Fluorouracile pour les tumeurs MSI [36], tandis que d’autres concluaient à l’absence d’efficacité,
voire à un effet potentiellement délétère pour les tumeurs MSI de stade 2 [32]. Dans une étude publiée en 2010, Sargent
et al. ont évalué l’influence du phénotype MSI à partir d'une
série de 457 patients inclus dans cinq essais randomisés évaluant le traitement
adjuvant par 5-Fluorouracile versus une chirurgie seule se résumant
à la résection d’un cancer du côlon de stade 2 et 3. Dans cette analyse, le
phénotype MSI versus MSS s’est révélé être un facteur prédictif de
résistance au 5-Fluorouracile, quel que soit le stade de la tumeur. Ces données ont
été combinées à celles obtenues antérieurement par Ribic et al.,
permettant d’augmenter la série à 1 027 patients traités pour un cancer du côlon de
stade 2 et 3 [32]. Cette analyse a confirmé
le bon pronostic du statut MSI ainsi que l’absence d’efficacité de la chimiothérapie
adjuvante par 5-Fluorouracile pour les tumeurs MSI de stade 3, voire un effet
délétère pour les tumeurs MSI de stade 2. Les premières études rétrospectives, dont
les nôtres [37], avaient
montré que l’addition de l’oxaliplatine au 5-Fluorouracile pouvait restaurer
l’efficacité de la chimiothérapie adjuvante pour les tumeurs MSI de stade 3. Ces
résultats ont ensuite été confirmé sur une large cohorte de 433 patients MSI de
stade 2 ou 3 traités par chirurgie seule ou associée à une chimiothérapie adjuvante
par fluoropyrimidine avec ou sans oxaliplatine [38]. L’utilisation d’une fluoropyrimidine seule
n’améliore pas la survie des patients par rapport au traitement chirurgical. En
revanche, l’adjonction de l’oxaliplatine à une fluoropyrimidine permet une
amélioration significative de la survie des patients présentant une tumeur de stade
3, mais pas de ceux ayant une tumeur de stade 2. Dans le cadre d’une étude
rétrospective multicentrique de 521 patients avec un CCR MSI non métastatique, 3
facteurs prédictifs de la survie sans récidive (SSR) ont été définis : l’occlusion
intestinale, la présence d’emboles vasculaires et un stade T4 [39], orientant la décision et les
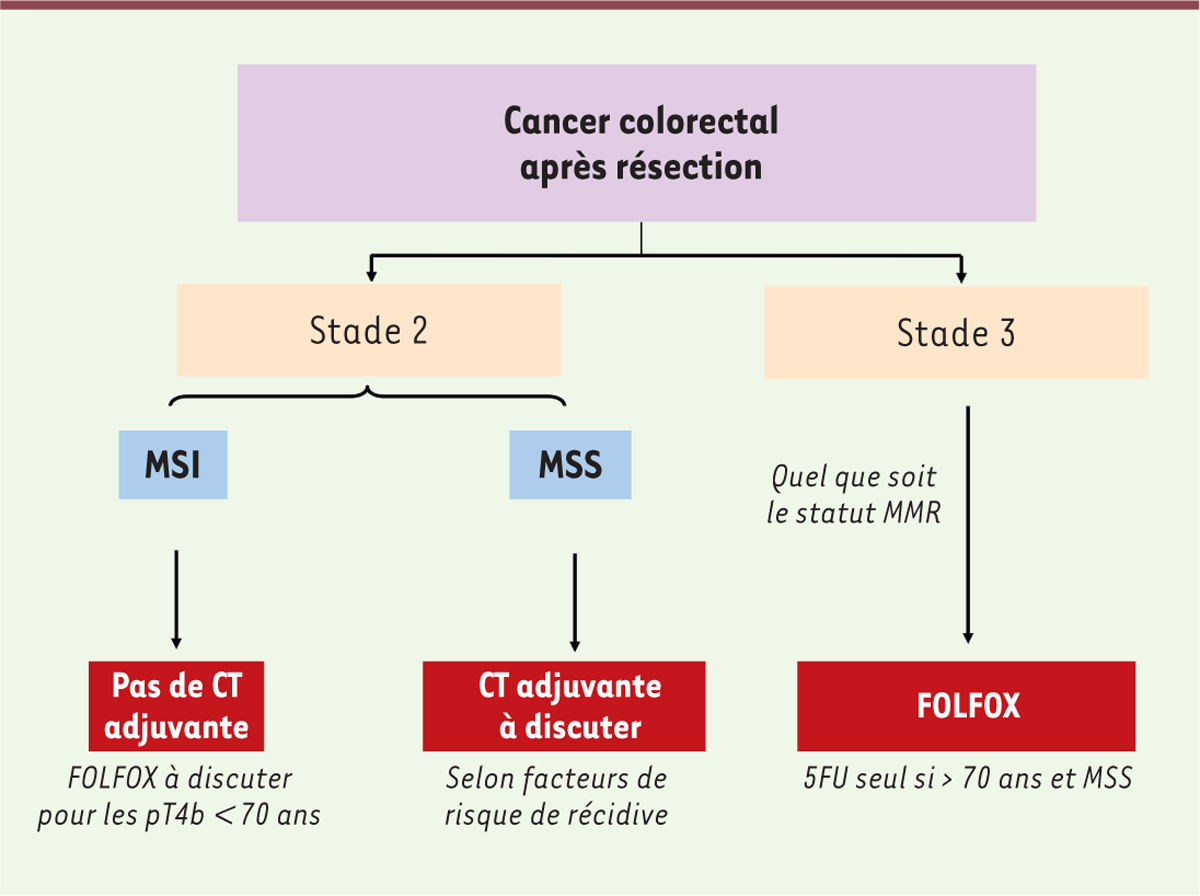
modalités de la chimiothérapie adjuvante dans ce type de cancer (Figure 2)
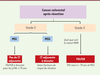 | Figure 2. Algorithme pour la décision thérapeutique de chimiothérapie adjuvante
dans les CCR de stade 2-3. CT : chimiothérapie. |
Des analyses rétrospectives réalisées sur des échantillons tumoraux de 1 008 patients
inclus dans l’étude MOSAIC, ont, par la suite, montré que l’adjonction de
l’oxaliplatine au 5-Fluorouracile apportait un bénéfice de survie à la fois pour les
tumeurs MSI et MSS. Plus récemment, une étude regroupant deux essais randomisés
ayant inclus 4 674 patients traités par FOLFOX avec ou sans cétuximab (un anticorps
monoclonal bloquant le récepteur du facteur de croissance épidermique, EGFR) pour
une tumeur de stade 3, a montré que le phénotype MSI, versus MSS,
était un facteur de bon pronostic, et cela quelle que soit l’origine de
l'inactivation du système MMR (sporadique ou familiale). D’autres études cliniques sont aujourd’hui en cours pour mieux définir l’intérêt
clinique de différents biomarqueurs dans les CCR MSI (identification de mutations ou
analyse d’expression en immunohistochimie)9.
Des protocoles de recherche clinique sont également élaborés afin d’étudier la
problématique des CCR MSI de stade 4 (stade métastatique). Le stade métastatique est
rarement atteint dans les CCR MSI (moins de 5 % des cas de CCR métastatiques), mais
il représente un stade particulièrement grave de la maladie (pronostic plus sombre
que celui des CCR MSS au même stade) [40]. Les analyses de cohortes10 en cours semblent indiquer que le pronostic et la chimiosensibilité
des CCR MSI métastatiques seraient différents de ceux des CCR MSS métastatiques,
mais ces résultats doivent être confirmés par des études prospectives. Récemment, un essai de phase 2 réalisé chez des patients avec une tumeur métastatique
a montré que le statut MSI était un facteur prédictif de réponse à l’immunothérapie
[6]. Le statut MSI/MSS de tumeurs isolées
de patients présentant un CCR métastatique, inclus dans un essai clinique
multicentrique afin de bénéficier d’un traitement par immunothérapie, a été contrôlé
[41]. Des erreurs
diagnostiques (diagnostic erroné à l’inclusion par les centres investigateurs) sur
le statut MSI de tumeurs qui étaient en fait MSS et avaient donc été incluses à tort
au sein de cette cohorte [42], ont été identifiées. La mise en évidence de ces erreurs
diagnostiques a permis, en particulier, d’expliquer l’absence de réponse au
traitement observée chez la majorité des patients hyperprogresseurs, venant donc
constituer la première cause de « résistance » à l’immunothérapie dans les CCR MSI
métastatiques. Ces résultats devront être vérifiés sur d’autres cohortes à
l’avenir. Le phénotype MSI dans les CCR est donc un marqueur moléculaire de bon pronostic, qui
semble également prédire l'absence d'efficacité de la chimiothérapie adjuvante par
le 5-Fluorouracile seul. Les récentes données cliniques suggèrent que l'adjonction
de l'oxaliplatine à un traitement par le 5-Fluorouracile pourrait rétablir le
bénéfice de la chimiothérapie adjuvante pour les patients avec un cancer du côlon
MSI de stade 3. Sur la base de ces données, les recommandations nationales
préconisent une chimiothérapie adjuvante par fluoropyrimdine plus oxaliplatine pour
les patients opérés d’un cancer du côlon de stade 3 quel que soit le phénotype MMR
(MSI ou MSS). Pour les patients avec un cancer du côlon de stade 2 présentant des
facteurs de haut risque de récidive, ceux dont la tumeur est MSS pourraient être
traités par fluoropyrimidine seule ou associée à l’oxaliplatine. En revanche,
l’indication d’une chimiothérapie adjuvante n’est pas retenue pour les tumeurs MSI
de stade 2, compte-tenu du bon pronostic et de l’inefficacité du 5-Fluorouracile
dans ce contexte. Une étude actuellement en cours11 évalue l’intérêt d’associer l’atezolimumab (un anticorps monoclonal
dirigé contre le ligand de PD-1, PD-L1) avec le FOLFOX après la résection d’un
cancer du côlon MSI de stade 2 (Tableau
I).
Tableau I.
| |
Stade 2 |
Stade 3 |
Stade IV |
| Pronostic général |
↗
|
≈
|
↘
|
|
| Réponse à la CT
MSI versus
MSS |
CT
5-Fluorouracile Folfox
↗↘ |
CT
5-Fluorouracile Folfox
↗↘ |
⁄
|
|
| Réponse à la CT
pour les sous-groupes des
CCR MSI
mutés sur HSP110 |
↗↗
|
↗↗
|
? |
|
| Réponse à l’immunothérapie
(anti-ICK) |
? |
? |
↗
|
Caractéristiques pronostiques et de réponse à la chimiothérapie des CCR
(MSI versus MSS). MSI : instabilité des microsatellites ; MSS :
stabilité des microsatellites ; CT : chimiothérapie ; anti-ICK :
anti-immunocheckpoint. |
|
Étude de l’infiltrat immunitaire des cancers colorectaux MSI Dans les tumeurs MSI et le cancer colorectal en particulier, l’instabilité
microsatellitaire produit un nombre important de protéines mutantes immunogènes. En
effet, les insertions/délétions typiquement générées du fait du statut MSI au niveau
des centaines de microsatellites codants sont à l’origine d’autant de décalages de
lecture (mutation frameshift) sur les transcrits des gènes cibles
correspondants. Les protéines mutantes ainsi traduites possèdent en conséquence des
extrémités C-terminales aberrantes néo-antigéniques qui sont reconnues comme telles
par le système immunitaire du patient [43]. L’expression de ces mutants est néanmoins régulée et il
existe, en particulier, des mécanismes de catabolisme dans la cellule qui
identifient et dégradent les ARN messager comportant un codon STOP prématuré, comme
ceux générés en nombre dans la cellule tumorale déficiente en MMR du fait de MSI. Ce
système, appelé NMD (nonsense mediated-mRNA decay), a une activité
importante dans la cellule tumorale MSI. Il permet la diminution de l’expression de
nombreux mutants favorisés par MSI dans la tumeur avec des conséquences à la fois
sur la croissance tumorale et la réponse immunitaire des patients. Il semble en
particulier que plus l’expression des facteurs du NMD est importante, plus celle des
néoantigènes produits par la cellule tumorale est diminuée, rendant la tumeur moins
visible par le système immunitaire (avec, en particulier, la diminution du nombre de
lymphocytes T CD3 infiltrants) [23, 24, 44]. Les CCR MSI présentent généralement un infiltrat lymphocytaire T important, par
rapport à ce qui est rencontré dans les CCR sans instabilité des microsatellites
(MSS). Nous avons montré que l’infiltrat T (lymphocytes CD3+) de ces
tumeurs est associé au nombre de mutations mais aussi à certaines mutations des
gènes cibles du MSI. Ces résultats suggèrent que plus le nombre de mutations est
important, plus il existe de lymphocytes T spécifiques, mais aussi qu’il existe des
mécanismes d’échappement à cette réponse immunitaire puisque le nombre de mutations
est également corrélé à la progression tumorale. Afin de caractériser plus
précisément les néo-antigènes immunogènes, nous avons analysé la relation entre
mutations cibles de l’instabilité microsatellitaire et infiltrats T CD8+
(lymphocytes T cytotoxiques) et Foxp3+ (lymphocytes T régulateurs, LTreg)
[45]. L’infiltrat T
cytotoxique augmente significativement avec le nombre de mutations ; il est associé
à des mutations qui décalent le cadre de lecture de certains gènes
(ASTE1, HNF1A, et TCF4),
suggérant l’établissement d’une réponse immunitaire spécifique vis-à-vis des
néo-antigènes produits à la suite de ces mutations. Il nous a paru important de connaître l’impact pronostique de l’infiltration
lymphocytaire dans ces tumeurs, notamment les lymphocytes T cytotoxiques et
régulateurs. Un faible infiltrat de LTreg Foxp3+ est associé à un stade
avancé et à des critères d’invasion métastatique précoce. Ces résultats surprenants
suggèrent que l’infiltrat T régulateurs, habituellement considéré comme
immunosuppresseur, est associé à une moindre invasivité tumorale dans les CCR MSI.
On peut penser que plus la réponse immunitaire est importante, plus les LTreg sont
nombreux et meilleur est le pronostic. Néanmoins, il est important de mieux
caractériser la réponse immunitaire dans ces tumeurs, ainsi que leurs mécanismes
d’échappement. Dans un travail collaboratif, nous avons caractérisé le profil
immunitaire de ces tumeurs [46]. Les CCR MSI ont un « immunoscore » élevé avec une forte réponse
lymphocytaire de type Th1, des taux importants de lymphocytes T mémoires mais
également une forte expression de molécules inhibitrices de la réponse immune, comme
PD-1 et PD-L1. L’interaction entre PD-1 et PD-L1 entraîne un épuisement fonctionnel
des lymphocytes T activés et représente un mécanisme d’échappement tumoral à la
réponse immunitaire des CCR MSI. Des essais thérapeutiques récents ont montré que
ces tumeurs sont très sensibles aux inhibiteurs de points de contrôle immunitaire
(immune checkpoint inhibitors) [6]. Toutes ces données générées sur l’immunité anti-tumorale des CCR MSI
seront bientôt validées par des études ancillaires adossées aux essais
thérapeutiques d’inhibiteurs de points de contrôle immunitaire, afin de mieux
comprendre l’efficacité particulière de ces traitements dans les tumeurs MSI. Cela
est déjà prévu dans le cadre d’un essai thérapeutique coordonné par la FFCD
(Fédération francophone de cancérologie digestive) avec un anticorps anti-PD-1 en
2e ligne, dans les CCR MSI métastatiques. Aujourd’hui, des analyses à haut débit de l’infiltrat immunitaire des tumeurs sont
développées avec des approches de séquençage d’ARN (RNA-seq) et de transcriptomique.
Dans une étude récente qui porte sur plus de 1 000 CCR, incluant 260 CCR MSI, en
provenance de 2 séries multi-centriques (1 cohorte en provenance du TCGA, 1 cohorte
française, série CIT), nous avons montré que c’est l’expression des points de
contrôle immunitaire (PD-1, PD-L1, IDO1, TIM3, LAG3) qui influence majoritairement
et négativement le pronostic dans les CCR MSI par rapport à d’autres marqueurs
immunitaires, dont ceux de l’immunoscore en particulier [47]. Dans les CCR MSS,
l’inverse se produit, avec un impact significatif de l’expression des marqueurs de
l’immunoscore (CD3 et CD8, en particulier), comme cela a déjà
été montré, et un impact mineur des points de contrôle. Ainsi, chez les patients
présentant un CCR, le pronostic de la maladie est déterminé par une balance entre
l’expression des marqueurs de l’immunoscore et celle des points de
contrôle, avec un impact clinique important de l’une ou de l’autre de ces
composantes antagonistes de la réponse immunitaire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Glossaire
|
APAF1 :
|
apoptotic peptidase-activating factor 1
|
|
APC :
|
adenomatous polyposis coli - APC regulator of WNT signaling
pathway
|
|
ASTE1 :
|
asteroid homolog 1
|
|
ATR :
|
ATR serine/threonine kinase
|
|
AXIN2 :
|
axin-related protein 2 or axis inhibition protein 2
|
|
BAX :
|
BCL2-associated X
|
|
BCL10 :
|
BCL10 immune signaling adaptor
|
|
BLM :
|
BLM RecQ like helicase
|
|
BRAF :
|
B-Raf proto-oncogene, serine/threonine kinase
|
|
CASP5 :
|
caspase 5 |
|
CHK1 :
|
checkpoint kinase 1
|
|
CMMRD :
|
constitutional mismatch repair deficiency syndrome
|
|
CTLA-4 :
|
cytotoxic T-lymphocyte-associated protein 4
|
|
CTNNB1 :
|
catenin beta 1
|
|
EGFR :
|
epidermal growth factor receptor
|
|
FAS :
|
Fas cell surface death receptor
|
|
FOXP3 :
|
forkhead box P3
|
|
HNF1A :
|
HNF1 homeobox A |
|
IDO1 :
|
indoleamine 2,3-dioxygenase 1
|
|
IGF2R :
|
insulin like growth factor 2 receptor
|
|
KRAS :
|
KRAS proto-oncogene, GTPase |
|
LAG3 :
|
lymphocyte activating 3
|
|
MBD4 :
|
methyl-CpG binding domain 4, DNA glycosylase
|
|
MGMT :
|
O6-methylguanine-DNA methyltransferase
|
|
MLH1 :
|
mutL homolog 1
|
|
MLH3 :
|
mutL homolog 3
|
|
MMR :
|
mismatch repair system
|
|
MRE11 :
|
MRE11 homolog, double-strand break repair nuclease
|
|
MSH2 :
|
mutS homolog 2
|
|
MSH3 :
|
mutS homolog 3
|
|
MSH6 :
|
mutS homolog 6
|
|
NMD :
|
nonsense-mediated mRNA decay
|
|
PD-1 :
|
programmed cell death 1
|
|
PD-L1 :
|
programmed cell death 1 ligand 1
|
|
PIK3CA :
|
phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic
subunit alpha
|
|
PMS2 :
|
PMS1 homolog 2, mismatch repair system component
|
|
PTEN :
|
phosphatase and tensin homolog
|
|
RAD50 :
|
RAD50 double strand break repair gene
|
|
RIZ :
|
PR/SET domain 2 (PRDM2) |
|
TCF4 :
|
transcription factor 4 |
|
TGFBR2 :
|
transforming growth factor beta receptor 2
|
|
TIM3 ou HAVCR2 :
|
hepatitis A virus cellular receptor 2
|
|
Footnotes |
1. Aaltonen
LA,
Peltomaki
P,
Leach
FS, et al.
Clues to the pathogenesis of familial colorectal
cancer . Science.
1993; ; 260 :
:812.–816. 2. Duval
A,
Hamelin
R. Mutations at
coding repeat sequences in mismatch repair-deficient human cancers: toward a
new concept of target genes for instability . Cancer
Res.
2002; ; 62 :
:2447.–2454. 3. Peltomaki
P,
Vasen
H. Mutations
associated with HNPCC predisposition: update of ICG-HNPCC/INSiGHT mutation
database . Dis Markers.
2004; ; 20 :
:269.–276. 4. Colas
C,
Coulet
F,
Svrcek
M, et al.
Lynch or not Lynch? Is that always a question? .
Adv Cancer Res.
2012; ; 113 :
:121.–166. 5. Hause
RJ,
Pritchard
CC,
Shendure
J,
Salipante
SJ. Classification
and characterization of microsatellite instability across 18 cancer
types . Nat Med.
2016; ; 22 :
:1342.–1350. 6. Le
DT,
Uram
JN,
Wang
H, et al.
PD-1 blockade in tumors with mismatch-repair
deficiency . N Engl J Med.
2015; ; 372 :
:2509.–2520. 7. Suraweera
N,
Duval
A,
Reperant
M, et al.
Evaluation of tumor microsatellite instability using five
quasimonomorphic mononucleotide repeats and pentaplex PCR .
Gastroenterology.
2002; ; 123 :
:1804.–1811. 8. Buhard
O,
Suraweera
N,
Lectard
A, et al.
Quasimonomorphic mononucleotide repeats for high-level
microsatellite instability analysis . Dis
Markers.
2004; ; 20 :
:251.–257. 9. Buhard
O,
Lagrange
A,
Guilloux
A, et al.
HSP110 T17 simplifies and improves the microsatellite instability
testing in patients with colorectal cancer . J Med
Genet.
2016; ; 53 :
:377.–384. 10. Bodo
S,
Colas
C,
Buhard
O, et al.
Diagnosis of constitutional mismatch repair-deficiency syndrome
based on microsatellite instability and lymphocyte tolerance to methylating
agents . Gastroenterology.
2015; ; 149 : (1017–29)
:e3.. 11. Canard
G,
Lefevre
JH,
Colas
C, et al.
Screening for Lynch syndrome in colorectal cancer: are we doing
enough? . Ann Surg Oncol.
2012; ; 19 :
:809.–816. 12. Svrcek
M,
El-Bchiri
J,
Chalastanis
A, et al.
Specific clinical and biological features characterize
inflammatory bowel disease associated colorectal cancers showing
microsatellite instability . J Clin Oncol.
2007; ; 25 :
:4231.–4238. 13. Svrcek
M,
Buhard
O,
Colas
C, et al.
Methylation tolerance due to an O6-methylguanine DNA
methyltransferase (MGMT) field defect in the colonic mucosa: an initiating
step in the development of mismatch repair-deficient colorectal
cancers . Gut.
2010; ; 59 :
:1516.–1526. 14. Chalastanis
A,
Penard-Lacronique
V,
Svrcek
M, et al.
Azathioprine-induced carcinogenesis in mice according to Msh2
genotype . J Natl Cancer Inst.
2010; ; 102 :
:1731.–1740. 15. Duval
A,
Raphael
M,
Brennetot
C, et al.
The mutator pathway is a feature of immunodeficiency-related
lymphomas . Proc Natl Acad Sci USA.
2004; ; 101 :
:5002.–5007. 16. Borie
C,
Colas
C,
Dartigues
P, et al.
The mechanisms underlying MMR deficiency in
immunodeficiency-related non-Hodgkin lymphomas are different from those in
other sporadic microsatellite instable neoplasms .
Int J Cancer.
2009; ; 125 :
:2360.–2366. 17. Beaugerie
L,
Svrcek
M,
Seksik
P, et al. Risk of
colorectal high-grade dysplasia and cancer in a prospective observational
cohort of patients with inflammatory bowel disease .
Gastroenterology.
2013;; 145 :
:166.–75e8. 18. Bodo
S,
Svrcek
M,
Sourrouille
I, et al.
Azathioprine induction of tumors with microsatellite instability:
risk evaluation using a mouse model .
Oncotarget.
2015; ; 6 :
:24969.–24977. 19. Duval
A,
Reperant
M,
Compoint
A, et al.
Target gene mutation profile differs between gastrointestinal and
endometrial tumors with mismatch repair deficiency .
Cancer Res.
2002; ; 62 :
:1609.–1612. 20. Hamelin
R,
Chalastanis
A,
Colas
C, et al.
Clinical and molecular consequences of microsatellite instability
in human cancers . Bull Cancer.
2008; ; 95 :
:121.–132. 21. Oliveira
C,
Pinto
M,
Duval
A, et al.
BRAF mutations characterize colon but not gastric cancer with
mismatch repair deficiency . Oncogene.
2003; ; 22 :
:9192.–9196. 22. Duval
A,
Iacopetta
B,
Thorstensen
L, et al.
Gender difference for mismatch repair deficiency in human
colorectal cancer . Gastroenterology.
2001; ; 121 :
:1026.–1027. 23. El-Bchiri
J,
Buhard
O,
Penard-Lacronique
V, et al.
Differential nonsense mediated decay of mutated mRNAs in mismatch
repair deficient colorectal cancers . Hum Mol
Genet.
2005; ; 14 :
:2435.–2442. 24. El-Bchiri
J,
Guilloux
A,
Dartigues
P, et al.
Nonsense-mediated mRNA decay impacts MSI-driven carcinogenesis
and anti-tumor immunity in colorectal cancers . PloS
One.
2008; ; 3 : :e2583.. 25. Kim
TM,
Laird
PW,
Park
PJ. The landscape of
microsatellite instability in colorectal and endometrial cancer
genomes . Cell.
2013; ; 155 :
:858.–868. 26. Jonchere
V,
Marisa
L,
Greene
M, et al.
Identification of positively and negatively selected driver gene
mutations associated with colorectal cancer with microsatellite
instability . Cell Mol Gastroenterol Hepatol.
2018; ; 6 :
:277.–300. 27. Whitesell
L,
Lindquist
SL. HSP90 and the
chaperoning of cancer . Nat Rev Cancer. ;
5 : :761.–72. 28. Yoshino
I,
Goedegebuure
PS,
Peoples
GE, et al.
Human tumor-infiltrating CD4+ T cells react to B
cell lines expressing heat shock protein 70 . J
Immunol.
1994; ; 153 :
:4149.–4158. 29. Dorard
C, de
Thonel
A,
Collura
A, et al.
Expression of a mutant HSP110 sensitizes colorectal cancer cells
to chemotherapy and improves disease prognosis . Nat
Med.
2011; ; 17 :
:1283.–1289. 30. Collura
A,
Lagrange
A,
Svrcek
M, et al. Patients
with colorectal tumors with microsatellite instability and large deletions
in HSP110 T17 have improved response to 5-fluorouracil-based
chemotherapy . Gastroenterology.
2014;; 146 :
:401.–11e1. 31. Berthenet
K,
Bokhari
A,
Lagrange
A, et al.
HSP110 promotes colorectal cancer growth through STAT3
activation . Oncogene.
2017; ; 36 :
:2328.–2336. 32. Sargent
DJ,
Marsoni
S,
Monges
G, et al.
Defective mismatch repair as a predictive marker for lack of
efficacy of fluorouracil-based adjuvant therapy in colon
cancer . J Clin Oncol.
2010; ; 28 :
:3219.–3226. 33. Gryfe
R,
Kim
H,
Hsieh
ET, et al.
Tumor microsatellite instability and clinical outcome in young
patients with colorectal cancer . N Engl J
Med.
2000; ; 342 :
:69.–77. 34. Popat
S,
Hubner
R,
Houlston
RS. Systematic
review of microsatellite instability and colorectal cancer
prognosis . J Clin Oncol.
2005; ; 23 :
:609.–618. 35. Andre
T,
Boni
C,
Mounedji-Boudiaf
L, et al.
Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment
for colon cancer . N Engl J Med.
2004; ; 350 :
:2343.–2351. 36. Elsaleh
H,
Joseph
D,
Grieu
F, et al.
Association of tumour site and sex with survival benefit from
adjuvant chemotherapy in colorectal cancer .
Lancet.
2000; ; 355 :
:1745.–1750. 37. Zaanan
A,
Costes
L,
Gauthier
M, et al.
Chemotherapy of advanced small-bowel adenocarcinoma: a
multicenter AGEO study . Ann Oncol.
2010; ; 21 :
:1786.–1793. 38. Tougeron
D,
Mouillet
G,
Trouilloud
I, et al. Efficacy
of adjuvant chemotherapy in colon cancer with microsatellite instability: A
large multicenter AGEO study . J Natl Cancer
Inst.
2016; :108.. doi: 10.1093/jnci/djv438. 39. Tougeron
D,
Sickersen
G,
Mouillet
G, et al.
Predictors of disease-free survival in colorectal cancer with
microsatellite instability: An AGEO multicentre study .
Eur J Cancer.
2015; ; 51 :
:925.–934. 40. Venderbosch
S,
Nagtegaal
ID,
Maughan
TS, et al.
Mismatch repair status and BRAF mutation status in metastatic
colorectal cancer patients: a pooled analysis of the CAIRO, CAIRO2, COIN,
and FOCUS studies . Clin Cancer Res.
2014; ; 20 :
:5322.–5330. 41. Overman
MJ,
Lonardi
S,
Wong
KYM, et al.
Durable clinical benefit with nivolumab plus ipilimumab in DNA
mismatch repair-deficient/microsatellite instability-high metastatic
colorectal cancer . J Clin Oncol.
2018; ; 36 :
:773.–779. 42. Cohen
R,
Hain
E,
Buhard
O, et al.
Association of primary resistance to immune checkpoint
inhibitors in metastatic colorectal cancer with misdiagnosis of
microsatellite instability or mismatch repair deficiency
status . JAMA Oncol.
2018; Nov 15. doi: 10.1001/jamaoncol.2018.4942. 43. Fridman
WH,
Pages
F,
Sautes-Fridman
C,
Galon
J. The immune
contexture in human tumours: impact on clinical outcome .
Nat Rev Cancer.
2012; ; 12 :
:298.–306. 44. Bokhari
A,
Jonchere
V,
Lagrange
A, et al.
Targeting nonsense-mediated mRNA decay in colorectal cancers with
microsatellite instability . Oncogenesis.
2018; ; 7 : :70.. 45. Maby
P,
Tougeron
D,
Hamieh
M, et al.
Correlation between density of CD8+ T-cell infiltrate
in microsatellite unstable colorectal cancers and frameshift mutations: a
rationale for personalized immunotherapy . Cancer
Res.
2015; ; 75 :
:3446.–3455. 46. Mlecnik
B,
Bindea
G,
Angell
HK, et al.
Integrative analyses of colorectal cancer show immunoscore is a
stronger predictor of patient survival than microsatellite
instability . Immunity.
2016; ; 44 :
:698.–711. 47. Marisa
L,
Svrcek
M,
Collura
A, et al.
The balance between cytotoxic T-cell lymphocytes and immune
checkpoint expression in the prognosis of colon tumors .
J Natl Cancer Inst.
2018 ; Jan;
1 : :110.. doi: 10.1093/jnci/djx136.
|