| |
| Med Sci (Paris). 35(6-7): 549–555. doi: 10.1051/medsci/2019096.Façonner l’intestin à partir des cellules souches
pluripotentes humaines Charlotte Flatres,1,2* Élise Loffet,1* Michel Neunlist,1 and Maxime M. Mahé1,3** 1UMR Inserm 1235, TENS (neuropathies du système nerveux
entérique et pathologies digestives), Inserm, Université de Nantes, Institut
des Maladies de l’Appareil Digestif, CHU de Nantes,
1, rue Gaston Veil,
44035Nantes Cedex 1,
France 2Service de pédiatrie générale et génétique médicale, CHRU de
Brest, Brest, France 3Division of Pediatric General and Thoracic Surgery,
Cincinnati Children’s Hospital Medical Center, 3333 Burnet Avenue, Cincinnati, OH45229États-Unis |

L’utilisation et la maîtrise des techniques de différenciation des cellules souches
pluripotentes humaines a permis des avancées conséquentes dans la génération de tissus
spécifiques. Il est aujourd’hui possible de différencier des cellules souches humaines
pluripotentes (hPSC) en structures tridimensionnelles appelées organoïdes. Ces
organoïdes sont des assemblages cellulaires capables de s’auto-renouveler et de
s’auto-organiser, ce qui leurs permet d’acquérir des fonctions similaires aux tissus
d’origine [1]. Les hPSC peuvent
ainsi être différenciées en organoïdes intestinaux qui présentent des caractéristiques
similaires à celles des différentes régions du tube digestif. Ces outils ouvrent donc de
nouveaux champs d’investigation dans l’étude du développement et de la physiopathologie
du tube digestif, et offrent de nouvelles perspectives en médecine de précision et
réparatrice [2]. Dans cette
revue, nous présentons les origines développementales du tube digestif humain et les
approches de différenciation dirigée des cellules souches pluripotentes humaines en
organoïdes intestinaux. Enfin, nous discutons les futures applications permises par les
organoïdes intestinaux dans l’étude du tube digestif et des maladies associées. |
Le tractus gastro-intestinal chez l’homme Un tube aux multiples fonctions Le tube digestif est un organe tubulaire, complexe, responsable des fonctions de
digestion et d’absorption. En contact direct avec le milieu extérieur, il joue
un rôle important de barrière en permettant le passage des nutriments tout en
prévenant celui de pathogènes. L’architecture du tube digestif, constituée de 4
tuniques successives, permet d’assurer l’ensemble de ces fonctions. La séreuse,
la couche la plus externe du tube, est accolée à la musculeuse qui est composée
de muscles lisses longitudinaux et circulaires. Ce compartiment intègre
également un système nerveux entérique (ENS) qui contrôle le mélange et la
propulsion du bol alimentaire grâce au phénomène de motricité intestinale. La
sous-muqueuse forme un tissu conjonctif lâche contenant des vaisseaux sanguins
et lymphatiques ainsi que les neurones et cellules gliales de l’ENS. Enfin, la
muqueuse, constituée d’un épithélium en contact direct avec la lumière
digestive, tapisse l’ensemble du tube digestif. Cet épithélium constitue une
barrière physique entre l’organisme et le milieu extérieur où se loge le
microbiote. Un système immunitaire participe également aux échanges entre l’hôte
et ce microbiote. Les fonctions de digestion et d’absorption sont assurées à
différents niveaux du tube grâce à sa spécialisation en différents organes
interconnectés [ 3]. Le
tube digestif se décompose, en effet, du pôle oral vers le pôle anal en :
œsophage, estomac, intestin grêle, côlon et rectum. Bien que ces organes
assurent des fonctions spécialisées, ils proviennent d’une même origine
embryonnaire. Les origines embryonnaires du tube digestif humain La formation du tube digestif commence à partir de la troisième semaine de
gestation et se termine vers la douzième semaine chez l’homme. Le tractus
gastro-intestinal, notamment l’épithélium digestif, est issu de la
différenciation d’un feuillet embryonnaire appelé endoderme [ 4]. Au cours de la formation de
l’endoderme, plusieurs voies de signalisation dont les voies Nodal,
fibroblast growth factor (FGF) et Wingless-related
integration site (WNT), sont activées [ 5]. Ce feuillet se replie sur lui-même pour
former un tube qui deviendra l’ébauche du tractus intestinal. À ce stade, le
tube digestif est composé de 3 segments : l’intestin primitif antérieur, moyen
et postérieur. Sa mise en place est orchestrée par la régulation temporelle et
spatiale de réseaux de gènes. Ainsi, plusieurs morphogènes sont exprimés selon
un gradient de concentration cranio-caudal, induisant l’expression de facteurs
de transcription spécifiques de chaque région de l’intestin primitif. Le tube
digestif continuera de se développer et de s’allonger au cours du développement
fœtal et pendant les premières années après la naissance (Figure 1).
 | Figure 1. Développement embryonnaire de l’intestin.
A. À 3 semaines de gestation, la
gastrulation commence et donne naissance aux trois feuillets
embryonnaires : l’ectoderme, le mésoderme et l’endoderme. Les tissus
dérivant de chaque feuillet sont présentés dans le tableau.
B..L’intestin primitif se
développe à partir de l’endoderme et apparaît vers la quatrième
semaine de gestation. C. Organogenèse
du tube digestif au cours du développement embryonnaire : le tube
digestif se développe en s’allongeant progressivement. |
|
Produire des organoïdes intestinaux à partir des cellules souches
pluripotentes Les cellules souches pluripotentes humaines Les cellules souches pluripotentes sont caractérisées par leur capacité clonale
d’auto-renouvèlement et de pluripotence. En d’autres termes, elles ont la
capacité de donner l’ensemble des cellules de l’organisme [ 6] ( →).
(→) Voir la Nouvelle de L. Coulombel, m/s n° 10, octobre 2009, page
798
Ces propriétés uniques rendent les cellules souches pluripotentes humaines (hPSC)
particulièrement intéressantes dans les domaines de la biologie du développement
et de l’ingénierie tissulaire [7]. Leur utilisation en recherche a été initiée à la fin des années
1990, avec l’isolement des cellules souches embryonnaires humaines (hESC) à
partir du blastocyste [8]. L’utilisation de ces cellules s’est par la suite étendue grâce à la
découverte en 2006, de la possibilité de reprogrammer des cellules somatiques en
cellules souches à pluripotence induite (iPSC) [9]. Grâce à leur pluripotence, il est
possible d’orienter le devenir cellulaire des hPSC en les exposant à des
facteurs spécifiques capables d’induire leur différenciation en cellules,
organes ou tissus souhaités. Mimer le développement du tube digestif in vitro La compréhension des mécanismes impliqués dans le développement intestinal permet
dorénavant de les reproduire in vitro en utilisant le potentiel
de différenciation des hPSC. Il est désormais possible d’orienter le devenir
intestinal par la différenciation dirigée des hPSC grâce à l’utilisation
séquentielle de facteurs de croissance qui activent les différentes voies de
signalisation impliquées dans le développement du tube digestif. La génération
d’un endoderme définitif, feuillet à l’origine de l’épithélium du tube digestif,
est ainsi possible par l’activation de la voie Nodal sous l’effet de l’Activine
A [ 10], un mimétique de
Nodal appartenant à la superfamille du TGFβ ( transforming growth factor
β). La formation de cet endoderme définitif est caractérisée, entre
autres, par l’expression des facteurs de transcription SOX17 ( SRY [sex
determining region Y]-Box 17) et FOXA2 ( forkhead box
A2) par les cellules après leur différenciation. L’endoderme ainsi
généré servira ensuite de plateforme pour la production des différentes régions
du tube. |
Régionalisation des organoïdes du tube digestif En poursuivant les étapes de différenciation qui suivent la génération d’endoderme
définitif, il est possible d’obtenir les différentes régions du tube digestif. L’œsophage La production d’organoïdes de l’œsophage (HEO) commence à partir de l’endoderme
définitif obtenu, par l’activation puis l’inhibition, séquentiellement, des
voies WNT, Notch, BMP ( bone morphogenetic protein) et de
l’acide rétinoïque (RA) [ 11, 12].
Cette activation conduit à la spécialisation de l’endoderme en intestin primitif
antérieur dorsal, le tissu à l’origine de l’œsophage. Les cellules expriment
alors le facteur de transcription SOX2 (sans expression de CDX2 [ caudal
type homeobox 2], marqueur de l’intestin primitif moyen et
postérieur), et se différencient ensuite en cellules de l’œsophage. Les HEO
obtenus expriment des marqueurs spécifiques de l’œsophage, comme SOX2, la
kératine 4 (KRT4) et TP63 ( tumor protein P63) et suivent le
développement de l’œsophage humain en formant un épithélium stratifié squameux
[ 11, 12] (Figure
2).
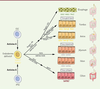 | Figure 2. Différenciation de différents tissus intestinaux in
vitro à partir de cellules souches pluripotentes induites
(iPSC) ou embryonnaires (hESC). Les cellules sont
différenciées en cellules de l’endoderme. Il est possible de générer
des organoïdes à l’identité œsophagienne, gastrique, intestinale ou
colique en les cultivant avec différents facteurs de
différenciation. |
L’estomac La production d’organoïdes gastriques (HGO), caractéristiques du
fundus ou de l’antre 1,
est également possible [ 13]. Comme pour les organoïdes de l’œsophage, les cellules de
l’endoderme sont spécifiées en endoderme définitif antérieur et moyen. Le tissu
obtenu sera ensuite postériorisé sous l’effet de RA pour former des sphéroïdes
qui expriment les facteurs de transcription SOX2 et HNF1β ( hepatocyte
nuclear factor-1β). Les régions de l’estomac se distinguent par
l’expression de PDX1 ( pancreatic and duodenal homeobox 1) qui
est exprimé dans l’antre (SOX2+/PDX1+) mais pas dans le fundus
(SOX2+/PDX1-) [ 14, 15]. Au stade précoce de
culture in vitro (13 jours), l’épithélium des HGO est
pseudostratifié. À un stade plus tardif (entre 13 et 34 jours), l’épithélium de
l’antre devient cylindrique, simple et organisé sous forme de glandes. Selon la
région de l’organoïde, l’épithélium gastrique est composé de cellules à mucus,
de cellules endocrines, de cellules G (sécrétant de la gastrine), de cellules
pariétales et de cellules principales, sécrétrices de pepsinogène. Les HGO
constituent un modèle robuste d’étude du développement et de la fonction de
l’estomac en condition physiologique mais aussi dans un contexte d’infection,
par exemple par la bactérie Helicobacter pilori [ 14] (Figure 2). Intestin grêle et côlon La génération d’organoïdes intestinaux in vitro à partir de hPSC
a été obtenue en 2011 par Spence et al. [ 16]. Elle est initiée à partir de
l’endoderme définitif par l’activation des voies WNT et FGF, et se traduit par
la formation de sphéroïdes intestinaux. Après inclusion dans un gel de matrice
extracellulaire ( Matrigel), les sphéroïdes forment des
structures intestinales complexes, les organoïdes intestinaux humains (HIO). Ces
HIO se caractérisent par la formation d’une lumière intestinale centrale
délimitée par une monocouche épithéliale constituée d’entérocytes et de cellules
sécrétrices, dont les cellules de Paneth (impliquées dans la défense vis-à-vis
des pathogènes présents dans la lumière intestinale), les cellules caliciformes
(ou cellules de Goblet, qui sécrètent le mucus), et les cellules
entéroendocrines. Bien que les HIO soient issus de l’endoderme définitif, ils
présentent autour de leur épithélium une couche de cellules mésenchymateuses qui
sont générées au cours du processus de différenciation. Le tissu obtenu est en
fait similaire à un intestin fœtal [ 17]. Transplanté chez des souris immunodéprimées, il se
développera pour former un tissu intestinal similaire à celui de l’intestin
grêle humain adulte [ 18]. L’acquisition de l’identité colique par les organoïdes est
également possible. Elle est réalisée par l’activation de la voie BMP afin de
dériver les cellules en intestin primitif postérieur, le tissu à l’origine du
tissu colique [ 18]. Le tissu obtenu
présente alors une morphologie semblable à celle du côlon humain. Il exprime,
entre autres, SATB2 ( special AT-rich sequence-binding protein
2), un marqueur distal spécifique. Après xéno-transplantation dans des
souris, l’épithélium des organoïdes coliques humains (HCO) s’organise en cryptes
similaires à celles du tissu colique humain. On retrouve au niveau de
l’épithélium, des cellules à mucus (qui sécrètent la mucine MUC2 spécifique du
côlon), des cellules entéroendocrines coliques (qui produisent le GLP1
[ glucagon-like peptide 1], le peptide YY [PYY], le
préproglucagon [GCG], et l’INSL5 [ insulin-like peptide 5], une
hormone spécifique du côlon), mais, comme dans le côlon humain, pas de cellules
de Paneth [ 19]
(Figure 2). |
Ajouter de la complexité aux organoïdes intestinaux Le système nerveux entérique Bien qu’il soit possible de produire des régions spécifiques du tube digestif à
partir des hPSC, le tissu obtenu ne comporte pas l’ensemble des composants du
microenvironnement cellulaire observés dans l’intestin humain. L’un des
composants majeurs du tube digestif est le système nerveux entérique (ENS), un
réseau neuro-glial qui l’innerve. Les cellules de l’ENS dérivent de la migration
des cellules de la crête neurale vagale à partir du tube neural, d’origine
ectodermique. Afin de reproduire l’ENS in vitro, les hPSC sont
donc tout d’abord différenciées en ectoderme puis en cellules de la crête
neurale. Les cellules obtenues sont ensuite postériorisées en activant la voie
RA, afin de leur donner une identité vagale [ 20]. Cultivées avec les sphéroïdes
intestinaux, ces cellules vont s’associer au mésenchyme des organoïdes. Ces
progéniteurs de l’ENS vont ensuite se différencier et donner des neurones et des
cellules gliales. Ce processus permet la mise en place d’un ENS fonctionnel avec
la formation de réseaux neuro-gliaux similaires aux plexus myentériques et
sous-muqueux retrouvés chez l’homme [ 20, 21].
Après xéno-transplantation, ces organoïdes intestinaux pourvus d’un ENS
présentent des réflexes neuromusculaires reproduisant des mouvements similaires
à l’activité péristaltique du tube digestif [ 20]. Les organoïdes intestinaux innervés permettent donc l’étude des
interactions entre l’ENS et les populations cellulaires du tube digestif et
constituent un nouveau modèle d’étude en neurogastroentérologie [ 22]. Les cellules immunitaires L’approche par différenciation dirigée ne permet pas de produire tous les types
cellulaires retrouvés dans le tissu intestinal. Les organoïdes
gastro-intestinaux ne comportent en effet pas de cellules immunitaires qui ont
une origine différente. Il est cependant possible de cultiver des organoïdes
intestinaux en présence de ces cellules et une étude récente a montré l’effet
positif de cellules lymphoïdes sur la maturation de ces organoïdes. La
production d’interleukine 2 (IL-2) par les cellules immunitaires en co-culture
induit en effet une augmentation de l’expression, par les organoïdes, des
marqueurs de l’épithélium digestif adulte dont des facteurs de transcription
(CDX2, SOX9 et ISX [ intestine specific homeobox]), des
marqueurs spécifiques de types cellulaires (entérocytes, cellules
entéroendocrines, cellules de Paneth et caliciformes), et une activité
fonctionnelle accrue [ 23]. Il est ainsi possible d’obtenir des organoïdes intestinaux
complexes pouvant associer toutes les interactions du tissu intestinal avec son
microenvironnement. Le microbiote intestinal Le microbiote est un constituant majeur de l’environnement intestinal. Il est
cependant absent des organoïdes produits in vitro. La culture
de ces structures étant réalisée en conditions stériles, il n’est pas possible
d’introduire un microbiote dans les organoïdes, ce qui les rend équivalent à un
intestin fœtal humain qui n’est pas encore colonisé. L’organoïde représente
néanmoins un modèle d’interactions hôte-pathogènes intéressant pour étudier
l’effet de bactéries sur le développement intestinal ou au cours d’infections
entériques [ 24]. Des
bactéries ou des virus peuvent ainsi être micro-injectés dans la lumière des
organoïdes. On peut alors évaluer leurs effets sur les fonctions de la barrière
épithéliale, comme la perméabilité intestinale [ 14, 25-28].
Hill et al. ont ainsi mis en évidence dans des organoïdes
colonisés avec une souche d’ Escherichia coli, une augmentation
de la production de peptides antimicrobiens, la maturation de la couche de mucus
et une augmentation de la fonction de barrière [ 27]. L’inoculation de Clostridium
difficile ou l’injection des toxines A et B de ce pathogène,
entraîne également une augmentation de la perméabilité paracellulaire dans les
organoïdes intestinaux [ 28]. L’ajout progressif de ces composants du microenvironnement
intestinal permet ainsi de découvrir leurs rôles et leurs fonctions sur la
maturation des tissus intestinaux (Figure
3). De nombreux acteurs du microenvironnement
intestinal, comme les vaisseaux sanguins, restent néanmoins encore à construire
afin de complexifier les organoïdes dérivés des hPSC.
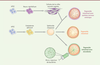 | Figure 3. Complexification du modèle organoïde. À partir des cellules souches
pluripotentes humaines (hPSC), les organoïdes gastro-intestinaux
peuvent être complexifiés par l’ajout de cellules du
microenvironnement comme le système nerveux entérique. L’étude des
interactions hôte-pathogènes est également possible par
micro-injection de bactéries dans le lumen des organoïdes. |
|
Le modèle des organoïdes gastro-intestinaux dérivés des hPSC permet la production
in vitro de tissu intestinal, non seulement de manière
tissu-spécifique, mais également avec une complexité ajustable. L’ajout modulable
d’un certain nombre de composants du microenvironnement (i.e. ENS,
système immunitaire et microbiote) favorise l’étude des interactions cellulaires et
moléculaires entre les différents éléments du tube digestif. Outre l’étude du
développement intestinal, les organoïdes intestinaux offrent de nouvelles
applications dans plusieurs domaines. En recherche clinique, ils permettent
notamment de modéliser des maladies spécifiques de patients. Les organoïdes peuvent
en effet être produits à partir des cellules de patients qui sont reprogrammées
(iPSC) mais qui conservent le génotype étudié [29]. Les organoïdes représentent ainsi un
modèle intégré pour l’étude de nombreuses pathologies humaines, comme les
entéropathies congénitales (e.g. dysplasie épithéliale intestinale, maladie des
inclusions microvillositaires), la maladie de Hirschsprung [20], ou encore les cancers colorectaux [30,31]. Ils constituent également un modèle d’interaction
hôte-pathogène pertinent pour l’étude des mécanismes d’infection à
Clostridium difficile [28] ou Helicobacter pylori [14,32]. Il est aussi possible de modifier génétiquement les organoïdes en
corrigeant des mutations grâce à la technologie CRISPR/Cas. Enfin, les organoïdes
gastro-intestinaux dérivés des hPSC représentent un intérêt majeur en ingénierie
tissulaire et en médecine réparatrice [33] (Figure
4). La combinaison de plusieurs types d’organoïdes (intestinaux,
hépatiques, cérébraux, etc.) constitue une piste intéressante pour le développement
de ces modèles. En particulier, l’utilisation des techniques de microfabrication et
de microfluidique conduisant à la création d’organ-on-chip, permet
de reproduire le fonctionnement physiologique d’un tissu ou d’un système entier
[34]. L’utilisation des
organoïdes dérivés des hPSC offre donc des perspectives prometteuses quant à la
compréhension des maladies humaines et la découverte de traitements efficaces.
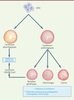 | Figure 4. Applications du modèle organoïde gastro-intestinal. L’utilisation des
organoïdes peut répondre à plusieurs problématiques. Les organoïdes
reproduisant les conditions physiologiques peuvent être utilisés en
recherche fondamentale et en médecine réparatrice. Les organoïdes
peuvent également être utilisés pour modéliser et étudier de multiples
pathologies. La production de modèles associés aux maladies génétiques
permet d’étudier le développement de ces maladies et leur réponse aux
traitements. La correction génétique (CRISPR/Cas9) est également
envisageable pour rétablir un phénotype normal. hPSC : cellules souches
pluripotentes humaines. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Fatehullah
A,
Tan
SH,
Barker
N. Organoids as an
in vitro model of human development and disease . Nat
Cell Biol.
2016; ; 18 :
:246.–254. 2. Picollet-D’hahan
N,
Dolega
ME,
Freida
D, et al.
Deciphering cell intrinsic properties: A key issue for robust
organoid production . Trends Biotechnol.
2017;; 35 :
:1035.–48. 3. Thompson
CA,
DeLaForest
A,
Battle
MA. Patterning the
gastrointestinal epithelium to confer regional-specific
functions . Dev Biol.
2018; ; 435 :
:97.–108. 4. Noah
TK,
Donahue
B,
Shroyer
NF. Intestinal
development and differentiation . Exp Cell
Res.
2011; ; 317 :
:2702.–2710. 5. Zorn
AM,
Wells
JM. Vertebrate
endoderm development and organ formation . Annu Rev.
Cell Dev Biol.
2009; ; 25 :
:221.–251. 6. Coulombel
L.. Pluripotence :
une définition à géométrie variable . Med Sci
(Paris).
2009; ; 25 :
:798.–801. 7. McCauley
HA,
Wells
JM. Pluripotent stem
cell-derived organoids: using principles of developmental biology to grow
human tissues in a dish . Development.
2017; ; 144 :
:958.–962. 8. Thomson
JA,
Itskovitz-Eldor
J,
Shapiro
SS, et al.
Embryonic stem cell lines derived from human
blastocysts . Science.
1998; ; 282 :
:1145.–1147. 9. Takahashi
K,
Yamanaka
S. Induction of
pluripotent stem cells from mouse embryonic and adult fibroblast cultures by
defined factors . Cell.
2006; ; 126 :
:663.–676. 10. D’Amour
KA,
Agulnick
AD,
Eliazer
S, et al.
Efficient differentiation of human embryonic stem cells to
definitive endoderm . Nat Biotechnol.
2005; ; 23 :
:1534.–1541. 11. Trisno
SL,
Philo
KED,
McCracken
KW, et al.
Esophageal organoids from human pluripotent stem cells delineate
Sox2 functions during esophageal specification . Cell
Stem Cell.
2018; ; 23 :
:501.–515.e7. 12. Zhang
Y,
Yang
Y,
Jiang
M, et al.
3D Modeling of esophageal development using human PSC-derived
basal progenitors reveals a critical role for Notch
signaling . Cell Stem Cell.
2018; ; 23 :
:516.–529.e5. 13. Broda
TR,
McCracken
KW,
Wells
JM. Generation of
human antral and fundic gastric organoids from pluripotent stem
cells . Nat Protoc.
2019; ; 14 :
:28.–50. 14. McCracken
KW,
Catá
EM,
Crawford
CM, et al.
Modelling human development and disease in pluripotent
stem-cell-derived gastric organoids . Nature.
2014; ; 516 :
:400.–404. 15. McCracken
KW,
Aihara
E,
Martin
B, et al.
Wnt/β-catenin promotes gastric fundus specification in mice and
humans . Nature.
2017; ; 541 :
:182.–187. 16. Spence
JR,
Mayhew
CN,
Rankin
SA, et al.
Directed differentiation of human pluripotent stem cells into
intestinal tissue in vitro . Nature.
2011; ; 470 :
:105.–109. 17. Finkbeiner
SR,
Hill
DR,
Altheim
CH, et al.
Transcriptome-wide analysis reveals hallmarks of human intestine
development and maturation in vitro and in vivo .
Stem Cell Reports.
2015; ; 4 :
:1140.–1155. 18. Watson
CL,
Mahe
MM,
Munera
J, et al.
An in vivo model of human small intestine using pluripotent stem
cells . Nat Med.
2014; ; 20 :
:1310.–1314. 19. Múnera
JO,
Sundaram
N,
Rankin
SA, et al.
Differentiation of human pluripotent stem cells into colonic
organoids via transient activation of BMP signaling .
Cell Stem Cell.
2017; ; 21 :
:51.–64.e6. 20. Workman
MJ,
Mahe
MM,
Trisno
S, et al.
Engineered human pluripotent-stem-cell-derived intestinal tissues
with a functional enteric nervous system . Nat
Med.
2017; ; 23 :
:49.–59. 21. Schlieve
CR,
Fowler
KL,
Thornton
M, et al.
Neural crest cell implantation restores enteric nervous system
function and alters the gastrointestinal transcriptome in human
tissue-engineered small intestine . Stem Cell
Reports.
2017; ; 9 :
:883.–896. 22. Mahe
MM. Engineering a
second brain in a dish . Brain Res.
2018; ; 1693 :
:165.–168. 23. Jung
KB,
Lee
H,
Son
YS, et al.
Interleukin-2 induces the in vitro maturation of human
pluripotent stem cell-derived intestinal organoids .
Nat Commun.
2018; ; 9 : :3039.. 24. Hill
DR,
Spence
JR. Gastrointestinal
organoids: understanding the molecular basis of the host-microbe
interface . Cell Mol Gastroenterol Hepatol.
2017; ; 3 :
:138.–149. 25. Karve
SS,
Pradhan
S,
Ward
DV, et al.
Intestinal organoids model human responses to infection by
commensal and Shiga toxin producing Escherichia coli .
PLoS One.
2017; ; 12 :
:e0178966.. 26. Holokai
L,
Chakrabarti
J,
Broda
T, et al.
Increased programmed death-ligand 1 is an early epithelial cell
response to Helicobacter pylori infection . PLoS
Pathog.
2019; ; 15 :
:e1007468.. 27. Hill
DR,
Huang
S,
Nagy
MS, et al. Bacterial
colonization stimulates a complex physiological response in the immature
human intestinal epithelium . eLife.
2017; :6.. 28. Leslie
JL,
Huang
S,
Opp
JS, et al.
Persistence and toxin production by Clostridium difficile within
human intestinal organoids result in disruption of epithelial paracellular
barrier function . Infect Immun.
2015; ; 83 :
:138.–145. 29. Finkbeiner
SR,
Spence
JR. A gutsy task:
generating intestinal tissue from human pluripotent stem
cells . Dig Dis Sci.
2013; ; 58 :
:1176.–1184. 30. Crespo
M,
Vilar
E,
Tsai
SY, et al.
Colonic organoids derived from human pluripotent stem cells for
modeling colorectal cancer and drug testing . Nat
Med.
2017; ; 23 :
:878.–884. 31. Sommer
CA,
Capilla
A,
Molina-Estevez
FJ, et al.
Modeling APC mutagenesis and familial adenomatous polyposis using
human iPS cells . PLoS One.
2018; ; 13 :
:e0200657.. 32. Bertaux-Skeirik
N,
Feng
R,
Schumacher
MA, et al.
CD44 plays a functional role in Helicobacter pylori-induced
epithelial cell proliferation . PLoS Pathog.
2015; ; 11 :
:e1004663.. 33. Nakamura
T,
Sato
T. Advancing
intestinal organoid technology toward regenerative medicine .
Cell Mol Gastroenterol Hepatol.
2018; ; 5 :
:51.–60. 34. Ingber
DE. Developmentally
inspired human organs on chips . Development.
2018; :145.. pii:
dev156125.. |